Генетические факторы в развитии диабетической полиневропатии при сахарном диабете 1-го типа
- Аннотация
- Статья
- Ссылки
- English
Цель – оценить ассоциации полиморфных маркеров генов-кандидатов SOD2 Ala16Val (rs4880) и IL-1082 G/A (rs1800896) у больных ДПН на фоне СД 1-го типа в узбекской популяции.
Материал и методы. Генетические тесты проведены у 74 пациентов, находившихся на стационарном лечении в эндокринологическом диспансере Бухарской области. Проанализирована частота встречаемости аллелей и генотипов SOD2 Ala16Val (rs4880) и IL-1082 G/A (rs1800896) у больных ДПН на фоне СД 1-го типа и практически здоровых лиц в узбекской популяции.
Результаты. Среди изученных полиморфных маркеров в данной выборке генотип Val/Val SOD2 Ala16Val (rs4880) может служить маркером предрасположенности к развитию ДПН, поскольку именно он был значимым при сравнении показателей больных ДПН и здоровых лиц.
Заключение. В связи с выявлением ассоциаций между вариантами гена SOD2 Ala16Val (rs4880) и ДПН необходимо дальнейшее комплексное изучение генов, кодирующих супероксиддисмутазу, для разработки новых направлений в диагностике, профилактике и персонификации лечения данного заболевания.
Цель – оценить ассоциации полиморфных маркеров генов-кандидатов SOD2 Ala16Val (rs4880) и IL-1082 G/A (rs1800896) у больных ДПН на фоне СД 1-го типа в узбекской популяции.
Материал и методы. Генетические тесты проведены у 74 пациентов, находившихся на стационарном лечении в эндокринологическом диспансере Бухарской области. Проанализирована частота встречаемости аллелей и генотипов SOD2 Ala16Val (rs4880) и IL-1082 G/A (rs1800896) у больных ДПН на фоне СД 1-го типа и практически здоровых лиц в узбекской популяции.
Результаты. Среди изученных полиморфных маркеров в данной выборке генотип Val/Val SOD2 Ala16Val (rs4880) может служить маркером предрасположенности к развитию ДПН, поскольку именно он был значимым при сравнении показателей больных ДПН и здоровых лиц.
Заключение. В связи с выявлением ассоциаций между вариантами гена SOD2 Ala16Val (rs4880) и ДПН необходимо дальнейшее комплексное изучение генов, кодирующих супероксиддисмутазу, для разработки новых направлений в диагностике, профилактике и персонификации лечения данного заболевания.




Введение
Диабетическая полиневропатия (ДПН) представляет собой серьезную медико-социальную проблему. Поражение нервной системы при сахарном диабете (СД) 1-го типа сопровождается симптоматикой, значительно снижающей качество жизни многих пациентов [1–3]. ДПН при СД 1-го типа лишь условно считается его осложнением, поскольку функциональные нарушения периферической нервной системы наблюдаются уже в дебюте заболевания, что связано с высокой чувствительностью нервных клеток к повышенной концентрации глюкозы [4–6].
Генетическая предрасположенность к развитию ДПН при СД 1-го типа обусловлена наследованием определенных аллелей обычных здоровых генов. Иногда аллели, определяющие предрасположенность к развитию ДПН при СД 1-го типа и связанные с заболеванием, называют этиологическими мутациями/вариантами. Этиологические варианты широко распространены в популяции, но каждый из них сам по себе не приводит к развитию заболевания. Только наличие определенной комбинации этиологических вариантов в целом ряде генов, определяющих предрасположенность к заболеванию и его осложнений, может приводить к физиологическим нарушениям, а следовательно, развитию ДПН при СД 1-го типа [6–8].
В связи с этим особое внимание уделяется изучению генетической предрасположенности к развитию осложнений СД 1-го типа с использованием полиморфных маркеров различных генов-кандидатов, то есть генов, чьи белковые продукты могут потенциально вовлекаться в патогенез какого-либо заболевания. Для каждой многофакторной и полигенной патологии круг генов-кандидатов строго очерчен [8–11].
Исследование генов-кандидатов позволяет определить, существуют ли для данной патологии в конкретной популяции предрасполагающие или предохраняющие генетические факторы (маркеры) и можно ли с помощью этих маркеров предсказать развитие болезни и ее осложнений задолго до появления симптомов, то есть прогнозировать течение заболевания. Исследования маркеров, в частности биохимических, проводятся при различных заболеваниях нервной системы в разных странах, в том числе в Узбекистане и России [12].
Ген SOD2 кодирует антиоксидантный фермент, который играет важную роль в защите клеток от повреждений, вызванных свободными радикалами. В то же время ген IL-10 кодирует цитокин, регулирующий иммунную систему и воспаление.
Проведение сравнительного анализа распределения частоты встречаемости генотипов SOD2 Ala16Val (rs4880) и IL-1082 G/A (rs1800896) среди пациентов с ДПН на фоне СД 1-го типа и практически здоровых людей может помочь понять, как генетические варианты этих генов связаны с риском развития ДПН у пациентов с СД 1-го типа.
Цель – изучить ассоциации полиморфных маркеров генов-кандидатов SOD2 Ala16Val (rs4880) и IL-1082 G/A (rs1800896) у больных ДПН на фоне СД 1-го типа.
Материал и методы
Проанализирована частота встречаемости аллелей и генотипов SOD2 Ala16Val (rs4880) и IL-1082 G/A (rs1800896) у пациентов основной (ДПН на фоне СД 1-го типа) и контрольной групп (практически здоровые лица). Исследована ассоциация полиморфных маркеров данных генов с развитием ДПН при СД 1-го типа в узбекской популяции (Бухара). Генетические анализы выполнены у 74 пациентов, находившихся на стационарном лечении в эндокринологическом диспансере Бухарской области. Для анализа распределения частоты встречаемости генотипов и аллелей генов определяли размер выборок пациентов основной и контрольной групп. Материалом для выделения ДНК служила венозная кровь из локтевой вены объемом 3–5 мл (для забора крови использовали вакьютайнеры Beckton-Dickinson) с антикоагулянтом/консервантом 15%-ным трикалиевым EDTA (ethendianin-tetraacetic acid). Геномную ДНК получали двухэтапным методом лизиса клеток крови. Выполнены генотипирование для определения генотипов SOD2 Ala16Val (rs4880) и IL-1082 G/A (rs1800896) методом ПЦР и последующее секвенирование. Распределение генотипов в исследуемых полиморфных локусах изучали с помощью логистического регрессионного анализа и проверки на соответствие равновесию Харди – Вайнберга на основании точного теста Фишера. Учитывали соответствие пациентов исследуемых групп по полу и возрасту. Статистически значимыми считали различия при p < 0,05.
Результаты
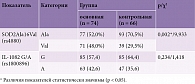
Выполнен сравнительный анализ аллельного распределения гена SOD2 Ala16Val (rs4880) у пациентов основной (ДПН и СД 1-го типа) и контрольной групп (табл. 2). При оценке аллельного распределения гена SOD2 Ala16Val (rs4880) у больных основной группы по сравнению с пациентами контрольной группы выявлены статистически значимые различия (p = 0,002) (используемый метод: Хи-квадрат Пирсона ≥ 9,933). Эти данные свидетельствуют об отчетливой ассоциации между наличием данных аллельных вариантов и развитием ДПН в исследуемой выборке (рис. 1).
В контрольной группе относительный риск наличия аллеля Val был ниже, чем в основной. Различия в показателе OR были статистически значимыми (отношение шансов 0,455; 95%-ный доверительный интервал (ДИ) 0,278–0,745). Это указывает на значительное различие в распределении аллелей между двумя группами (рис. 1).
Аллельное распределение гена SOD2 Ala16Val (rs4880) может рассматриваться как перспективное направление при комплексном изучении развития ДПН у пациентов с СД. Такой анализ призван помочь в понимании генетических факторов, влияющих на развитие осложнений при СД. Результаты исследования могут быть полезны для разработки новых подходов к лечению и профилактике ДПН.
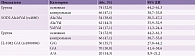
Затем был проведен сравнительный анализ распределения аллелей гена IL-10-1082 G/A (rs1800896) у пациентов обеих групп. При сравнении распределения аллелей гена IL-10-1082 G/A (rs1800896) между пациентами основной и контрольной групп не обнаружено статистически значимых различий (p = 0,234) (табл. 1, рис. 2).
Частота встречаемости G-аллеля в основной группе составила 57,4%, в контрольной – 64,4%. Однако различия в показателях OR не достигли статистической значимости. Статистически значимого различия в частоте встречаемости G-аллеля между группами не установлено. Вероятно, нет оснований полагать, что наличие или отсутствие этого аллеля связано с изучаемым заболеванием.
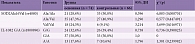
Сравнительный анализ распределения частоты встречаемости генотипов SOD2 Ala16Val (rs4880) и IL-1082 G/A (rs1800896) среди пациентов обеих групп представлен в табл. 2, частота встречаемости анализируемых генотипов генотипов гена супероксиддисмутазы 2 – в табл. 3. При сравнительном анализе распределения частоты встречаемости генотипов гена SOD2 Ala16Val (rs4880) в группах статистически значимые различия в частоте встречаемости генотипа Val/Val не установлены (p = 0,017) (используемый метод: Хи-квадрат Пирсона ≥ 5,699). В то же время генотип Ala/Ala гена SOD2 Ala16Val (rs4880) в контрольной группе наблюдался чаще, чем в основной (p = 0,008) (используемый метод: Хи-квадрат Пирсона ≥ 6,883) (рис. 3).
Кроме того, выполнен сравнительный анализ распределения частоты встречаемости генотипов гена IL-10-1082 G/A (rs1800896) в группах. При сравнении распределения частоты встречаемости генотипов гена IL-10-1082 G/A (rs1800896) значимые различия в группах не выявлены (табл. 3, рис. 4).
На основании полученных данных можно сделать вывод, что в исследуемой выборке больных ДПН значимыми предрасполагающими маркерами были аллель Val и гомозиготный генотип Val/Val гена SOD2 Ala16Val (rs4880).
Обсуждение
В ходе исследования мы провели сравнительный анализ частоты встречаемости аллельных вариантов и генотипов полиморфных маркеров SOD2 Ala16Val (rs4880) и IL-10-1082 G/A (rs1800896) у больных ДПН на фоне СД 1-го типа и пациентов контрольной группы. Как показали результаты, среди изученных полиморфных маркеров в данной выборке генотип Val/Val SOD2 Ala16Val (rs4880) служил отчетливым маркером предрасположенности к развитию ДПН, поскольку именно данный генотип был значимым при сравнении пациентов исследуемых групп.
Заключение
На основании полученных результатов можно сделать вывод о высокой вероятности ассоциации данного полиморфизма с развитием исследуемых патологий. В связи с выявлением таких ассоциаций между частотой встречаемости описанных вариантов гена SOD2 Ala16Val (rs4880) и ДПН необходимо дальнейшее комплексное изучение генов, кодирующих супероксиддисмутазу. Возможно, это окажется полезным для разработки новых направлений в диагностике, профилактике и персонификации лечения данного тяжелого мультисистемного заболевания [13–15].
Ранее основное внимание в аспекте генетических исследований уделялось моногенным заболеваниям, наследуемым по закону Менделя, в том числе и нашим коллективом [16]. Сегодня все больше работ посвящено изучению патогенеза и диагностике заболеваний с полигенным наследованием [17], фармакологическим и нефармакологическим методам помощи пациентам, что наглядно прослеживается на примере ДПН [18].
Генетически ассоциированные осложнения СД вызывают интерес у мировых исследователей. Так, в последних публикациях малайзийские авторы рассматривали мутации в генах SOD2 и IL-10 [19]. Ранее было показано, что SOD2 защищает нейроны от повреждения в клеточных культурах и на животных моделях диабетической невропатии [20]. В России работы в этом направлении ведутся более 20 лет [21, 22]. Описаны предрасполагающие к ДПН генетические факторы у пациентов с СД 1-го типа, включая полиморфизмы в генах SOD2 и SOD3.
Таким образом, в современном мире повышается роль оценки и интерпретации индивидуальных генетических особенностей, включая поиск генетических маркеров для прогнозирования, профилактики и персонификации подходов к ведению пациентов c тяжелыми инкурабельными заболеваниями. В частности, представляет интерес сравнение различных популяций. Представленные данные по узбекской популяции заслуживают дальнейшего изучения и обсуждения.
Sh.B. Аkhrorova, L.R. Akhmadeeva, PhD, Prof., M.R. Ruzibakieva, PhD, E.N. Akhmadeeva, PhD, Prof., М.М. Мukhsinov
Bukhara State Medical University
Bashkir State Medical University
Institute of Human Immunology and Genetics of the Academy of Sciences of the Republic of Uzbekistan
Contact person: Leila R. Akhmadeeva, Leila_ufa@Mail.ru
Genetic associations in diabetes mellitus (DM) and its complications, including diabetic polyneuropathy (DPN) are a relevant and widely discussed topic in the world due to the prospects of using DNA analysis to personalize care programs for such patients. The superoxide dismutase 2 (SOD2) and interleukin 10 (IL-10) genes are of interest as possible candidate genes for studying clinical genetic comparisons in various diseases, including DPN, and have been previously studied in various populations.
Purpose of this work is to study the association of polymorphic markers of candidate genes SOD2 Ala16Val (rs4880) and IL-1082 G/A (rs1800896) in patients with DPN in type 1 diabetes patients in the Uzbek population.
Material and methods. Genetic tests were carried out on 74 patients undergoing inpatient treatment at the endocrinology clinic in the Bukhara region. We analyzed the frequency of occurrence of alleles and genotypes of SOD2 Ala16Val (rs4880) and IL-1082 G/A (rs1800896) in patients with DPN in type 1 diabetes in comparison with practically healthy individuals in the Uzbek population.
Results. The study showed that among the studied polymorphic markers, in this sample the Val/Val SOD2 Ala16Val (rs4880) genotype can serve as a marker of susceptibility to the development of DPN, since this particular genotype was significant when comparing the group of patients with DPN with indicators of healthy population controls.
Conclusion. Since we identified the associations between variants of the SOD2 gene Ala16Val (rs4880) and DPN in this study, further comprehensive analises of the genes encoding superoxide dismutase are necessary to develop new approaches to the diagnosis, prevention and personalized treatment of this disease.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.