Возможность применения препарата Ипигрикс у пациентов с диабетической полиневропатией
- Аннотация
- Статья
- Ссылки
- English
Введение
Сахарный диабет (СД) 2-го типа представляет собой серьезную медико-социальную проблему вследствие широкой распространенности и выраженности проявлений в дальнейшем. Наблюдается неуклонный рост числа больных СД 2-го типа, что обусловлено малоподвижным образом жизни, неадекватным рационом, ожирением и метаболическим синдромом [1, 2]. По прогнозам, число пациентов с СД 2-го типа в течение последующих трех десятилетий удвоится [3]. Сегодня в мире насчитывается свыше 400 млн человек с этим заболеванием. К 2045 г. его распространенность увеличится более чем на 51% [4]. Ведущими причинами неблагоприятных исходов, связанных с СД 2-го типа, являются макро- и микрососудистые осложнения. При этом основной причиной смерти считается сердечно-сосудистая патология [5, 6].
Имеются данные о том, что увеличение риска сердечно-сосудистой смерти связано с поражением периферической нервной системы – диабетической полиневропатией (ДПН) с вовлечением вегетативных нервных волокон. Максимальный риск наступления неблагоприятного исхода имеет место у пациентов с кардиальной вегетативной невропатией (КВН), которая часто наблюдается на фоне СД 2-го типа [7, 8]. Сама по себе дистальная симметричная ДПН – инвалидизирующее осложнение диабета, которое часто проявляется тяжелым невропатическим болевым синдромом и в значительной степени снижает качество жизни пациентов. Хорошо известно, что поражение периферического отдела вегетативной нервной системы обусловлено высоким риском инфекционных осложнений, ампутацией нижней конечности вследствие развития язв (диабетическая стопа), внезапных падений [9]. Кроме того, дисфункция периферической вегетативной нервной системы, в частности КВН, связана с повышенным риском сердечно-сосудистой смерти [10, 11]. В качестве причин наступления смертельного исхода у пациентов с КВН рассматривают развитие сердечной аритмии и тяжелой ортостатической гипотензии [12]. Дисфункция вегетативной иннервации сосудистой системы головного мозга является важным фактором развития нарушения ауторегуляции его кровообращения, состояния, ассоциированного с развитием как острых, так и хронических форм цереброваскулярной патологии, в том числе сосудистой деменции и деменции смешанного типа [13]. Важно также, что при нарушении чувствительной и вегетативной иннервации миокарда у больных со стенозирующим поражением коронарных артерий увеличивается риск развития безболевой ишемии миокарда, что объясняется высоким риском развития инфаркта.
Различные формы ДПН и других вариантов поражения периферической нервной системы развиваются на протяжении жизни примерно у половины больных СД 2-го типа и 55–59% пациентов с СД 1-го типа [14–16]. Еще большая распространенность поражения периферических нервов при СД 2-го типа, в частности их субклинических форм, установлена в ходе исследований, проведенных с использованием методов электрофизиологической диагностики [17]. Показано, что распространенность различных форм невропатий, связанных с СД 2-го типа, достигает 8% среди пациентов с впервые выявленным заболеванием [18]. При этом вегетативная ДПН, в том числе КВН, равно как и дистальная симметричная ДПН, может развиваться уже на стадии предиабета [19]. Несмотря на высокий риск наступления смертельного исхода у пациентов с КВН, а также частое поражение у них различных внутренних органов (помимо миокарда – сетчатка глаза, почки, головной мозг и т.д.), диагностика данного состояния нередко оказывается несвоевременной, когда изменения периферической нервной системы приобретают необратимый характер [12, 20].
Поражение периферической нервной системы у пациентов с СД 2-го типа обусловлено сложными патогенетическими механизмами, которые включают в себя не только непосредственно гипергликемию, но и другие метаболические расстройства (окислительный стресс, активация полиолового пути и проч.), нарушения микроциркуляции, дефицит ряда необходимых для нормального функционирования организма веществ, в частности витаминов группы B [15]. В силу ряда причин вегетативная ДПН развивается в соответствии с принципом раннего поражения длинных нервных волокон, имеющих богатую миелиновую оболочку [21].
Клинические проявления и диагностика ДПН
Поскольку наиболее длинные миелинизированные нервные волокна входят в состав блуждающего нерва, который обеспечивает значительный объем парасимпатической иннервации внутренних органов, клиническая картина вегетативной ДПН, в том числе КВН, характеризуется преобладанием симпатических влияний в условиях различной степени выраженности парасимпатической денервации [22].
Выявление симптомов вегетативной ДПН объективно затруднено, нередко из-за недооценки связанного с ней риска в отношении здоровья пациента. Поэтому данное состояние не всегда диагностируется своевременно, тем более на ранних стадиях. Большое значение имеет целенаправленный сбор анамнестических сведений, в частности выявление тахикардии покоя, не связанной с физической нагрузкой, внезапное увеличение частоты сердечных сокращений (ЧСС), повышение артериального давления (АД), плохая переносимость физических нагрузок. Существенную помощь в постановке диагноза может оказать выявление нарушений со стороны желудочно-кишечного тракта (ощущение переполнения желудка при приеме относительно небольшого/привычного количества пищи, замедление эвакуации содержимого желудка, склонность к запорам, расстройства тазовых функций, в частности нарушение эрекции).
Инструментальная лабораторная диагностика вегетативной ДПН в условиях реальной клинической практики достаточно сложна и трудоемка. В аспекте влияния, оказываемого вегетативной нервной системой на уровень системного АД, понятен интерес к разработке методов регистрации АД при функциональных нагрузках. Данные о нарушении регуляции системного АД у пациентов с СД 2-го типа послужили основанием для проведения исследования долгосрочной прогностической ценности различных вариантов его суточного ритма при данном заболевании. С этой целью были ретроспективно обследованы 349 амбулаторных пациентов с СД, у которых оценивалось наличие микрососудистых осложнений [23]. Уровень и характер суточной динамики АД анализировали на основании результатов его 24-часового амбулаторного мониторирования. Медиана длительности наблюдения составила 21 (1,1–22,0) год (всего 6251 человеко-лет наблюдения), средний возраст обследованных – 57,1 ± 11,9 года, из них 52% женщин. У 81,4% имел место СД 2-го типа, у 18,6% – СД 1-го типа. За период наблюдения умерли 136 (39%) пациентов. Наиболее высокая распространенность хронической болезни почек, КВН и постуральной гипотензии зарегистрирована у тех, у кого среднее АД во время ночного сна повышалось относительно дневных часов (в отличие от больных со снижением АД в ночное время или его стабильными показателями в течение суток). После внесения поправок на имевшиеся факторы сердечно-сосудистого риска оказалось, что повышение АД в ночные часы сопровождалось снижением показателя средней общей выживаемости на 13,4% на протяжении 2,5 лет и двукратным увеличением риска смерти от всех причин (отношение шансов 2,2; 95%-ный доверительный интервал 1,3–3,8). При этом снижение среднего АД на 1% в ночное время по сравнению с дневным было независимо связанным со снижением риска смерти в течение 20 лет на 4%. Результаты этого длительного исследования подтвердили наличие высокого риска у пациентов с СД и КВН с нарушением регуляции суточного ритма АД и в очередной раз подчеркнули необходимость не только адекватной коррекции АД, но и разработки эффективной коррекции дисфункции вегетативной нервной системы.
В повседневной клинической практике для оценки функционального состояния вегетативной иннервации достаточно широко применяют методы регистрации изменений не только АД, но и ЧСС, выполнение функциональных проб (форсированное дыхание, орто- и клиностаз), тестов Вальсальвы и Ашнера – Даньини [24].
Результаты ряда клинических исследований продемонстрировали достаточно высокую диагностическую точность одновременного применения набора перечисленных тестов для своевременного выявления нарушений функционального состояния вегетативной нервной системы. Сегодня они по сути являются золотым стандартом диагностики данного состояния. К сожалению, значительное время, которое врач должен потратить на проведение полноценного обследования, существенно ограничивает применение данного способа диагностики как в амбулаторных, так и в стационарных условиях.
Значительный интерес представляет оценка вариабельности сердечного ритма (ВСР) [25]. Изначально считалось, что получение диагностически ценного материала возможно только при непрерывной регистрации ЧСС на протяжении 12–24 часов. Вместе с тем результаты дальнейших исследований показали, что для получения надежных результатов, характеризующих состояние вегетативной нервной системы, достаточно регистрации ЧСС в течение не более пяти минут [26]. Установлено, что проведение кратковременной регистрации ЧСС обеспечивает получение надежных результатов при относительно меньших по сравнению с длительным мониторированием временных и материальных затратах. Исследования, проведенные с использованием оценки ВРС, продемонстрировали эффективность данного диагностического метода, позволили выявить основные паттерны изменения параметров ВРС, характеризующих различные виды нарушений вегетативной нервной системы [27, 28].
Лечение
При лечении пациентов с различными формами ДПН, в том числе вегетативными нарушениями, помимо коррекции гликемии и устранения прочих факторов риска поражения периферической нервной системы назначают витамины группы B, альфа-липоевую (тиоктовую) кислоту, ряд лекарственных препаратов, эффективность которых продемонстрирована в ограниченном количестве клинических исследований [29, 30]. У пациентов с ДПН возможно применение препаратов комплексного воздействия на периферическую нервную систему, в частности модулирующих процессы проведения импульса по нервному волокну и транссинаптической передачи сигнала. Такими свойствами в полной мере обладает препарат ипидакрин (Ипигрикс®), основные механизмы действия которого изучены в условиях эксперимента, а эффективность и безопасность подтверждены в ходе клинических исследований.
Ипидакрин оказывает стимулирующий эффект на процессы нервно-мышечной и невро-невральной передачи, проведение возбуждения по нервным волокнам вследствие ингибирования активности ацетилхолинэстеразы и блокады калиевых каналов [31]. Вследствие обратимой блокады калиевых каналов в пресинаптическом волокне в момент прохождения нервного импульса наблюдается удлинение периода возбуждения, что обеспечивает поступление большого количества ацетилхолина в синаптическую щель. За счет селективной блокады калиевых каналов мембран нейронов и повышения скорости поступления ионов кальция в окончания аксонов удлиняется период возбуждения пресинаптического волокна, что в итоге приводит к повышению поступления ацетилхолина в синаптическую щель. Собственно антихолинэстеразный эффект ипидакрина носит кратковременный характер (до 20–30 минут) и является обратимым, тогда как блокада калиевой проницаемости мембраны нейрона сохраняется в течение двух часов после введения терапевтической дозы препарата. Ипидакрин способен вызывать замедление работы натриевого ионного насоса, что в определенной степени может объяснить противоболевой эффект препарата, реализуемый на уровне периферических проводящих чувствительных путей. Имеются данные о том, что противоболевое действие ипидакрина обусловлено центральными механизмами действия – активацией холинергической системы головного мозга [32]. В экспериментальном исследовании показано, что применение ипидакрина в силу угнетения активности ацетилхолинэстеразы может рассматриваться как перспективное направление в комплексном лечении пациентов с болевым синдромом. Препарат может назначаться с целью усиления обезболивающего эффекта препаратов первой линии при лечении ноцицептивного и невропатического болевых синдромов.
Электрофизиологические исследования показали, что на фоне применения ипидакрина у больных с периферическим парезом увеличивается амплитуда М-ответа в пораженных мышцах, наряду с этим уменьшается резидуальная латентность, возрастают длительность и амплитуда потенциалов двигательных единиц, что свидетельствует об активации реиннервационных процессов [33]. Уменьшение показателя длительности резидуальной латентности может указывать на восстановление трофического обеспечения и функционального состояния аксонов и считается благоприятным прогностическим признаком восстановления функций. При длительном использовании ипидакрина наблюдается увеличение скорости распространения возбуждения по периферическим нервам, что может отражать процессы ремиелинизации [34].
Имеется значительный опыт применения ипидакрина при различных заболеваниях периферической нервной системы. Достаточно изучена его эффективность при моно- и полиневропатиях, которые проявляются прежде всего двигательными расстройствами.
В одно из первых клинических исследований эффективности ипидакрина были включены 35 пациентов с периферической мононевропатией (туннельный синдром), дискогенной радикулопатией шейной и поясничной локализации [35]. Пациенты основной группы на протяжении шести недель в составе комплексной терапии (препараты витаминов группы B, тиоктовая кислота) получали ипидакрин (две недели по 15 мг/сут внутримышечно или подкожно, затем четыре недели перорально по 20 мг три раза в сутки). Пациентам группы сравнения назначали только базисную терапию.
Проводимая терапия сопровождалась значительной положительной динамикой в виде нарастания объема и силы движений в паретичных мышечных группах. По окончании курса лечения имело место расширение силы и объема активных движений пораженных мышечных групп. У пациентов с поражением позвоночника наблюдалось восстановление нормального распределения мышечной активности. Данные клинического обследования подтверждались результатами электронейромиографии (ЭНМГ). У пациентов основной группы нарастала скорость распространения возбуждения по периферическим нервам (p < 0,05 при сопоставлении с группой сравнения), что отражало активизацию процессов ремиелинизации. Скорость распространения импульса по n. medianus на стороне поражения до начала лечения составила 45,3 ± 1,3 м/с, после его окончания – 61,2 ± 1,2 м/с (р < 0,05), на стороне поражения – 42,3 ± 1,2 и 48,7 ± 1,0 м/с соответственно. Наряду с восстановлением скорости проведения импульса у пациентов с признаками аксонального повреждения в пораженных мышцах регистрировалось увеличение амплитуды М-ответа (отличия носили статистически значимый характер по сравнению с исходным уровнем; р < 0,05). В группе сравнения, несмотря на определенное купирование болевого синдрома и уменьшение выраженности периферических парезов, статистически значимых изменений показателей ЭНМГ по сравнению с исходными не зарегистрировано. Результаты проведенного исследования подтвердили, что ипидакрин – мощный антихолинэстеразный препарат, способный одновременно оказывать положительное влияние на проведение импульса по периферическим нервам.
Помимо восстановления нарушенных двигательных функций в ходе данного исследования отмечалось уменьшение интенсивности болевого синдрома (значения по визуальной аналоговой шкале уменьшились с 23,2 ± 1,2 до 12,0 ± 1,3 балла; р < 0,05). Вместе с тем уменьшилась площадь нарушения чувствительности в зонах поражения.
Данное наблюдение подтверждает наличие противоболевого эффекта ипидакрина, что расширяет область его применения у пациентов с компрессионным поражением периферических нервных стволов, в том числе с вертеброгенной радикулопатией.
Высокая клиническая эффективность ипидакрина отмечается не только при компрессионной и ишемической, но и при травматической невропатии. Препарат продемонстрировал положительный эффект при краниальной невропатии, в том числе невропатии лицевого нерва. Независимо от характера и локализации патологического процесса применение ипидакрина сопровождалось более ранним по сравнению с группой контроля наступлением клинического эффекта, сокращением сроков лечения, а также более полным восстановлением нарушенных двигательных функций и эффективным устранением болевого синдрома. У пациентов с мононевропатией различного генеза своевременное начало лечения с назначением ипидакрина позволило сократить срок наступления значимого клинического эффекта в среднем на 6,7 ± 2,1 суток. Одновременно авторы отметили существенное сокращение последующего восстановительного периода за счет более высокой эффективности реабилитационных мероприятий [36]. Проведение курса лечения сопровождалось увеличением количества больных не только с полным восстановлением двигательных функций, но и уменьшением интенсивности болевого синдрома.
Как правило, ипидакрин назначается в составе комплексной медикаментозной терапии (витамины группы B, тиоктовая кислота) вместе с лечебной гимнастикой и физиотерапевтическими процедурами.
Способность ипидакрина ингибировать активность натриевых каналов, оказывать модулирующее действие на проведение болевых сигналов позволяет говорить о возможности его применении в целях уменьшения интенсивности болевого синдрома. Исследования применения ипидакрина в комплексной терапии пациентов с различными болевыми синдромами проводились неоднократно. Обычно в исследования включались пациенты с вертеброгенной патологией, дискогенным корешковым синдромом. Исследования применения ипидакрина в комплексной терапии такого контингента пациентов продемонстрировали вполне ожидаемые положительные результаты. На фоне лечения у больных уменьшалась не только выраженность вялого пареза, обусловленного компрессией корешка, но и интенсивность болевого синдрома с невропатическим компонентом.
Как показали дальнейшие исследования, на фоне применения ипидакрина уменьшается выраженность не только невропатического, но и ноцицептивного компонентов болевого синдрома [33]. Так, зафиксировано уменьшение выраженности болевого синдрома у пациентов с дорсалгией без признаков радикулопатии, то есть с преимущественно ноцицептивным острым болевым синдромом.
Ученые изучали эффективность применения ипидакрина у больных с поясничной дорсопатией с корешковым синдромом, перенесших дискэктомию, не обеспечившую купирование болевого синдрома (синдром неудачной операции на позвоночнике) [37]. Ипидакрин назначали в составе комплексной терапии (нестероидные противовоспалительные препараты, миорелаксанты, немедикаментозное лечение). Согласно результатам, комбинированная терапия с применением ипидакрина обеспечивала не только максимальное восстановление нарушенных двигательных функций, но и уменьшение интенсивности болевого синдрома сочетанного патогенеза. Данные клинического наблюдения полностью подтверждены результатами электрофизиологического обследования. Авторы отметили хорошую переносимость лечения, отсутствие негативного влияния ипидакрина на желудочно-кишечный тракт и сердечно-сосудистую систему. Кроме того, не зарегистрировано случаев системного холиномиметического эффекта.
Исследователи оценивали возможность применения ипидакрина у пациентов с СД 2-го типа. Не так давно были представлены результаты наблюдательного исследования применения препарата Ипигрикс® при болевой форме диабетической полиневропатии (НИРВАНА) [38]. Всего в исследование были включены 60 пациентов с СД 2-го типа и болевой формой ДПН в возрасте 30–65 лет. В результате комплексного клинико-инструментального обследования были получены данные о высокой эффективности Ипигрикса в составе комплексной терапии больных ДПН. Было также установлено, что применение препарата позволяет добиться не только своевременного купирования болевого синдрома, но и повышения показателей качества жизни. На основании полученных результатов можно рекомендовать широкое внедрение в клиническую практику описанного метода лечения у пациентов с болевой формой ДПН.
Исследование эффективности ипидакрина у пациентов с ДПН
Несмотря на наличие данных о высокой эффективности препарата при заболеваниях периферической нервной системы, в частности ДПН, практически отсутствуют сведения о его влиянии на клинические проявления вегетативных нарушений. В связи с этим было проведено открытое многоцентровое сравнительное проспективное исследование влияния препарата Ипигрикс® на показатели, характеризующие состояние вегетативной нервной системы у пациентов с ДПН [39].
Материал и методы
Протокол исследования был одобрен локальным этическим комитетом. Критерии включения в исследование:
- возраст 18–70 лет;
- наличие СД 2-го типа;
- длительность заболевания не менее 12 месяцев;
- регулярный прием сахароснижающих лекарственных препаратов;
- болевой невропатический синдром;
- прочие двигательные и чувствительные поражения периферической нервной системы, обусловленные СД 2-го типа.
Критерии невключения:
- беременность и период кормления;
- применение в период проведения исследования препаратов витаминов группы В или тиоктовой кислоты, альфа- или бета-адреноблокаторов;
- прием противоэпилептических антидепрессантов;
- выраженная брадикардия;
- нарушения сердечной проводимости;
- нестабильная стенокардия/острый коронарный синдром;
- язвенная болезнь желудка или двенадцатиперстной кишки в стадии обострения;
- декомпенсированная почечная, печеночная или сердечная недостаточность;
- непереносимость препарата Ипигрикс® или отдельных компонентов его лекарственной формы.
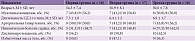
Включенные в исследование пациенты были распределены в три группы. Первую составили 16 больных, получавших Ипигрикс® перорально по 20 мг три раза в сутки на протяжении 60 дней. Во вторую группу вошли 17 пациентов, которые в течение 15 дней получали Ипигрикс® внутримышечно по 15 мг один раз в сутки, затем два месяца перорально по 20 мг три раза в сутки. 16 пациентов третьей группы (группа сравнения) получали только базисную терапию без ипидакрина и других обратимых ингибиторов холинэстеразы. Изначально в исследование вошли 54 пациента – по 18 в каждой группе. Вследствие причин, не связанных с переносимостью проводимого лечения (наступление беременности, изменение места жительства, госпитализация в связи с различными медицинскими показаниями), досрочно завершили исследование пять больных. В итоге анализу были подвергнуты результаты динамического обследования 51 пациента. На момент включения в исследование пациенты трех групп были сопоставимы по основным клинико-демографическим показателям (табл. 1). Все больные получали сопоставимую сахароснижающую терапию, лекарственные препараты, назначенные по поводу имеющихся соматических заболеваний.
Выраженность невропатического болевого синдрома оценивали на основании шкалы неврологических симптомов (Neurological Symptoms Score, NSS), которая позволяет оценить выраженность основных чувствительных проявлений ДПН (боль, парестезии, онемение) на протяжении последних 24 часов [40].
Диагностика КВН осуществлялась с применением тестов Эвинга, позволяющих оценить функциональное состояние сердечно-сосудистой системы и выявить расстройства ее вегетативной регуляции с регистрацией изменений АД и ЧСС. Выполнялись проба с форсированным глубоким дыханием, тест 30/15 и проба с изометрической динамометрией [22, 41]. При оценке выполнения каждого теста за 0 баллов принимали нормальный результат, за 1 балл – сомнительный/пограничный результат, 2 балла – измененный (патологический) результат. В случае если имел место патологический результат выполнения двух и более тестов или сумма баллов при выполнении всех тестов превышала 4, диагностировались нарушения вегетативной регуляции сердечной деятельности. Результаты тестирования показали, что у всех включенных в исследование больных наблюдались проявления КВН.
Объективная оценка деятельности вегетативной системы проводилась на основании результатов анализа показателей ВСР. Регистрировали показатели спектральной плотности мощности временной последовательности кардиоинтервалов RR с использованием быстрого преобразования Фурье с последующим расчетом таких показателей, как HF (высокочастотные волны в диапазоне 0,40–0,15 Гц, характеризующие парасимпатическую кардиоингибиторную активность), LF (низкочастотные волны в диапазоне 0,15–0,04 Гц, характеризующие кардиостимулирующую симпатическую активность), VLF (волны очень низкой частоты в диапазоне 0,04–0,00 Гц, отражающие активность надсегментарных вегетативных центров), LF/HF (отношение LF и HF, отражающее соотношение активности парасимпатического и симпатического отделов вегетативной нервной системы), TP (общая мощность спектра, характеризующая суммарный эффект воздействий на сердечный ритм различных уровней вегетативной регуляции). ВРС оценивали на основании анализа фрагментов ритмограмм продолжительностью пять минут. Исследование проводили с помощью комплекса «Ритм, АД-03». Кроме того, в ходе наблюдения за пациентами регистрировали нежелательные явления (НЯ) и оценивали их потенциальную связь с приемом лекарственных препаратов. Исходные выраженность и проявления невропатического синдрома у больных трех групп не отличались.
При статистическом анализе результатов использовали программный пакет SPSS 21.0. Количественные показатели представлены в виде среднего и стандартного отклонения (M ± SD), качественные – в виде абсолютного значения и частоты (n/%). Значимость различий количественных показателей с нормальным распределением оценивали на основании t-критерия Стьюдента. При распределении, отличном от нормального, использовали критерий Манна – Уитни. Различия считали значимыми при p < 0,05.
Результаты
На фоне проводимой терапии у пациентов первой группы на 30-е сутки наблюдалось снижение интенсивности болевого синдрома, что подтверждалось уменьшением значений по шкале NSS (отличия не носили статистически значимого характера). На 60-е сутки значения данного показателя уменьшились на 37% по сравнению с исходными (p < 0,05). У пациентов второй группы на 30-е сутки имело место значительное уменьшение (на 22%) показателей по шкале NSS (p < 0,05). Значения оказались ниже, чем у больных первой группы (отличия не носили статистически значимого характера). На 60-е сутки во второй группе наблюдалось дальнейшее снижение значений по шкале NSS (на 35% по сравнению с исходным уровнем; p < 0,05). Различия между первой и второй группами отсутствовали. У больных третьей группы значения по шкале NSS не менялись на протяжении периода наблюдения.
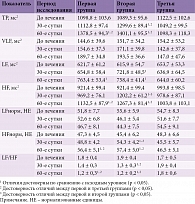
Исходно результаты спектрального анализа ВCР в наблюдавшихся группах не отличались (табл. 2). На 30-е сутки у пациентов первой группы отмечалось некоторое увеличение показателей ТР, VLF и LF и уменьшение соотношения LF/HF (p > 0,05 для всех показателей). На 60-е сутки в первой группе отмечался значительный прирост значений TP (на 20%; p < 0,05), HF (на 18,6%; p < 0,05), HFнорм (на 15,8%; p < 0,05), величина соотношения LF/HF уменьшилась на 28% (p < 0,05). При исследовании на 60-е сутки указанные показатели значительно отличались от соответствующих значений в третьей группе (p < 0,05 для всех показателей).
Во второй группе зарегистрирована более выраженная динамика показателей: при обследовании на 30-е сутки наблюдались увеличение значения TP (на 19,2%; p < 0,05), HF (на 23,2%; p < 0,05), HFнорм (на 18,6%; p < 0,05) и снижение величины соотношения LF/HF (на 31,4%; p < 0,05). Зарегистрированные результаты статистически значимо не отличались от таковых в первой группе, но достоверно отличались от показателей в третьей группе. На 60-е сутки во второй группе были выявлены дальнейшее нарастание значений показателей TP (на 25,4%; p < 0,05), HF (на 27,3%; p < 0,05), HFнорм (на 21,1%; p < 0,05) и уменьшение величины соотношения LF/HF (на 36,8%; p < 0,05). Изменения остальных показателей на 60-е сутки не носили достоверного характера по сравнению с исходными уровнями. Величина показателей абсолютной и относительной мощности низкочастотного спектра во второй группе на 60-е сутки была существенно выше, чем в третьей (p < 0,05). Статистически значимые отличия показателей оценки ВРС в первой и второй группах на 60-е сутки отсутствовали. В третьей группе показатели ВРС на протяжении периода наблюдения оставались стабильными.
Способ введения Ипигрикса не ассоциировался с развитием НЯ. В ходе исследования НЯ не зарегистрированы. Ни одному из пациентов не потребовалось прекращения лечения или изменения режима приема препарата вследствие плохой переносимости лечения. Анализ результатов субъективной оценки эффективности и переносимости терапии показал, что большинство пациентов первой и второй групп расценили его результаты как хорошие и очень хорошие.
Обсуждение
Вовлечение в патологический процесс периферической нервной системы у пациентов с СД 2-го типа представляет собой нередкое тяжелое осложнение основного заболевания. Как свидетельствуют результаты многочисленных исследований, вегетативные расстройства, прежде всего нарушения регуляции ритма и сосудистого тонуса, существенно ухудшают прогноз заболевания, угрожают жизни пациента и несут в себе риск наступления инвалидизации. Разработка методов эффективной коррекции вегетативных нарушений у больных ДПН остается актуальной задачей. В этой связи несомненный интерес представляет изучение применения ипидакрина (Ипигрикс®), продемонстрировавшего высокую эффективность, у пациентов с различными поражениями периферической нервной системы.
Заключение
Результаты представленного исследования показали, что у пациентов всех трех групп до начала участия в исследовании имели место проявления вегетативной кардиальной невропатии в виде преимущественной активации симпатического отдела и относительного подавления активности парасимпатического отдела. Изначально у всех пациентов наблюдалось снижение мощности преимущественно высокочастотных колебаний, что могло указывать на явления недостаточности парасимпатического отдела вегетативной нервной системы. Избыточная активность симпатического отдела при недостаточности парасимпатической иннервации является характерной особенностью вегетативной ДПН, однако нередко встречается и у пациентов с метаболическим синдромом [42].
После проведенной терапии отмечалось статистически значимое увеличение представленности низкочастотных колебаний, что свидетельствовало о восстановлении функционального состояния парасимпатического отдела вегетативной нервной системы. Наблюдалось более раннее наступление клинического эффекта (на 30-е сутки исследования) у пациентов, которые получали комбинированное лечение: вначале Ипигрикс® вводился парентерально, затем перорально. Однако при обследовании на 60-е сутки терапии было установлено, что выраженность эффекта проводимого лечения существенным образом не зависела от режима введения препарата. Полученные данные позволяют рассматривать возможность комбинированного лечения у пациентов с более выраженными вегетативными расстройствами при необходимости ранней коррекции вегетативных нарушений.
Дальнейшего изучения требует вопрос о длительности проведения терапии препаратом Ипигрикс®. Принимая во внимание хроническое течение как собственно СД 2-го типа, так и обусловленных им неврологических осложнений, у значительной части пациентов следует рассматривать возможность проведения многократных повторных курсов лечения Ипигриксом.
В ходе исследования отмечалось положительное влияние Ипигрикса на выраженность чувствительных нарушений у больных ДПН. Положительный эффект заключался в уменьшении интенсивности невропатического болевого синдрома, а также других его проявлений. Полученные результаты подтверждают данные ранее проведенных исследований, показавших эффективность ипидакрина у пациентов с невропатическим болевым синдромом.
Кроме того, хорошая переносимость препарата и отсутствие значимых НЯ на фоне терапии, установленные в исследовании, могут способствовать повышению приверженности пациентов лечению.
Имеющиеся на сегодняшний день данные позволяют рассматривать Ипигрикс® в качестве препарата, назначение которого целесообразно у пациентов с ДПН с вегетативными нарушениями. Представляется перспективным и обоснованным проведение рандомизированных плацебо-контролируемых исследований, направленных на дальнейшее углубленное изучение эффективности применения ипидакрина у пациентов с поражением периферической нервной системы, обусловленным СД 2-го типа.
P.R. Kamchatnov, PhD, Prof., E.R. Barantsevich, PhD, Prof., A.A. Kabanov, PhD, A.V. Chugunov, PhD
N.I. Pirogov Russian National Research Medical University
Academician I.P. Pavlov First St. Petersburg State Medical University
Contact person: Pavel R. Kamchatnov, pavkam7@gmail.com
Damage to the peripheral nervous system is a frequent complication of various somatic diseases, in particular, type 2 diabetes mellitus. The development of diabetic polyneuropathy (DPN) is associated with a significant increase in the risk of death, disability, and a decrease in the quality of life of patients. The article discusses the pathogenesis and clinical manifestations of vegetative DPN, provides information on the effectiveness of the use of ipidacrine (Ipigrix) in this condition. The results of clinical studies on the use of Ipigrix in patients with various forms of DPN are analyzed, the results of evaluating the effectiveness and safety of treatment are evaluated.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.