Инфекционный эндокардит, осложненный эмболией в переднюю межжелудочковую ветвь
- Аннотация
- Статья
- Ссылки
- English
Основные положения. Инфекционный эндокардит (ИЭ) – одно из наиболее тяжелых и потенциально жизнеугрожающих заболеваний, сопровождаемых множеством системных осложнений. Особую диагностическую и клиническую сложность представляют случаи с эмболизацией в коронарные артерии. В данной работе приведено описание клинического наблюдения пациентки с ИЭ митрального клапана, вызванного Streptococcus gordonii, с тромбоэмболией в переднюю межжелудочковую ветвь и инфарктом миокарда. Представлены ключевые диагностические признаки, включая наличие крупных вегетаций при эхокардиографии, подъем сегмента ST на электрокардиограмме и данные коронароангиографии, подтвердившие наличие окклюзии. Описана терапевтическая тактика с применением тромбоаспирации и антибактериальной терапии.
Заключение. Этот случай подчеркивает необходимость высокой настороженности в отношении коронарных эмболий при ИЭ, особенно у пациентов с выраженными вегетациями и активным инфекционным процессом.
Основные положения. Инфекционный эндокардит (ИЭ) – одно из наиболее тяжелых и потенциально жизнеугрожающих заболеваний, сопровождаемых множеством системных осложнений. Особую диагностическую и клиническую сложность представляют случаи с эмболизацией в коронарные артерии. В данной работе приведено описание клинического наблюдения пациентки с ИЭ митрального клапана, вызванного Streptococcus gordonii, с тромбоэмболией в переднюю межжелудочковую ветвь и инфарктом миокарда. Представлены ключевые диагностические признаки, включая наличие крупных вегетаций при эхокардиографии, подъем сегмента ST на электрокардиограмме и данные коронароангиографии, подтвердившие наличие окклюзии. Описана терапевтическая тактика с применением тромбоаспирации и антибактериальной терапии.
Заключение. Этот случай подчеркивает необходимость высокой настороженности в отношении коронарных эмболий при ИЭ, особенно у пациентов с выраженными вегетациями и активным инфекционным процессом.
Введение
Инфекционный эндокардит (ИЭ) по-прежнему остается заболеванием с высоким риском осложненного течения, особенно при поздней диагностике и наличии высокоагрессивных патогенов. Одним из наиболее тяжелых и потенциально жизнеугрожающих осложнений при ИЭ является тромбоэмболический синдром, уступающий по частоте летальных исходов лишь прогрессирующей сердечной недостаточности [1–3]. Системные эмболии наблюдаются примерно у 20–50% пациентов, при этом чаще всего затрагивают головной мозг, селезенку, почки и конечности [2]. Поражение коронарных артерий встречается крайне редко и оценивается примерно в 3% случаев [4]. Это подчеркивает клиническую значимость тромбоэмболических событий, ассоциированных с ИЭ, и обосновывает необходимость своевременной оценки факторов риска, а также выбора оптимальной лечебной стратегии.
Основными предрасполагающими факторами к тромбоэмболическим осложнениям считаются морфологические характеристики вегетаций, тип возбудителя, а также наличие эпизодов эмболий в анамнезе. Наиболее высокий эмболический потенциал отмечается у подвижных, рыхлых вегетаций крупных размеров – свыше 10 мм, особенно более 15 мм, – в связи с их повышенной вероятностью отрыва и попадания в сосудистое русло [2, 5]. Поражение митрального клапана сопряжено с более высоким риском эмболий [5]. Это обусловлено как бóльшей подвижностью передней створки митрального клапана, так и рыхлой, неоднородной структурой вегетаций на фоне низкой линейной скорости кровотока в этой зоне. Немаловажное прогностическое значение также имеет динамика размеров вегетаций в процессе терапии: как их увеличение, так и уменьшение могут указывать на высокий риск эмболических осложнений [2].
Клинический случай
Пациентка Г., 64 года, в конце мая 2024 г. госпитализирована в гКБ № 52 ДЗМ. В анамнезе: в декабре 2023 г. перенесла острую респираторную вирусную инфекцию, после чего отметила появление общей слабости, с начала января 2024 г. были периодические повышения температуры тела до 39 °С. Амбулаторно получала фторхинолоны (ципрофлоксацин) с кратковременным положительным эффектом. В апреле 2024 г. выполнена компьютерная томография (КТ) с контрастом органов грудной клетки, брюшной полости и малого таза – диагностирован инфаркт селезенки. Амбулаторно по эхокардиографии (ЭхоКГ): гипертрофия миокарда левого желудочка (ЛЖ), дилатация полости левого предсердия, фракция выброса (ФВ) ЛЖ 58%, незначительный митральный стеноз, вегетация на уровне передней створки митрального клапана (МК), митральная регургитация (МР) 3-й степени, незначительное количество жидкости в полости перикарда.
При поступлении в стационар объективно: рост 164 см, масса тела 85 кг, индекс массы тела 30,8 кг/м2. При осмотре: сознание ясное, кожные покровы чистые, обычной окраски и влажности, отеков нет, температура тела 38,5 °С. Частота дыхательных движений – 16/мин, SpO2 – 98% на атмосферном воздухе. В легких дыхание везикулярное, хрипов нет. Ритм правильный, систолический шум на верхушке, частота сердечных сокращений (ЧСС) – 105 уд/мин, АД – 120/80 мм рт. ст. Остальные органы и системы без особенностей.
Лабораторно отмечены: повышение уровня С-реактивного белка (СРБ) до 31,06 мг/л (норма – 0–6), D-димера до 3132 нг/мл (норма – 0–500), фибриногена до 5,23 г/л (норма – 0–4), лактатдегидрогеназы до 303,5 Ед/л (норма – 0–248) и N-концевого натрийуретического пептида (NTproBNP) до 865 пг/мл (норма – 0–125), а также анемия легкой степени (гемоглобин – 86 г/л), эритропения (3,6 × 1012/л).
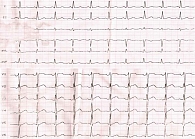
На электрокардиограмме (ЭКГ) при поступлении – синусовая тахикардия, ЧСС – 103 уд/мин, нормальное положение электрической оси сердца (рис. 1).
По результатам ЭхоКГ (30.05.24 г.): ФВ ЛЖ – 60%, на передней створке МК – гиперэхогенная подвижная структура на широком основании с неровными контурами 1,7 × 0,8 см со множественными активно флотирующими фрагментами длиной около 0,6–0,8 см, в основании задней створки мелкий флотирующий элемент длиной 0,6 см, открытие створок достаточное, МР средней степени тяжести.
Пациентке инициирована эмпирическая антимикробная терапия (АМТ): ампициллин/сульбактам в/в (по 3 г 3 раза в сутки), ванкомицин в/в (по 1,5 г 2 раза в сутки). Учитывая полученные данные, пациентку консультировал кардиохирург – рекомендована консервативная терапия. В анализе крови на стерильность – рост Streptococcus gordonii (S. gordonii). В связи с результатом микробиологического исследования проведена смена АМТ на цефтриаксон (по 2 г 2 раза в сутки). Через три дня в связи с сохраняющейся субфебрильной лихорадкой (до 37,5 °С) добавлен гентамицин в дозе 160 мг/сут.
По результатам чреспищеводной эхокардиографии: миксоматозная дегенерация передней створки МК; подклапанная флотирующая вегетация передней створки больших размеров; подклапанная вегетация основания задней створки средних размеров; МР 2-й степени; трикуспидальный, аортальный клапаны (АК) и клапан легочной артерии без признаков вегетаций.
На фоне проводимой терапии отмечался регресс маркеров системного воспаления: СРБ – 11 мг/л, лейкоциты – 4,9 × 109/л, нейтрофилы – 3,5 × 109/л. При повторном анализе крови на стерильность роста микроорганизмов не выявлено.
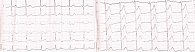
Через 10 дней с момента госпитализации у пациентки развились интенсивные давящие боли за грудиной; на ЭКГ – синусовая тахикардия; ЧСС – 100 уд/мин; элевация ST в I отведении, aVL, V2–V6 и депрессия ST максимально до 1 мм во II, III, aVF (рис. 2).
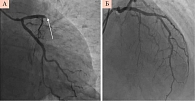
Экстренно выполнена коронароангиография (КАГ): ствол левой коронарной артерии (ЛКА) – без ангиографически значимых стенозов; передняя межжелудочковая артерия (ПМЖА) – в устье -30% стеноз, далее на границе проксимального и среднего сегментов остро окклюзирована, постокклюзионные отделы не заполняются по внутри- и межсистемным коллатералям; диагональная ветвь – постокклюзионные отделы слабо заполняются по внутри- и межсистемным коллатералям; огибающая артерия – в устье эксцентрический (-15–20%) стеноз, далее без ангиографически значимых стенозов; ветвь тупого края – без ангиографически значимых стенозов; в устье правой коронарной артерии (ПКА) – 50% стеноз, далее без стенотического поражения. Реканализация ПМЖА. Тромбоаспирация из ПМЖА.
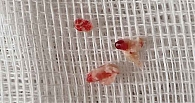
На контрольной ангиограмме после проведения коронарного проводника отмечена дислокация тромботических масс далее по среднему сегменту. При наличии у пациентки бактериального эндокардита нативного митрального клапана с массивными вегетациями, вероятнее всего, имеет место эмболическая окклюзия ПМЖА (рис. 3). Выполнена тромбоаспирация тромботических масс. В промывных водах обнаружено три фрагмента твердых, белого цвета эмбола (рис. 4). При контрольной коронарографии – реканализация в месте раннее выявленного тромбоза, ангиографических признаков коронарного атеросклероза нет, ширина просвета артерии восстановлена полностью, ангиографические признаки диссекции интимы отсутствуют, гемодинамика по расширенному сегменту и заполнение дистальных отделов артерии хорошее, признаков дистальной эмболии левой коронарной артерии нет, кровоток по артерии – TIMI 3 (полное восстановление кровотока).
Результаты ЭхоКГ в динамике после КАГ: ФВ – 60%; зона нарушения локальной сократимости – гипокинез области верхушки, преимущественно зоны апикальной кепки; крупная вегетация на передней створке митрального клапана (размеры около 1,3 × 1,2 см с мелкими фрагментами) активно флотирует в кровотоке; мелкий флотирующий фокус в основании задней створки длиной 0,4 см повышенной эхогенности (без изменений); систолическое давление в легочной артерии – 37 мм рт. ст. Пациентка переведена в НИИ СМП им. Н.В. Склифосовского для хирургического лечения порока МК.
Основной диагноз: Вторичный инфекционный эндокардит на фоне миксоматозной дегенерации митрального клапана, ассоциированный со Streptococcus gordonii. Осложнения: митральная недостаточность третьей степени. Тромбоэмболический синдром. Септические инфаркты селезенки. Эмболия передней межжелудочковой ветви (ПМЖВ) фрагментами вегетаций. Коронароангиография: стеноз ПКА в устье – 50%, стеноз ПМЖВ в устье – 30%, острая окклюзия на границе проксимального и среднего сегментов ПМЖВ. Тромбоэмболоэкстрация из ПМЖВ. Инфаркт миокарда (ИМ) 2 типа. Железодефицитная анемия средней степени тяжести.
Обсуждение
Согласно данным международных наблюдений, с начала 2000-х гг. во всем мире отмечается стабильная тенденция к росту заболеваемости ИЭ (31–57,4%) [1–3]. Это связывают с рядом факторов, включая старение населения, расширение применения инвазивных методов диагностики и лечения (ангиография, установка катетеров, имплантация кардиостимуляторов), увеличение объемов кардиохирургических вмешательств, рост числа пациентов, находящихся на гемодиализе, а также распространение ВИЧ-инфекции и внутривенной наркомании.
Неблагоприятный прогноз ИЭ связан с его осложненным течением, в частности с тромбоэмболическими осложнениями, представляющими особую опасность [6–8]. В отличие от типичных эмболий в церебральные или периферические сосуды, коронарные эмболии часто протекают под маской ИМ и могут быть ошибочно интерпретированы как проявление атеротромботического поражения. Это создает определенные сложности при выборе стратегии лечения, особенно в экстренных ситуациях.
Учитывая анатомические и гемодинамические особенности МК, создаются условия, способствующие формированию вегетаций, которые, как правило, имеют большие размеры, неоднородную структуру и выраженную подвижность. Вегетации на МК чаще достигают размеров, превышающих 10–15 мм, что существенно увеличивает риск их отрыва и системной эмболизации [1, 2].
В одном из наиболее цитируемых исследований G.С. Di Salvo и соавт. среди пациентов с установленным диагнозом ИЭ (n = 384) частота эмболий при поражении МК достигала 57%, тогда как при поражении АК – только 25%. Авторы также отметили, что размер вегетаций свыше 10 мм на МК был независимым предиктором системных эмболий [3]. Такие случаи требуют более пристального наблюдения и раннего обсуждения хирургической тактики при локализации вегетаций на МК.
В представленном клиническом случае у пациентки были выявлены вегетации крупных размеров (более 10 мм) на измененном МК с признаками миксоматозной дегенерации, осложнившиеся септическими эмболиями в селезенку и окклюзией ПМЖА.
Связь между возбудителем ИЭ и риском тромбоэмболических осложнений имеет практическую важность. Наиболее значимыми патогенами в этом контексте являются Staphylococcus aureus и Streptococcus bovis. S. aureus характеризуется выраженной тромбогенной активностью, способностью к инвазии и формированию крупных подвижных вегетаций. Инфекции, вызванные этим микроорганизмом, ассоциируются с повышенной частотой эмболий, в том числе в центральную нервную систему, почки и селезенку [1]. S. bovis также связан с высоким риском тромбоэмболических осложнений и, кроме того, может быть маркером колоректальной неоплазии, что требует обязательного дополнительного обследования [1, 2]. Таким образом, этиологический агент ИЭ должен рассматриваться как один из ключевых факторов стратификации риска эмболий и прогноза заболевания.
В данном клиническом случае у пациентки высеян S. gordonii. Этот возбудитель реже, чем S. aureus, вызывает острое течение ИЭ. Описаны случаи, когда ИЭ, вызванный S. gordonii, сопровождался ишемическим инсультом (по данным магнитно-резонансной томографии), рецидивирующими эмболиями в субсегментарные ветви легочной артерии, селезенку и почки, выявленными с помощью КТ [6].
Сроки появления тромбоэмболий могут быть разными, наиболее часто они возникают до начала терапии антибиотиками и в первые две недели лечения, когда вегетации отличаются рыхлой неоднородной структурой, легко фрагментируются [7]. Именно такой сценарий развития осложнений наблюдался в описываемом нами случае.
Далее через две недели от начала антибактериальной терапии происходят организация, уплотнение вегетаций, появление покровного эндотелия; при этом риск новых эмболических событий снижается до 6–21% [8, 9]. В связи с этим хирургическое лечение с целью профилактики тромбоэмболических осложнений у больных группы высокого риска рекомендуют проводить преимущественно в первые две недели от начала антибиотикотерапии [6].
Частота ИМ эмболического генеза при ИЭ, по данным различных источников, колеблется от 3,3 до 12% [4, 7], однако по результатам аутопсий она достигает 60% [9]. Такое расхождение объясняется, с одной стороны, более тяжелым течением заболевания у умерших пациентов, а с другой – трудностью диагностики безболевых форм ИМ при ИЭ. Развитие обширного тромбоэмболического ИМ ассоциировано с крайне неблагоприятным прогнозом и повышением летальности до 45–50% [1].
Основным патогенетическим механизмом ИМ в условиях ИЭ считают эмболизацию коронарных артерий вегетациями, реже – тромбообразование на воспалительно-измененной сосудистой стенке (коронарит), что усугубляется гиперкоагуляцией, характерной для системной инфекции [7, 10]. Среди других механизмов упоминают механическое перекрытие устья коронарной артерии вегетацией с АК, а также выраженную недостаточность АК, вызывающую снижение коронарной перфузии и ишемию миокарда [11]. Этиологически инфаркт на фоне ИЭ наиболее часто ассоциирован с S. aureus, S. epidermidis и стрептококками [8], а источником эмболов чаще всего выступает АК, реже – МК.
Примерно у половины пациентов ИМ при ИЭ протекает атипично – без выраженного болевого синдрома [7, 12]. В остальных случаях клиническая картина включает ангинозную боль, нарушения ритма и проводимости, а также развитие или декомпенсацию сердечной недостаточности. Диагностика ИМ при ИЭ основывается на клинических признаках, повышении уровня специфических биомаркеров (тропонины), ЭКГ-изменениях и эхокардиографических признаках. Хотя КАГ позволяет визуализировать эмбол в просвете коронарной артерии, она сопряжена с риском отрыва вегетаций при контакте с катетером и может спровоцировать системную эмболию. Поэтому КАГ оправдана только при отсутствии вегетаций на АК [11]. Кроме того, у пациентов с ИЭ возможно развитие септических микротромбоэмболий в миокарде, что может приводить к формированию очагов деструкции и абсцессов в толще миокарда. В данном случае пациентке в связи с развившимся острым коронарным синдромом выполнено экстренное чрескожное коронарное вмешательство (ЧКВ) и, несмотря на все риски, оно было оправдано, учитывая клиническую картину ишемии миокарда и угрозу развития фатальных осложнений.
Инфаркты или абсцессы селезенки занимают значительное место среди тромбоэмболических осложнений при ИЭ. По данным аутопсий, патологические изменения селезенки выявляют примерно у 50% умерших пациентов, однако лишь у половины из них они сопровождаются клиническими симптомами при жизни [8]. Учитывая высокую частоту бессимптомного течения и потенциальный риск разрыва органа, ряд исследователей рекомендуют рутинное выполнение КТ органов брюшной полости перед планируемым клапанным вмешательством для своевременного выявления эмболических поражений [4]. В нашем наблюдении инфаркт селезенки протекал субклинически и был диагностирован по данным КТ.
Ключевым элементом терапии ИЭ, направленным как на лечение самого заболевания, так и на профилактику его осложнений, включая тромбоэмболии, остается своевременное назначение эффективной антибактериальной терапии. Уже на этапе раннего начала адекватной антибиотикотерапии наблюдается снижение риска эмболических событий [13]. При этом значение этиотропного лечения по-прежнему фундаментально. В то же время подходы к применению антитромботической терапии при ИЭ до настоящего времени менее изучены и вызывают большие дискуссии, особенно в контексте ведения пациентов с осложнениями в виде ишемического инсульта или ИМ.
Исходя из накопленного опыта, можно считать, что сам по себе диагноз ИЭ не является показанием для проведения антикоагулянтной терапии [1, 10]. Основанием для нее служит наличие дополнительных факторов риска – фибрилляции предсердий, тромбоза глубоких вен и др. При этом необходимо в каждом конкретном случае оценивать риск и пользу такой терапии. Так, у больного ИЭ нативных клапанов без реального риска эмболий рутинное использование антикоагулянтов большинство исследователей не рекомендуют [10].
Оптимальное лечение больных эмболическим ИМ при ИЭ также недостаточно разработано и требует дальнейшего изучения. Следует отметить, что в текущих клинических рекомендациях, как российских, так и международных, коронарные эмболии не имеют отдельного алгоритма лечения [1, 14]. Ряд авторов указывает на эффективность как консервативной терапии (антибиотики + антикоагулянты), так и инвазивных вмешательств в условиях ИЭ при наличии показаний. В литературе описаны единичные случаи успешного ЧКВ при ИЭ, но долгосрочные исходы остаются неясными, и решение о вмешательстве принимается индивидуально.
Данный клинический случай подчеркивает важность привлечения мультидисциплинарной команды специалистов при ведении пациентов с осложненным течением ИЭ, включающей кардиологов, рентгенохирургов и кардиохирургов. Использование ЭхоКГ, КАГ и лабораторных методов дало возможность своевременно установить точный диагноз, локализовать источник эмболии и оказать необходимую помощь. Такой подход позволяет минимизировать риски и улучшить прогноз даже в столь сложных клинических ситуациях.
Заключение
Случай демонстрирует редкое осложнение инфекционного эндокардита – эмболию в переднюю межжелудочковую ветвь, потребовавшую экстренного коронарного вмешательства. Он подчеркивает необходимость ранней диагностики и междисциплинарного подхода в лечении таких пациентов.
Конфликт интересов. Авторы заявляют об отсутствии конфликта интересов.
N.G. Poteshkina, E.A. Kovalevskaya, D.V. Fetzer, N.S. Krylova, M.Yu. Maslova, E.Yu. Dorofeeva
Pirogov Russian National Research Medical University
Moscow City Clinical Hospital No 52
Contact person: Mariya Yu. Maslova, m.unoemezzo@gmail.com
Purpose. To describe the diagnostic features and own experience thromboaspiration and targeted antibacterial therapy in a patient with infectious endocarditis included thromboembolism in the coronary artery and myocardial infarction.
Key points. Infective endocarditis (IE) remains one of the most severe and potentially life-threatening diseases, often associated with numerous systemic complications. Coronary artery embolism represents a particularly challenging diagnostic and clinical manifestation. This article presents a clinical case of a patient with mitral valve IE caused by Streptococcus gordonii, complicated by thromboembolism of the left anterior descending artery and myocardial infarction. Key diagnostic findings are described, including large vegetations on echocardiography, ST-segment elevation on ECG, and coronary angiography confirming vascular occlusion. The treatment approach included thromboaspiration and targeted antibiotic therapy.
Conclusion. This case highlights the importance of maintaining high clinical suspicion for coronary embolism in IE, particularly in patients with large vegetations and an active infectious process.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.