Хемомикробиомный анализ синергизма D-маннозы и D-фруктозы в сравнении с другими метабиотиками
- Аннотация
- Статья
- Ссылки
- English
Введение
Состояние микробиоты кишечника тесно связано со здоровьем всего организма человека. Оздоровление микробиоты кишечника важно не только для желудочно-кишечного тракта (ЖКТ), но и для кожи и мочеполовой системы. Физиологический баланс может поддерживаться посредством пробиотиков (микроорганизмов, использующихся в терапевтических целях) или особых низкомолекулярных соединений, тонко модулирующих метаболизм микробиоты. Для обозначения таких соединений или их смесей применяются разнообразные термины: «пребиотики», «метабиотики», «конбиотики», «нутрицевтики», «функциональное питание» и т.д. [1].
Понятие «пребиотик» в настоящее время проходит стадию ревизионизма [2] и определяется как «субстрат, селективно используемый микроорганизмами организма-хозяина и приносящий пользу здоровью» [3, 4]. Подобное определение, несмотря на кажущуюся простоту и очевидность, порождает комплекс противоречий между клинической медициной и микробиологией. По сути, оно подменяет идею объективного микробиологического исследования воздействия низкомолекулярных веществ на микробиоту (о чем будет сказано далее) идеей, схожей с концепцией доказательности в медицине. Как известно, доказательная медицина при принятии решений в клинической практике призывает ориентироваться на исследования с некоторой произвольно определяемой статистической значимостью. В этом смысле, по мнению ряда выдающихся международных экспертов, «доказательность имеет довольно узкое значение и крайне уязвима к обоснованным упрекам в том, что отражает не объективную реальность, а всего лишь устоявшееся мнение» [5]. Зачастую в области «доказательности» используются устаревшие или просто ошибочные подходы к анализу данных [6], которые к тому же полностью пренебрегают результатами исследований функциональной геномики [7], микробиомики и методами анализа больших данных [8]. Поэтому с точки зрения приведенного ранее «ревизионистского» определения пребиотиков традиционные пребиотики (фруктоолигосахариды, инулин, галактаны и др.) могут перестать быть таковыми, если в каком-то метаанализе вдруг будет заявлено об «отсутствии достоверного клинического эффекта» (то есть уже упоминавшейся пользы для здоровья).
Целям настоящей статьи наиболее отвечает термин «метабиотик» [9]. Под метабиотиками понимают молекулы с определенной химической структурой, которые способны оптимизировать специфичные для организма-хозяина физиологические функции, связанные с деятельностью симбиотической микробиоты. В соответствии с данными функциональной геномики, метабиотиками могут быть миллионы веществ [10]. Кроме того, концепция метабиотиков, предложенная Б.Я. Шендеровым и соавт., не содержит внутренних противоречий, находится в полном согласии с методологией микробиологии, позволяет учитывать данные современной геномики и микробиомики [1, 9]. Особенно важно подчеркнуть, что концепция метабиотиков в принципе не может вступить в противоречие с клинической медициной.
Метабиотики как вещества, способствующие росту физиологической микробиоты, могут существенно различаться по воздействию на различных представителей микробиома, а значит, и по фармакологическим свойствам (например, интенсивности проявления основного эффекта, выраженности побочных реакций – метеоризма, флатуленции и др.) [11]. Поэтому комплексная оценка эффектов того или иного метабиотика должна включать исследование влияния этого метабиотика на микробиом в целом.
Такого рода комплексная оценка эффектов метабиотиков может быть проведена посредством роботизированных микробиомных скринингов роста бактерий in vitro [12] – экспериментальной процедуры, доступной только в отдельных исследовательских центрах. Альтернативой дорогостоящим и практически недоступным роботизированным скринингам выступает хемомикробиомный скрининг, направленный на оценку активностей исследуемой молекулы по отношению к заданной выборке представителей микробиома. Хемомикробиомный анализ свойств потенциальных метабиотиков проводится на основании нахождения молекул, структурно схожих с исследуемым метабиотиком. Затем посредством современных методов машинного обучения (искусственного интеллекта) выполняются количественные расчеты свойств метабиотиков.
Известны различные молекулы метабиотиков. Например, лактулоза метаболизируется микробиотой толстого кишечника, закисляя среду, благодаря чему тормозится рост патогенных бактерий и увеличивается нейтрализация аммиака, улучшается всасывание кальция и магния [13]. В пищевой и фармацевтической промышленности повсеместно используются такие заменители сахара, как D-фруктоза (структурная единица метабиотического полисахарида инулина), ксилит (пищевая добавка E967), сорбит (пищевая добавка E420), которые тоже проявляют метабиотические свойства [14].
Метабиотик D-манноза – эндогенный моносахарид, необходимый для N-гликозилирования около 30% белков протеома человека [15] и участвующий в «тонкой настройке» структур и функций белков протеома, в том числе иммуноглобулинов E, M, D, A и G. Блокируя взаимодействие бактериальных фимбрий с эндотелием, D-манноза предотвращает абсорбцию различных бактерий (уропатогенных штаммов Escherichia coli, Pseudomonas aeruginosa, Shigella, Leischmania, Mycobacterium и др.) на поверхности тканей, что позволяет предупредить развитие рецидива инфекций мочеполовых путей [16]. D-манноза усваивается микробиотой организма и частично подвергается расщеплению в процессе гликолиза. Пероральное введение D-маннозы и пробиотических штаммов бактерий стимулирует функциональную активность макрофагов, усиливая поглотительную и переваривающую способность клеток и приводя к снижению уровня фактора некроза опухоли альфа [17]. Однако воздействие D-маннозы и других метабиотиков на микробиом человека в целом остается малоизученным.
В настоящей работе представлены результаты сравнительного хемомикробиомного анализа D-маннозы, лактулозы, сорбита, ксилита и D-фруктозы, проведенного с использованием современных технологий машинного обучения. Актуальные методы прикладной математики позволяют достоверно и верифицируемо прогнозировать фармакологические эффекты молекул. На основании теории анализа размеченных графов и теории метрического анализа данных [18, 19], комбинаторной теории разрешимости [20], топологической теории анализа плохо формализованных задач [21] и новейших методов прогнозирования значений числовых переменных [22] нами разработан уникальный метод хемомикробиомного анализа, то есть прогнозирования влияния низкомолекулярных соединений на микробиом человека. Для каждой из исследованных молекул были получены значения площади под кривой роста (area under the curve – AUC) для репрезентативной выборки 38 микроорганизмов-комменсалов человека, включая бифидо- и лактобактерии.
Материал и методы
Проведен хемомикробиомный анализ молекул D-маннозы, лактулозы, сорбита, ксилита, D-фруктозы. Поскольку в водных растворах фруктоза существует в виде смеси таутомеров (динамических изомеров, переходящих друг в друга), в которой преобладает бета-D-фруктопираноза (около 80%), в настоящем исследовании для анализа эффектов D-фруктозы и инулина использовалась именно бета-D-фруктопираноза (рис. 1).
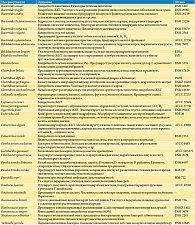
В микробиоте ЖКТ человека найдено более 1000 различных микроорганизмов [23], в том числе Firmicutes (Clostridium, Dorea, Eubacterium, Roseburia, Ruminococcus и др.), Bacteroides, Actinobacteria (Bifidobacterium, Collinsella), Fusobacteria, Proteobacteria (Bilophila, Escherichia и др.), Verrucomicrobia, Melainabacteria, Fungi (Saccharomyces и др.) [1]. Для адекватного представления микробиоты ЖКТ человека использована репрезентативная выборка бактерий кишечной микробиоты, сформированная на основании анализа 364 фекальных метагеномов здоровых добровольцев (таблица) [24]. Данная выборка репрезентативна и включает виды представителей микробиоты с учетом их распространенности в различных популяциях. Всего изучено 38 бактерий-комменсалов, которые относятся к различному 21 роду бактерий, представляют 80% микробиоты ЖКТ человека и существенно различаются по эффектам биохимического воздействия на организм человека (см. таблицу).
При проведении хемомикробиомного анализа D-маннозы, лактулозы, сорбита, ксилита и D-фруктозы моделировалось их воздействие в концентрации 10 ммоль/л, что приблизительно соответствует приему нескольких граммов метабиотика взрослым человеком и одновременно условиям культивирования бактерий (~1% сахаров). При моделировании принималось, что каждый штамм выращивается в стандартном анаэробном бульоне (так как все исследованные штаммы – анаэробы), а кривая роста демонстрирует зависимость оптической плотности от времени. Для того чтобы сопоставить результаты, в процессе подготовки данных для машинного обучения проводилась нормализация кривых роста. Процедура выполнения хемомикробиомного анализа подробно описана в работе И.Ю. Торшина и соавт. [25].
Результаты
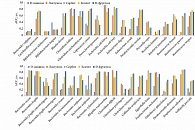
В результате хемомикробиомного анализа получены прогнозы нормализованных значений AUC (рис. 2). Для дальнейшего анализа отобраны только те данные, которые соответствовали значениям, статистически достоверно отличающимся от контрольных экспериментов (p < 0,05 при сравнении со стандартной средой выращивания бактерий) и со стандартным отклонением, не превышающим погрешность метода (в среднем 0,2 у.е.).
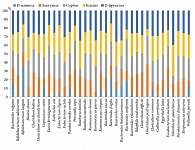
Сравнительный хемомикробиомный анализ метабиотиков D-маннозы, лактулозы, сорбита, ксилита и D-фруктозы позволил получить оценки значений AUC для 38 организмов-комменсалов микробиоты человека и вычислить профили воздействия метабиотиков на микробиом человека (рис. 3).
Обсуждение результатов
D-манноза
Хемомикробиомный анализ показал, что в среднем по репрезентативной выборке микробиоты D-манноза в значительно меньшей степени, чем другие вещества, поддерживала рост бактерий-комменсалов (AUC для D-маннозы – 0,13 ± 0,16, лактулозы – 0,42 ± 0,24, сорбита – 0,59 ± 0,24, ксилита – 0,55 ± 0,23, D-фруктозы – 0,58 ± 0,24). Действительно, хорошо известно, что D-манноза достаточно слабо метаболизируется в организме человека: до 90% выводится с мочой в течение 30–60 минут [26], практически не претерпевая существенных биотрансформаций. Экзогенная D-манноза, поступающая из пищи, усваивается микробиотой лишь частично [27].
Тем не менее в соответствии с результатами хемомикробиомного анализа именно D-манноза лучше остальных молекул способствовала росту бифидобактерий Bifidobacterium longum subsp. longum (AUC для D-маннозы – 0,38, молекул сравнения – от 0,17 до 0,18). Бифидобактерии – важнейший представитель микрофлоры человека (удельный вес в составе микробиоценозов составляет до 85%). Им принадлежит ведущая роль в нормализации микробиоценоза кишечника, поддержании неспецифической резистентности организма, улучшении процессов всасывания и гидролиза жиров, белкового и минерального обмена. Бифидобактерии вырабатывают масляную кислоту и другие короткоцепочечные жирные кислоты (КЦЖК) (уксусную, молочную, янтарную). Сниженное количество бифидобактерий в ЖКТ считается одним из патогенетических факторов хронических расстройств пищеварения.
В ходе исследования был получен важный результат: D-манноза была нейтральна и не влияла на рост патогенных бактерий Clostridium difficile, Clostridium perfringens DSM 756, Fusobacterium nucleatum DSM 15643 (AUC для D-маннозы – 0,04, молекул сравнения – 0,61–0,86). Отметим, что инвазия клостридиями ассоциирована с тяжелыми формами цистита. Несмотря на то что патогенные штаммы Clostridium difficile найдены в кишечнике у 50% новорожденных и 3–15% здоровых детей старше двух лет, а также у взрослых, эти бактерии являются основной причиной больничной диареи. Количество Clostridium difficile в составе нормальной микрофлоры кишечника здорового взрослого человека не должно превышать 0,01–0,001%. Токсикогенные штаммы клостридий продуцируют токсин А (энтеротоксин) и B (цитотоксин). Clostridium difficile – достаточно распространенная причина (30% случаев) антибиотик-ассоциированной диареи – одного из осложнений, которое возникает у 5–25% пациентов, получающих антимикробную терапию. Описаны случаи Clostridium difficile-зависимого эмфизематозного цистита, характеризующегося наличием газонаполненных кист в стенке мочевого пузыря и встречающегося при сахарном диабете [28].
Установлено, что D-манноза практически не поддерживала рост условно патогенных бактерий Clostridium perfringens DSM 756 (AUC для D-маннозы – 0,002, молекул сравнения – 0,08–0,40), которые могут приводить к анаэробной гангрене, антибиотик-ассоциированной диарее, некротическому энтериту при попадании в не подвергшиеся первичной хирургической обработке раны. Заболевания, вызванные Clostridium perfringens, серотип F, кодируются как «A05.2 Пищевое отравление, вызванное Clostridium perfringens (Clostridium welchii)» (некротический энтерит) и «B96.7 Clostridium perfringens как причина болезней, классифицированных в других рубриках». Инвазия мочевого пузыря Clostridium perfringens может стать причиной гангренозного цистита, сопровождаться септическим шоком и даже некрозом костного мозга [29].
D-манноза в наименьшей степени, чем молекулы сравнения, способствовала росту патогенных Fusobacterium nucleatum DSM 15643 (AUC для D-маннозы – 0,32, молекул сравнения – 0,63–0,80). Повышенная обсемененность бактериями Fusobacterium nucleatum ротовой полости связана с различными заболеваниями десен. Некоторые подвиды Fusobacterium способны проникать между клетками, образующими стенки кровеносных сосудов, и, перемещаясь с кровотоком, формировать колонии в самых разных органах и тканях организма-хозяина. Эти колонии запускают воспалительные процессы, стимулирующие развитие атеросклеротических бляшек, эрозии соединительной ткани клапанов сердца и хрящевой ткани суставов, хронических заболеваний легких, мозга, печени и мочеполовой системы.
Хемомикробиомный анализ значений минимальной подавляющей концентрации (minimum inhibitory concentration – MIC) показал, что D-манноза может тормозить рост некоторых болезнетворных организмов. Например, значение MIC Candida albicans для D-маннозы составило 5,35 мкг/мл (для молекул сравнения – 5,66–9,68 мкг/мл). Напомним, что Candida albicans присутствует у 80% людей, не приводя к развитию заболеваний. Однако на фоне иммунодефицита Candida albicans вызывает кандидоз. D-манноза тормозит рост возбудителя гриппа Haemophilus influenzae (MIC для D-маннозы – 4,19 мкг/мл, других молекул – 5,19–16,07 мкг/мл), возбудителя менингита, отита, синусита, внебольничной пневмонии Streptococcus pneumoniae (MIC для D-маннозы – 0,50 мкг/мл, других молекул – 0,37–0,87 мкг/мл) и возбудителя скарлатины Streptococcus pyogenes (MIC для D-маннозы – 0,28 мкг/мл, других молекул – 0,20–0,72 мкг/мл).
Таким образом, D-манноза не способствует размножению различных болезнетворных микроорганизмов и при этом поддерживает рост бифидобактерий Bifidobacterium longum, важных для здоровья микробиома.
D-фруктоза
D-фруктоза продемонстрировала одно из самых значимых влияний на рост исследованных комменсалов (AUC для D-фруктозы – 0,58 ± 0,24, остальных молекул – 0,13–0,59). Известно, что инулин стимулирует рост бифидобактерий Bifidobacterium adolescentis и Bifidobacterium bifidum [30]. D-фруктоза, образующаяся при переработке инулина в ЖКТ, может положительно влиять на численность и многих других представителей здоровой микробиоты (см. рис. 2), поддерживая синтез КЦЖК, врожденный иммунитет и другие полезные функции микробиоты.
КЦЖК полезны для колоноцитов (клеток толстой кишки), так как ответственны за выработку энергии и нормальный темп деления клеток. КЦЖК производятся бифидобактериями, лактобактериями, эубактериями, непатогенными клостридиями, бактероидами и другими представителями здоровой микробиоты.
Хемомикробиомный анализ показал, что лактулоза, сорбит, ксилит и D-фруктоза в одинаковой мере содействовали росту Lactobacillus paracasei ATCC SD5275 (AUC 0,711–0,791, нет статистически значимых различий), а также Eggerthella lenta DSM 2243 (AUC для D-фруктозы – 0,77, молекул сравнения – 0,54–0,86), которые в свою очередь способствуют колонизации стенок кишечника лактобактериями [31].
Эубактерии – представители типичной нормофлоры ЖКТ, значительная часть всех населяющих ЖКТ микроорганизмов. Они метаболизируют углеводы с накоплением КЦЖК (масляной в виде бутират-аниона, уксусной, муравьиной), используемых энтероцитами. Бутират-анион важен для колоноцитов, поскольку в случае его недостатка эти клетки подвергаются аутофагии [32]. Эубактерии Eubacterium rectale входят в состав микробиоты толстой кишки и представляют собой основных продуцентов масляной кислоты. D-фруктоза оказывала выраженное положительное воздействие на рост эубактерий Eubacterium rectale DSM 17629 (AUC для D-фруктозы – 0,53, молекул сравнения – 0,19–0,48).
В продукции масляной кислоты также участвуют непатогенные клостридии Clostridium bolteae DSM 15670 (AUC для D-фруктозы – 0,79, молекул сравнения – 0,58–0,83). Clostridium bolteae – представители нормальной микрофлоры кишечника, кожи и полости рта человека. Они продуцируют КЦЖК (масляную, изомасляную, валериановую, капроновую, изовалериановую, изокапроновую) [33]. Clostridium saccharolyticum DSM 2544 (AUC для D-фруктозы – 0,73, молекул сравнения – 0,55–0,74) метаболизируют различные сахара для употребления другими представителями микробиоты ЖКТ.
Bacteroides xylanisolvens HM-722 (AUC для D-фруктозы – 0,82, молекул сравнения – 0,59–0,83) участвуют в расщеплении ксилана, вырабатывают ацетат и пропионат [33]. Bacteroides ovatus ATCC-8483 (AUC для D-фруктозы – 0,83, молекул сравнения – 0,21–0,64), нормальные обитатели кишечника человека (1–3% от микробиома), расщепляют длинные цепи полисахаридов пищевых волокон и синтезируют янтарную и фенилуксусную кислоты. Таким образом, D-фруктоза – один из лучших метабиотиков для поддержания роста представителей микробиоты, синтезирующих КЦЖК.
Иммуномодулирующие эффекты исследованных представителей микробиоты осуществляются отчасти путем увеличения синтеза масляной кислоты, которая ингибирует сигнальные пути гамма-интерферона (STAT1) и гистон-деацетилазы [34, 35], а также является медиатором воспалительного ответа толстого кишечника [36]. Кроме того, исследованные представители микробиоты человека проявляют и более специфические иммуномодулирующие свойства. В частности, Blautia obeum DSM 25238 (AUC для D-фруктозы – 0,67, молекул сравнения – 0,23–0,67) ограничивает колонизацию холерных вибрионов. Данный эффект реализуется за счет повышения экспрессии гена luxS, кодирующего синтазу аутоиндуктора 2. Молекула аутоиндуктора 2 усиливает формирование бактериальных пленок нормальной микробиоты, предотвращает абсорбцию холерных вибрионов и подавляет оперон tcp холерных вибрионов, участвующий в синтезе холерного токсина [37].
D-фруктоза поддерживает рост руминококков Ruminococcus gnavus ATCC 29149 (AUC для D-фруктозы – 0,67, молекул сравнения – 0,08–0,59) и Ruminococcus torques ATCC 27756 (AUC для D-фруктозы – 0,71, молекул сравнения – 0,26–0,77), которые входят в число доминантных видов бактерий толстого кишечника (седьмое место по распространенности). Руминококки участвуют в переработке пищевых крахмалов и усвоении других растительных полисахаридов. Снижение популяции руминококков ослабляет антибактериальный иммунитет, поскольку руминококки продуцируют антибактериальное соединение руминококцин A, который активно подавляет рост патогенных клостридий [38, 39].
Поддерживаемые D-фруктозой стрептококки Streptococcus salivarius DSMZ 20560 (AUC для D-фруктозы – 0,89, молекул сравнения – 0,72–0,89) помогают функционированию барьерного иммунитета слизистых оболочек и регулируют воспалительный ответ. Streptococcus salivarius синтезируют бактериоцины, которые относятся к классу лантибиотиков – антимикробных полипептидов, содержащих редкие тиоэфирные аминокислоты лантионин и метиллантионин. Streptococcus salivarius обладают потенциалом в качестве пробиотика в микробиоме полости рта, снижают зубной налет за счет продуцирования бактериоцинов, нейтрализующих Streptococcus mutans, которые вызывают халитоз (плохой запах изо рта) и кариес [40, 41].
D-фруктоза положительно влияет на бактерии-комменсалы, которые способствуют всасыванию жиров. Например, было показано, что Clostridium ramosum DSMZ 1402 (AUC для D-фруктозы – 0,75, молекул сравнения – 0,24–0,73) усиливают усвоение углеводов и жиров при высокожировой диете [42]. Eggerthella lenta DSM 2243 (AUC для D-фруктозы – 0,77, молекул сравнения – 0,54–0,86) содержат гидролазу желчных кислот, активация которой ведет к колонизации стенок кишечника лактобактериями [31].
Синергизм D-маннозы и D-фруктозы
Уринарный микробиом, биомасса которого составляет 100–100000 КОЕ/мл, включает в свой состав лактобактерии (45%), гарднереллы и превотеллы (27%), энтеробактерии (9%), стафилококки (3%) бифидобактерии (2%) и др. [43, 44]. Патогенез хронических инфекций мочеполовых путей, в том числе цистита, зависит не только от определенных патогенных штаммов Escherichia coli и других патогенов, но и от состояния уринарного микробиома в целом. В частности, в развитии инфекций мочеполовых путей значительную роль играют вирусные инфекции [45], снижение популяции лактобактерий и увеличение популяции гарднерелл [44]. Эти и другие изменения уринарного микробиома ассоциированы с повышением уровней провоспалительных цитокинов [46].
Известны высокая эффективность и безопасность использования D-маннозы в терапии цистита: она непосредственно блокирует адгезию патогенных штаммов Escherichia coli, вызывающих цистит [16]. Хемомикробиомный анализ показал, что молекулы D-маннозы крайне слабо могут стимулировать рост исследованных штаммов кишечной палочки. Escherichia coli – один из важных конкурентов условно патогенной микрофлоры и важна для выработки КЦЖК. В то же время D-фруктоза способствует размножению полезных штаммов кишечной палочки Escherichia coli ED1a (AUC для D-фруктозы – 0,82, молекул сравнения – 0,71–0,92) и Escherichia coli IAI1 (AUC для D-фруктозы – 0,82, молекул сравнения – 0,60–0,86). D-фруктоза, которая усваивается бактериями после расщепления инулина, относится к числу лучших метабиотиков для поддержки синтеза масляной кислоты и других КЦЖК, врожденного иммунитета, всасывания жиров и противодействия росту патогенных бактерий. Поскольку D-манноза влияет на полезную микробиоту в гораздо меньшей степени, чем D-фруктоза, то для усиления ее метабиотических свойств перспективным представляется сочетанное использование D-маннозы и инулина (источника молекул D-фруктозы для микробиоты). Это позволит блокировать абсорбцию уропатогенных форм Escherichia coli при цистите, положительно влиять на рост полезных штаммов Escherichia coli и здоровье микробиома человека в целом (см. рис. 2), в том числе рост лакто- и бифидобактерий.
Комбинация «D-манноза + инулин» доступна на российском рынке. Так, препарат Экоцистин содержит значительные дозы D-маннозы (1500 мг) и инулина (1492,5 мг) в одном саше для приготовления раствора для питья [47]. Этих количеств вполне достаточно и для поддержания полезной микробиоты, и для торможения абсорбции уропатогенных штаммов Escherichia coli. В общем случае терапевтический эффект может быть достигнут употреблением одного саше в сутки. При лечении тяжелых форм цистита доза может быть увеличена в два – четыре раза.
Заключение
Использование метабиотиков можно назвать одним из эффективных и безопасных способов оздоровления кишечного и уринарного микробиомов. Анализ воздействия того или иного метабиотика на различных представителей микробиома важен для комплексной оценки фармакологического действия соответствующего препарата.
Полученные результаты количественно обосновывают эффекты изученных метабиотических молекул на конкретные штаммы позитивной или нейтральной микрофлоры ЖКТ, в том числе воздействие на синтез КЦЖК. Они также позволяют анализировать целесообразность сопровождения той или иной фармакотерапии приемом D-маннозы, лактулозы, сорбита и др.
Хемомикробиомный анализ показал, что D-манноза, хотя и слабо поддерживает рост большинства исследованных представителей полезной микробиоты, но все же может тормозить рост различных представителей патогенной флоры. Кроме того, D-манноза в большей степени, чем молекулы сравнения, способствует росту бифидобактерий Bifidobacterium longum, продуцирующих масляную кислоту и другие КЦЖК, тем самым оздоровляя кишечный микробиом.
Результаты проведенного хемомикробиомного анализа указали на целесообразность дополнения метабиотических эффектов D-маннозы эффектами инулина, образованного из молекул D-фруктозы. Синергидное сочетание «D-манноза + инулин» будет стимулировать рост многих представителей здоровой микробиоты, в том числе бифидо- и лактобактерий, поддерживать синтез КЦЖК, функцию врожденного иммунитета, блокируя абсорбцию уропатогенных форм Escherichia coli и одновременно содействуя росту полезных штаммов Escherichia coli. Совместное применение D-маннозы и инулина будет оздоровлять и кишечный, и уринарный микробиом, снижая воспаление и способствуя более быстрому восстановлению микробиоты пациентов после антибиотикотерапии.
Работа выполнена при поддержке гранта РФФИ № 18-07-00944.
I.Yu. Torshin, PhD, A.N. Galustyan, PhD, М.I. Ivanova, A.K. Khadzhidis, PhD, O.A. Gromova, PhD, Prof.
Federal Research Center ‘Computer Science and Control’ of the Russian Academy of Sciences, Moscow
St. Petersburg State Paediatric Medical University
Big Data Storage and Analysis Center, Moscow
Contact person: Olga A. Gromova, olga_gromova@rambler.ru
This paper presents the results of comparative chemomicrobiomic analysis of D-mannose, lactulose, sorbitol, xylitol and D-fructose (the structural basis of inulin), made with the use of modern technologies of big data analysis. For each of the studied molecules, estimations of the area under the normalized growth curve were obtained for the representative sample of the human microbiota, which included 38 commensal bacteria, including Bifidobacterium and Lactobacillus. The values of the minimum suppressing concentration for 42 pathogenic (bacterial and fungal) microorganisms were calculated. Previously, the high efficiency and safety of using D-mannose in the treatment of cystitis were established: by blocking the fimbriae of pathogenic bacteria (for example, uropathogenic strains of Escherichia coli), D-mannose inhibits the development of urinary tract infections. In the course of chemomicrobiomic analysis, it was shown that in comparison with other metabiotics, D-mannose contributes less to the growth of conditionally pathogenic bacteria in the human microbiome and more to the growth of Bifidobacterium longum subsp. longum, which produce butyric acid and other short-chain fatty acids. The results of chemomicrobiomic analysis indicate the prospects of supplementing the metabiotic effects of D-mannose with the effects of inulin formed from D-fructose molecules for activation of the synthesis of short-chain fatty acids, support of innate immunity and growth of beneficial Escherichia coli strains.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.