Клинический случай: хронический инвазивный грибковый полисинусит у пациента с острым миелобластным лейкозом на фоне проведения противоопухолевой терапии
- Аннотация
- Статья
- Ссылки
- English
Введение
Впервые вопрос о микотическом поражении полости носа и верхнечелюстной пазухи был поднят J. Schubert (1889) и Н. McKenzie (1893) [1]. С этого момента исследователи всего мира активно начали изучать этиологию, патогенез, диагностику и лечение грибкового риносинусита. В отечественной литературе наиболее полное описание грибкового поражения носа и околоносовых пазух принадлежит В.Я. Кунельской (1989) [2]. По данным различных авторов, от 5 до 96% хронических риносинуситов имеют грибковую этиологию [3–5].
Однако, несмотря на столь широкий диапазон эпидемиологических показателей, долгое время заболевание считалось редко встречающимся [1]. В настоящее время в литературе нет четких статистических данных по распространенности грибкового риносинусита. Но однозначно авторы отмечают выраженную тенденцию к росту заболеваемости, особенно за последние десятилетия [6–8].
Известно более 100 тыс. видов грибов. Возбудители микозов могут быть условно подразделены на две группы: грибы с «истинным» паразитарным диморфизмом и условно-патогенные: дрожжеподобные и плесневые грибы [9, 10]. Существуют неинвазивная и инвазивная формы грибкового риносинусита. К неинвазивной форме относят мицетому, или грибковое тело околоносовой пазухи, – это хронический аллергический грибковый синусит. Причиной неинвазивной формы грибкового риносинусита в 90% случаев является аспергиллезное поражение [1, 2].
Отличительная черта инвазивных грибковых риносинуситов – наличие деструкции костных стенок околоносовых пазух, а также сосудистой инвазии [11, 12]. Причиной инвазивной формы грибкового риносинусита является группа мицелиальных возбудителей порядка Mucorales, которые широко распространены в окружающей среде. Вследствие этого данная форма заболевания получила название «мукормикоз» [7, 8].
Развитие той или иной формы во многом зависит от иммунологического состояния макроорганизма. Острые инвазивные грибковые синуситы обычно встречаются у иммунокомпрометированных пациентов, в то время как хронические инвазивные и неинвазивные синуситы характерны для пациентов с нормальным иммунным статусом (иммунокомпетентных) [6, 13].
К группе риска развития мукормикоза околоносовых пазух следует отнести пациентов с онкогематологическими заболеваниями (до 50% всех случаев) и больных сахарным диабетом (до 23%) [14, 15]. Особое распространение инвазивная форма грибкового риносинусита получила во время пандемии COVID-19 в виде осложнения у пациентов с новой коронавирусной инфекцией на фоне длительного курса терапии глюкокортикостероидами [5, 7, 8]. Высокий риск развития мукормикоза отмечается у пациентов с синдромом приобретенного иммунодефицита (СПИД), больных с бронхиальной астмой и у пациентов, получающих агрессивную антибактериальную терапию [7, 14, 15].
Среди гематологических заболеваний к группе повышенного риска развития инвазивных микозов относятся пациенты с острым миелобластным лейкозом в период проведения противоопухолевой терапии [6, 7]. У большинства этих пациентов для обеспечения долгосрочной выживаемости программной химиотерапии недостаточно, в связи с чем главным способом лечения является аллогенная трансплантация гемопоэтических стволовых клеток (аллоТГСК). Развитие мукормикоза околоносовых пазух на этапе химиотерапии может быть препятствием для своевременного проведения аллоТГСК [16, 17].
Представляем клинический случай инвазивного грибкового полисинусита у пациента с острым миелобластным лейкозом на фоне проведения противоопухолевой терапии.
Клинический случай
Пациентка К., 34 года, с диагнозом «острый миелоидный лейкоз, комплексный кариотип, группа неблагоприятного риска» (по классификации ELN 2022 от 11.01.2022). Диагноз впервые установлен в 2022 г. Был проведен курс индукции ремиссии «7 + 3» (непрерывное введение цитарабина в течение семи дней и болюсное введение митоксантрона в течение трех дней): ремиссия не была достигнута.
В период с февраля 2022 г. по ноябрь 2023 г. больной провели:
- три курса консолидации ремиссии высокими дозами цитарабина;
- два цикла терапии по схеме «венетоклакс + цитарабин»;
- один курс по схеме НАМ (высокие дозы цитарабина + митоксантрон);
- два курса по схеме FLAG-mito (флударабин + цитарабин + митоксантрон + филграстим);
- курс по схеме «5 + 5» (цитарабин + митоксантрон в течение пяти дней).
Между курсами химиотерапии наблюдались непродолжительные периоды костномозговой ремиссии. Продолжительная ремиссия острого миелоидного лейкоза была достигнута в декабре 2023 г. В связи с прогрессированием основного заболевания развилась панцитопения на фоне аплазии костного мозга, в результате чего пациентке проводилась регулярная заместительная терапия компонентами крови.
В июле 2023 г. у пациентки диагностировали правосторонний гемисинусит (без деструкции костных стенок околоносовых пазух) и правостороннюю полисегментарную пневмонию.
Пациентка была госпитализирована в многопрофильный стационар, где получила несколько курсов антибактериальной терапии (азтреонам, цефтазидим, авибактам, тигециклин). Однако, несмотря на проводимое лечение, по данным компьютерной томографии (КТ) органов грудной клетки и околоносовых пазух отмечалось прогрессирование заболевания. К терапии добавлены антимикотические препараты амфотерицин В и позаконазол. Для санации очага инфекции после разрешения пневмонии была проведена санирующая операция в объеме эндоскопической правосторонней полисинусотомии. Во время проведения хирургического вмешательства был взят материал для патогистологического исследования, в результате которого установлена инвазия в слизистую оболочку. Результат исследования: фрагменты слизистой полости носа, частично выстланные респираторным эпителием, с фиброзом, элементами грибкового поражения (сходного с мукормицетами). После проведенного курса стационарного лечения пациентка была выписана под наблюдение онкогематолога для продолжения курса химиотерапевтического лечения. Был продолжен курс антимикотической терапии (амфотерицином В) и заместительной терапии компонентами крови.
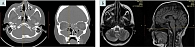
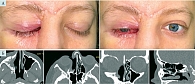
В сентябре 2023 г. проведена контрольная КТ околоносовых пазух – выявлено прогрессирование воспалительного процесса в объеме двустороннего поражения околоносовых пазух без деструкции костных стенок (рис. 1). Жалоб и клинических проявлений риносинусита у пациентки не выявлено. Была продолжена антимикотическая терапия и химиотерапевтическое лечение до ноября 2023 г. В феврале 2024 г. появилось гноетечение из медиального угла правого глаза. Для исключения инвазивной формы грибкового риносинусита (риноцеребрального мукормикоза) была проведена магнитно-резонансная томография (МРТ) головного мозга. Выявлен односторонний процесс: поражение правой верхнечелюстной и лобной пазух, клеток решетчатого лабиринта справа с разрушением медиальной стенки правой глазницы, распространение процесса в полость черепа через решетчатую пластинку справа (передний отдел основания черепа) без распространения в головной мозг (см. рис. 1). Пациентку консультировали в Московском центре глубоких микозов и актиномикоза очно, в НИИ медицинской микологии им. П.Н. Кашкина (г. Санкт-Петербург) дистанционно – была скорректирована противогрибковая терапия и рекомендовано хирургическое лечение.
В апреле 2024 г. пациентка поступила в оториноларингологическое отделение Научно-образовательного института клинической медицины им. Н.А. Семашко Российского университета медицины Минздрава России. Жалобы при поступлении: гноетечение из правого глаза, покраснение правого глаза, затруднение носового дыхание справа, образование «корок» в правой половине носа.
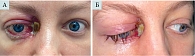
При передней риноскопии: слева – без особенностей; справа полость носа обтурирована корками серо-зеленоватого оттенка, признаков кровотечения нет, отделяемого нет, носовое дыхание справа затруднено. Другие лор-органы без патологических изменений. В области медиального угла правого глаза гнойная корка, гнойное отделяемое. После удаления корки визуализируется участок деваскуляризированной костной ткани. Покраснение и отечность конъюнктивы правого глаза (рис. 2).
Пациентку осмотрел офтальмолог, установил диагноз «грибковая орбитальной флегмона без нарушения зрения». Даны рекомендации по антисептической обработке правого глаза.
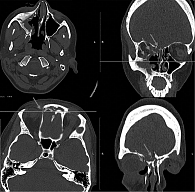
Проведена КТ околоносовых пазух: выявлено тотальное затемнение правой верхнечелюстной пазухи с признаками остеита ее стенок, затемнение сохранившихся клеток решетчатого лабиринта с признаками костной деструкции межъячеистых перегородок, тотальное затемнение правой лобной пазухи, костная деструкция нижней и медиальной костных стенок правой глазницы, деструкция костей наружного носа и лобного отростка верхней челюсти, прилегающих к медиальному углу правого глаза (рис. 3).
После проведения курса гемотрансфузий (эритроцитарной массы и тромбоконцентрата) проведено хирургическое лечение в объеме расширенной эндоскопической правосторонней полисинусотомии с удалением некротизированных костных структур клеток решетчатого лабиринта справа, медиальной стенки правой глазницы и наружного носа, эндоскопической правосторонней фронтотомии под общей анестезией. Во время операции эндоскопическим доступом были удалены деваскуляризированные костные фрагменты, а также некротизированные участки мягких тканей до визуально здоровой и хорошо кровоснабжающейся ткани.
После удаления всех клеток решетчатого лабиринта справа была удалена и деваскуляризированная решетчатая пластинка – обнажена неповрежденная воспалительным процессом твердая мозговая оболочка, ликвореи не было. Затем сформировано широкое сообщение полости носа с правой лобной пазухой – удалено ее содержимое в виде полипозно утолщенной слизистой оболочки и грануляций. Далее наружным доступом удалены нежизнеспособные костные структуры наружного носа и лобного отростка правой верхней челюсти в области медиального угла правого глаза. Завершилась операция тампонадой правой половины носа. Во время операции был взят мазок для проведения микробиологического исследования. Удаленный интраоперационный материал направлен на патогистологическое исследование. Операцию пациентка перенесла хорошо, через два дня тампон из правой половины носа был удален. В послеоперационном периоде проводились контроль показателей крови, гемотрансфузии, ежедневные перевязки. После стабилизации общего и местного статуса пациентку выписали из стационара и наблюдали амбулаторно.
Патогистологическое заключение: фрагменты некротизированной губчатой и компактной кости, с очаговой плотной лимфоплазмоцитарной инфильтрацией, с обилием сегментоядерных лейкоцитов и эритроцитов, крупных скоплений колоний кокковой флоры в межбалочных пространствах, с разрастанием грануляционной ткани, с участками фиброза и некроза с включением инородных тел в виде «мячиков для гольфа», с элементами грибкового поражения.
Результат микробиологического исследования: Klebsiella pneumoniae spp. pneumoniae 106, концентрация в КОЕ (1 г; 1 мл), резистентный ко всем основным видам антибактериальных препаратов, кроме тигециклина, колистина, полимиксина В. Затем пациентка получила курс антибактериальной терапии препаратом тигециклин в течение 10 дней.
При микробиологическом исследовании венозной крови роста грибковой микрофлоры не выявлено.
После выписки из стационара был продолжен курс антимикотической терапии (амфотерицином В) и заместительной терапии компонентами крови.
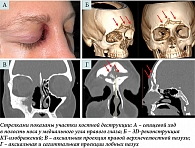
Через месяц после операции (в мае 2024 г.) было отмечено улучшение носового дыхания справа, отсутствие патологического отделяемого из носа и правого глаза, сформировался свищевой ход в полость носа у медиального угла правого глаза без признаков воспаления. Однако пациентка начала отмечать периодическое появление головной боли в области лба, преимущественно на правой стороне. На контрольной КТ околоносовых пазух выявлена положительная динамика в виде исчезновения деструктивного воспаления в правой верхнечелюстной пазухе (с признаками остеита ее стенок) и правой половине носа, отсутствие патологических изменений передних отделов основания черепа над решетчатой пластинкой и мягких тканей правой глазницы вдоль ее медиальной стенки. Однако обнаружено прогрессирование воспаления в правой лобной пазухе с распространением на левую лобную пазуху, возникновение костной деструкции костных стенок обеих лобных пазух (рис. 4).
Пациентка повторно госпитализирована в стационар. После предоперационной подготовки и курса гемотрансфузий (эритроцитарной массы и тромбоконцентрата) в июне 2024 г. было проведено хирургическое вмешательство в объеме открытой расширенной двусторонней фронтальной синусотомии, эндоскопической ревизии правой верхнечелюстной пазухи и передних отделов основания черепа с одномоментной пластикой свищевого дефекта. Во время операции наружным доступом проведено удаление деваскуляризированной костной ткани до визуально здоровых и хорошо кровоснабжающихся костных структур – таким образом удалена большая часть передних стенок обеих лобных пазух, а также некротизированный участок правой лобной кости, распространявшийся наверх по межкортикальному пространству. При эндоскопической ревизии правой верхнечелюстной пазухи обнаружена ее рубцовая облитерация без признаков воспалительных изменений, рубцы частично удалены. Завершилась операция пластикой свищевого дефекта подглазничным кожно-мышечным лоскутом на питающей ножке.
В послеоперационном периоде в стационаре был проведен курс антимикотической терапии препаратом изавуконазол в течение 14 дней, проводился контроль показателей крови, гемотрансфузии, ежедневные перевязки, поэтапное удаление швов. После стабилизации общего и местного статуса пациентка была выписана и наблюдалась амбулаторно.
Через два месяца после хирургического вмешательства (август 2024 г.) пациентка отмечала, что головная боль и нарушения носового дыхания ее больше не беспокоят, отсутствовали также патологические выделения из правого глаза. При осмотре: проекция лобных пазух без патологических изменений, раны зажили первичным натяжением. Отсутствуют дефект в области медиального угла правого глаза, птоз верхнего века из-за рубцовых изменений, энофтальм. При эндоскопическом осмотре левой половины полости носа: без особенностей, справа – слизистая оболочка розовая, без признаков воспаления, рубцовые изменения в правой верхнечелюстной пазухе, вдоль стенки глазницы и основания черепа, отсутствуют средняя и верхняя носовые раковины, нижняя носовая раковина не увеличена, рубцово изменена, отделяемого нет. На КТ околоносовых пазух через два месяца после повторного хирургического вмешательства не было выявлено признаков костно-деструктивных и воспалительных изменений (рис. 5).
При последующих контрольных осмотрах не выявлено признаков грибкового поражения. В ноябре 2024 г. после комплексного обследования и предоперационной подготовки в профильном учреждении пациентке была проведена аллоТГСК.
Обсуждение
Представленный клинический случай демонстрирует успешные диагностические и лечебные мероприятия в сложной клинической ситуации – редкого жизнеугрожающего осложнения противоопухолевой терапии острого миелоидного лейкоза. Мукормикоз – быстропрогрессирующая угрожающая жизни инфекция. Летальность при риноцеребральной форме мукормикоза может достигает 100% [18]. Поэтому крайне важно для предотвращения распространения инфекции в головной мозг и органы зрения как можно раньше диагностировать заболевание и назначить лекарственную терапию. Следует помнить, что грибы Mucorales относятся к возбудителям, резистентным к большинству противогрибковых средств, поэтому решающее значение имеет наступление ремиссии основного заболевания и раннее проведение хирургического лечения [6, 7, 19].
Чтобы избежать рецидивов заболевания и полностью ликвидировать деструктивный воспалительный процесс, объем санирующего вмешательства должен быть наиболее радикальным. Примененный эндоскопический подход при первой операции обеспечил малую травматичность, небольшой объем кровопотери, хорошую визуализацию внутренних структур полости носа и околоносовых пазух, но оказался недостаточным для полного удаления инфекционного патологического субстрата в правой лобной пазухе.
Заключение
В настоящее время инвазивные грибковые риносинуситы получили широкое распространение. Половина пациентов с мукормикозом околоносовых пазух – это больные, страдающие онкогематологическими заболеваниями и получающие противоопухолевую терапию. Для успешного лечения данной категории больных необходимо междисциплинарное взаимодействие врачей далеко не смежных на первый взгляд специальностей – онкогематологов и оториноларингологов, а также челюстно-лицевых хирургов, нейрохирургов. Представленный клинический случай продемонстрировал успешный опыт такого взаимодействия и открыл перспективы развития совместной работы в будущем.
Конфликт интересов. Авторы заявляют об отсутствии конфликта интересов.
D.N. Atlashkin, A.Yu. Ovchinnikov, M.A. Edzhe, O.B. Kulakov, A.Yu. Shcherbakov
Russian University of Medicine
Contact person: Denis N. Atlashkin, dr.atlashkin@mail.ru
This article presents a case study of successful treatment for chronic invasive fungal sinusitis in a person with acute leukemia during chemotherapy. The successful treatment of this type of patient requires interdisciplinary collaboration between oncologists and hematologists, otolaryngologists, maxillofacial surgeons, and neurosurgeons to avoid relapse and completely eradicate the inflammatory process. To achieve this, the scope of surgical intervention must be as extensive as possible.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.


