Компьютерная (электронная) модель витального прогноза у пациентов с начальной меланомой хориоидеи
- Аннотация
- Статья
- Ссылки
- English
Материал и методы. Для создания компьютерной (электронной) модели витального прогноза пациентов после энуклеации по поводу начальной меланомы хориоидеи папиллярной локализации применяли компьютерную предобработку данных 31 пациента в возрасте в среднем 59,67 ± 4,2 года. Использовали патоморфологические параметры и критерии опухолевого клеточного микроокружения. Выполняли построение статистических моделей.
Результаты. Доверительный интервал статистически достоверных факторов отделен от нуля. На основании этого сделан однозначный вывод, что наличие миелоидных клеток супрессорного происхождения (промиелоцитов) в ткани опухоли является фактором, повышающим риск смерти от метастатической болезни при меланоме хориоидеи. Наличие плазмоцитов, напротив, рассматривается как фактор, снижающий риск смерти.
Определена формула функции риска: Hi(t) = h0(t) × exp
(-0,3150083536330702 × х1
+0,3279865936177689 × х2
+0,013793792320692503 × х3
-0,5917623519392681 × х4
+0,0700743147993131 × х5
-3,296382837585438 × х6
+3,624943885623139 × х7
+0,6773504841265628 × х8).
Формула зависимости функции риска от времени представлена в виде: h(t) = ho(t) exp (b1x1 + b2x2 + ... + bpxp),
где Xj – объясняющие переменные;
bj – подбираемые коэффициенты.
На основании полученной формулы создана программа, включающая в себя параметры опухолевого клеточного микроокружения меланомы хориоидеи, позволяющие прогнозировать выживаемость каждого пациента.
Заключение. Компьютерная (электронная) модель витального прогноза, полученная на основе анализа выживаемости пациентов после энуклеации по поводу меланомы хориоидеи, позволяет прогнозировать сроки смерти пациента от метастатической болезни. Полученные временные параметры модели предполагают изменение тактики ведения пациентов после энуклеации по поводу начальной меланомы хориоидеи, распространяющейся на диск зрительного нерва. К таким изменениям необходимо отнести сокращение периодичности осмотров и обследований пациентов с меланомой хориоидеи (ПЭТ-КТ три раза в год) с консультацией онколога с целью планирования системной таргетной и иммунотерапии.
Материал и методы. Для создания компьютерной (электронной) модели витального прогноза пациентов после энуклеации по поводу начальной меланомы хориоидеи папиллярной локализации применяли компьютерную предобработку данных 31 пациента в возрасте в среднем 59,67 ± 4,2 года. Использовали патоморфологические параметры и критерии опухолевого клеточного микроокружения. Выполняли построение статистических моделей.
Результаты. Доверительный интервал статистически достоверных факторов отделен от нуля. На основании этого сделан однозначный вывод, что наличие миелоидных клеток супрессорного происхождения (промиелоцитов) в ткани опухоли является фактором, повышающим риск смерти от метастатической болезни при меланоме хориоидеи. Наличие плазмоцитов, напротив, рассматривается как фактор, снижающий риск смерти.
Определена формула функции риска: Hi(t) = h0(t) × exp
(-0,3150083536330702 × х1
+0,3279865936177689 × х2
+0,013793792320692503 × х3
-0,5917623519392681 × х4
+0,0700743147993131 × х5
-3,296382837585438 × х6
+3,624943885623139 × х7
+0,6773504841265628 × х8).
Формула зависимости функции риска от времени представлена в виде: h(t) = ho(t) exp (b1x1 + b2x2 + ... + bpxp),
где Xj – объясняющие переменные;
bj – подбираемые коэффициенты.
На основании полученной формулы создана программа, включающая в себя параметры опухолевого клеточного микроокружения меланомы хориоидеи, позволяющие прогнозировать выживаемость каждого пациента.
Заключение. Компьютерная (электронная) модель витального прогноза, полученная на основе анализа выживаемости пациентов после энуклеации по поводу меланомы хориоидеи, позволяет прогнозировать сроки смерти пациента от метастатической болезни. Полученные временные параметры модели предполагают изменение тактики ведения пациентов после энуклеации по поводу начальной меланомы хориоидеи, распространяющейся на диск зрительного нерва. К таким изменениям необходимо отнести сокращение периодичности осмотров и обследований пациентов с меланомой хориоидеи (ПЭТ-КТ три раза в год) с консультацией онколога с целью планирования системной таргетной и иммунотерапии.
Введение
Увеальная меланома (УМ) − заболевание, сопровождающееся метастазированием. Отсутствие своевременного лечения приводит к смерти больных. Почти у 50% пациентов с меланомой хориоидеи метастазы развиваются в течение десяти лет после лечения и зависят от размера опухоли, локализации, типа клеток, плотности сосудистой сети, цитогенетики и состояния иммунного статуса, возраста, пола [1, 2].
Согласно теории S. Eskelin и T. Kivela, системные микрометастазы присутствуют в организме за несколько лет до первичного лечения опухоли [3]. Размер образования – важный прогностический фактор. Предполагается, что метастазирование происходит при среднем диаметре основания 3 мм и проминенции 1,5 мм [3]. Однако существует мнение, что прогноз в отношении меланомы малого размера более благоприятный, чем в отношении большой опухоли [4, 5].
Результаты исследований показали низкий уровень смертности у пациентов с малыми опухолями по сравнению с пациентами с опухолями средних и больших размеров (десятилетняя выживаемость – 25 и 45% соответственно) [6].
По данным С.L. Shields и соавт., на значимой когорте 8033 пациентов с УМ доказано, что через пять, десять и 20 лет после лечения метастатическую болезнь диагностировали при малых размерах в 6, 12 и 20% случаев, средних – в 14, 26 и 37%, больших – в 35, 49 и 67% случаев соответственно [6].
Несмотря на наличие определенного количества работ по исследуемому вопросу, остаются не до конца изученными выживаемость пациентов после органосохранного и ликвидационного лечения и значение комплекса патоморфологических факторов и опухолевого клеточного микроокружения в витальном прогнозе больных с начальной меланомой хориоидеи. Создание компьютерных (электронных) моделей для определения сроков выживаемости в зависимости от комплекса факторов опухолевого клеточного микроокружения, позволяющих индивидуально планировать этапы динамического контроля за пациентами с УМ, ранее не выполняли.
Материал и методы
Выявлены независимые факторы и построена модель для прогнозирования выживаемости пациентов после энуклеации по поводу начальной меланомы хориоидеи, распространяющейся на диск зрительного нерва.
Создание прогностической компьютерной (электронной) модели включало несколько этапов:
- оценка показателей неблагоприятного течения опухолевого процесса и выживаемости пациентов с начальной меланомой хориоидеи (результативные признаки);
- в когорте из 31 пациента с начальной меланомой хориоидеи проведен однофакторный анализ с определением типа функции зависимости фактора и результативного признака;
- создание многомерной корреляционной матрицы отобранных при однофакторном анализе детерминант, предоставляющих информацию о степени влияния на результативные каждой переменной и их взаимодействие между собой;
- многофакторный анализ с использованием регрессионной модели Кокса для выявления независимых предикторов, значимо влияющих на результативные признаки;
- создание реализованной в среде программирования интеллектуальной научно обоснованной системы визуализации функции неблагоприятного течения опухолевого процесса и выживаемости для заданных независимых предикторов пациентов с начальной меланомой хориоидеи.
Для формирования прогностической модели применяли описание метода модели, выполнены анализ данных и препроцессинг, перебор гиперпараметров, выбор параметров лучшей модели, анализ найденных зависимостей, описание общих характеристик модели, визуализация коэффициентов доверительных интервалов, разработаны формулы функции риска, построены графики частных влияний ковариант на риск гибели пациентов с метастатической болезнью.
Аналитическими критериями служили определенные параметры опухолевого клеточного микроокружения (в сочетании с неблагоприятными патоморфологическими факторами):
- степень инфильтрации лимфоцитами опухолевого узла (х1);
- концентрация лимфоцитов вокруг ткани меланомы (х2);
- распространенность лимфоцитов на протяжении от опухолевой ткани (х3);
- количество тучных клеток в опухоли и вокруг нее (х4);
- наличие нейтрофилов (х5), плазмоцитов (х6), промиелоцитов (x7), присутствие эозинофилов (х8).
С целью создания модели для более углубленного анализа проведена градация степени инфильтрации лимфоцитами различных зон меланомы хориоидеи, прилежащих отделов и по их количеству установлена 1-я степень – до 10 клеток, 2-я степень – 11–30 клеток, 3-я степень – 31 клетка и более.
Расширенную градацию степени инфильтрации остальными клетками определяли по их количеству в ткани меланомы и вокруг нее: 1-я степень – 1–3 клетки, 2-я степень – 4–6 клеток, 3-я степень – 6 и более клеток, 0 – отсутствие изучаемых клеток в микроокружении опухоли.
Для анализа установили даты энуклеации с точностью до дня и жизненный статус (жив или умер пациент) на дату фиксации (5 ноября 2020 г.). Интервал от дня операции до дня фиксации или дня смерти округляли с точностью до недель и преобразовывали в столбец таблицы данных.
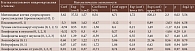
С целью нахождения наилучшего варианта построены модели, основанные на гиперпараметрах алгоритма оценивания и гиперпараметрах, специфичных для алгоритма оценивания. Наилучшую модель выбирали по критериям алгоритма Ньютона – Рапсона нахождения модельных коэффициентов, который сошелся (converged) в настоящем исследовании, и показателя AIC из информационного критерия Акаике, который оказался минимален по полученным моделям. Применяли метод оценивания Бреслова, без регуляризации AIC 63.03.
Результаты
На основании метода Бреслова получили гиперпараметры регуляризации (penalizer = 0.1, l1_ratio = 1.0 Partial AIC 70.80; penalizer = 0.05, l1_ratio = 1.0 Partial AIC 68.15; penalizer = 0.05, l1_ratio = 0.5 Partial AIC 67.42; penalizer = 0.01, l1_ratio = 0.5 Partial AIC 64.27). Использовали метод оценивания кубических сплайнов, гиперпараметры количества узлов (4 AIC 132.98; 2 AIC 152.52; 8 AIC 141.09) (таблица). Найдены параметры лучшей модели методом оценивания (estimator) Бреслова без регуляризации, который сошелся за пять итераций, AIC 63.03.
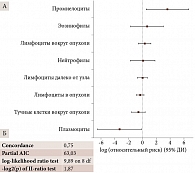
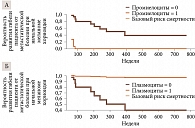
Доверительный интервал (ДИ) статистически достоверных факторов отделен от нуля. Это позволяет сделать однозначный вывод, что наличие миелоидных клеток супрессорного происхождения (промиелоцитов) в ткани опухоли служит фактором, повышающим риск смерти пациента от метастатической болезни при меланоме хориоидеи. Наличие плазмоцитов, напротив, фактор, снижающий риск гибели больного (рис. 1 и 2).
Определена формула функции риска: Hi(t) = h0(t) × exp
(-0,3150083536330702 × х1
+0,3279865936177689 × х2
+0,013793792320692503 × х3
-0,5917623519392681 × х4
+0,0700743147993131 × х5
-3,296382837585438 × х6
+3,624943885623139 × х7
+0,6773504841265628 × х8).
За основу создания модели брали регрессионную модель Кокса пропорциональных рисков и некоторые ее модификации.
Формула зависимости функции риска от времени представлена в виде: h(t) = ho(t) exp (b1x1 + b2x2 + ... + bpxp),
где Xj – объясняющие переменные;
bj – подбираемые коэффициенты.
На основании полученной формулы создана программа, включающая в себя параметры опухолевого клеточного микроокружения меланомы хориоидеи, позволяющие прогнозировать выживаемость каждого пациента.
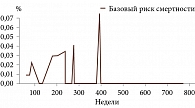
Электронный адрес модели: http://service.antshealth.tech/medical-predicts/lifelen-by-uvenal-measured-tabular. Пароль – WH76n3wZ. Динамика риска смертности по неделям независимо от дополнительных факторов риска представлена на рис. 3 и 4.
Обсуждение
Показатель выживаемости онкологических больных является важнейшим критерием объективной оценки деятельности онкологической службы [7]. Ученые провели исследования выживаемости при начальной меланоме хориоидеи [8]. После энуклеации при средней продолжительности наблюдения 7,2 года 9,2% больных умерли от метастатической болезни через 5,8 года после операции [9]. Пятилетняя смертность при начальной меланоме составляет 1% [10]. По мнению других исследователей, пятилетняя частота метастазирования и смертность пациентов с начальной меланомой хориоидеи после брахитерапии составляет 3,9%, семилетняя – 9,5% [11]. Так, по мнению A. Malclès и соавт., частота развития метастатической болезни при малых опухолях составляет 10% после брахитерапии и облучения узким медицинским протонным пучком [12]. По данным A.M. Lane и соавт., пяти-, десяти- и 15-летняя смертность от метастатической болезни при начальной меланоме хориоидеи составляет 2, 5 и 7% соответственно [10]. Аналогичные данные в ходе исследований получили С.L. Shields и соавт. [6]. E. Semenova и P.T. Finger, напротив, при исследовании 72 пациентов после брахитерапии ни в одном случае не выявили метастатической болезни при минимальном сроке наблюдения восемь месяцев [13].
Раннее развитие метастатической болезни, снижающей сроки выживаемости, диктует необходимость постоянных динамических осмотров пациентов с УМ после проведенного лечения. Диспансерное наблюдение осуществляется врачом-офтальмологом каждые три месяца в течение первого года. Далее – один раз в шесть месяцев в течение последующих двух лет, при безрецидивном течении заболевания − пожизненно один раз в год [14].
Компьютерная (электронная) модель витального прогноза, полученная на основании анализа выживаемости 31 пациента после энуклеации по поводу меланомы хориоидеи, позволяет прогнозировать сроки гибели пациента от метастатической болезни. Полученные временные параметры модели предполагают изменение тактики ведения пациентов после энуклеации по поводу начальной меланомы хориоидеи, распространяющейся на диск зрительного нерва (периоды наблюдения указаны в клинических рекомендациях «Увеальная меланома» 2020 г. [14]). К таким изменениям необходимо отнести сокращение периодичности осмотров и обследований пациентов с меланомой хориоидеи (ПЭТ-КТ три раза в год) с обязательной консультацией онколога с целью планирования системной таргетной и иммунотерапии.
Заключение
Разработана компьютерная (электронная) модель витального прогноза пациентов после энуклеации по поводу начальной меланомы хориоидеи папиллярной локализации, позволяющая прогнозировать гибель пациента от метастатической болезни, что предполагает изменение тактики ведения больного. Доказано, что наличие миелоидных клеток супрессорного происхождения – промиелоцитов (p = 0,02) в ткани опухоли служит фактором, повышающим риск смерти пациента от метастатической болезни, и рассматривается как повод для обозначения потенциальных мишеней таргетной иммунотерапии первичной меланомы хориоидеи.
После энуклеации по поводу начальной меланомы хориоидеи папиллярной локализации рекомендуется использовать компьютерную (электронную) модель витального прогноза, основанную на анализе состава опухолевого клеточного микроокружения, для планирования тактики ведения пациентов в послеоперационном периоде.
Авторы заявляют об отсутствии конфликта интересов.
S.V. Saakyan, PhD, Prof., Corr.-Mem. RAS, Ye.B. Myakoshina, PhD, D.D. Garry, G.Yu. Tarasov, I.Yu. Myakoshin
A.I. Yevdokimov Moscow State University of Medicine and Dentistry
Moscow Helmholtz Research Сentre of Eye Diseases
Artificial Networks and Technologies LLC
Contact person: Yelena B. Myakoshina, myakoshina@mail.ru
Purpose – create a computer (electronic) model of vital prognosis in patients with small choroidal melanoma.
Material and methods. To create a computer (electronic) model of the vital prognosis of patients after enucleation for small choroidal melanoma papillary localization, computer preprocessing of data from 31 patients aged 59.67 ± 14.2 years on average was used. Pathological parameters and criteria of the tumor cell microenvironment were used. Statistical models were built.
Results. The confidence interval of statistically significant factors is separated from zero, which allows us to unequivocally conclude that the presence of myeloid cells of suppressor origin (promyelocytes) in the tumor tissue is a factor that increases the risk of death of a patient from metastatic disease in choroidal melanoma. The presence of plasma cells, on the contrary, turned out to be a factor that reduces the risk of death of the patient.
The risk function formula is determined. Hi(t) = h0(t) × exp
(-0,3150083536330702 × х1
+0,3279865936177689 × х2
+0,013793792320692503 × х3
-0,5917623519392681 × х4
+0,0700743147993131 × х5
-3,296382837585438 × х6
+3,624943885623139 × х7
+0,6773504841265628 × х8).
The formula for the dependence of the risk function on time is represented as: h(t) = ho(t) exp (b1x1 + b2x2 + ... + bpxp), Xj are explanatory variables and bj are fitting coefficients.
Based on the obtained formula, a program was created that includes the parameters of the tumor cell microenvironment of choroidal melanoma, depending on which it is possible to predict the survival of each patient.
Conclusion. A computer (electronic) model of vital prognosis, obtained on the basis of an analysis of the survival of patients after enucleation for choroidal melanoma, makes it possible to predict the timing of a patient's death from metastatic disease. The obtained time parameters of the model suggest a change in the tactics of managing patients after enucleation for small choroidal melanoma extending to the optic nerve. Such changes include a reduction in the frequency of examinations and examinations of patients with choroidal melanoma (PET-CT 3 times a year) with an oncologist's consultation in order to plan systemic targeted and immunotherapy.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.


