Коррекция анемии препаратами железа у пациентов с кардиоренальным анемическим синдромом
- Аннотация
- Статья
- Ссылки



В исследовании OPTIME при снижении уровня гемоглобина (Нb) ниже 12 г/дл увеличивался риск смерти и повторной госпитализации на 13% (1). Ретроспективный анализ исследования SOLVD, в котором принимали участие 6563 больных, показал увеличение смертности на 2,7% при снижении гематокрита на 1% (2). Во многих крупных рандомизированных исследованиях показано взаимное негативное влияние ХБП, анемии и ХСН (3-7), что позволило объединить это сочетание термином кардиоренальный анемический синдром (КРАС). Под этим термином авторы подразумевают различные патологические состояния, в зависимости от этого варьирует частота КРАС. Так, при обследовании пациентов с различными функциональными классами ХСН Шутов А.М. и соавт. (2006) выявили КРАС в 18,8% случаев.
Считается, что нарушение функции почек обусловлено, главным образом, снижением сердечного выброса и хронической гипоперфузией почек. Доказано, что снижение скорости клубочковой фильтрации (СКФ) у пациентов ХСН является независимым предиктором общей и сердечно-сосудистой смертности, даже более сильным, чем ФК ХСН и ФВ ЛЖ (8, 9). Согласно данным, представленным Philipp S. еt al., среди 2941 пациента с ХСН уровень Нb менее 110 г/л (8,1%) ассоциировался со CКФ менее 25 мл/мин и более высоким функциональным классом ХСН (10). Как показало исследование RENAAL, у пациентов с диабетической нефропатией и неблагоприятными клиническими исходами (ранняя терминальная ХПН, смерть) исходная концентрация гемоглобина была ниже (11). По данным последних исследований коррекция анемии способствует замедлению прогрессирования почечной дисфункции.
В качестве причин анемии при ХСН обсуждаются главным образом снижение продукции эритропоэтина (ЭПО) или относительная эритропоэтинорезистентность, а также дефицит железа, гемодилюция, недостаточное питание, воспаление с высоким уровнем цитокинов, нарушение функции костного мозга, лечение ингибиторами ангиотензин-превращающего фермента (иАПФ) и ацетилсалициловой кислотой (12, 13).
Анемия рассматривается как фактор риска сердечно-сосудистых осложнений, а также способствует прогрессированию хронической болезни почек. Это обусловлено гипоксическим повреждением тубулоинтерстиция почек со снижением СКФ и секреции ЭПО. Кроме того, вследствие активации симпатоадреналовой и ренин-ангиотензин-альдостероновой систем, анемия может усугублять внутригломерулярную гипертензию и протеинурию, задержку жидкости и увеличение венозного возврата на фоне повышенной ретенции натрия (14).
Согласно Европейским рекомендациям по лечению анемии при нефропатиях, всем пациентам с уровнем Hb менее 110 г/л, при исключении других причин анемии, показана терапия препаратами железа в сочетании с препаратами ЭПО, что позволяет снизить дозу последних и, соответственно, затраты на лечение (15).
Так, Шило и соавт. (2005) показали, что применение Венофера (железо-гидроксид сахарозный комплекс) позволяет достичь целевых значений уровня гемоглобина, обеспечивает поддержание показателей обмена железа на оптимальном уровне и приводит к уменьшению необходимой дозы дорогостоящих препаратов ЭПО у пациентов с ХБП примерно на 30% (16).
В настоящее время нет четких рекомендаций (европейских, американских, российских) по лечению анемии при ХСН. Многочисленные исследования последних лет показали, что коррекция даже умеренной анемии с помощью препаратов ЭПО и железа у пациентов с ХСН может привести к улучшению качества жизни, переносимости физических нагрузок и сократительной способности сердца. Однако вопрос о возможности коррекции анемии у пациентов ХСН препаратами ЭПО остается открытым в связи с имеющимися данными об увеличении сердечно-сосудистого риска на фоне терапии этими препаратами. В исследовании CHOIR и TREATE достижение целевого уровня гемоглобина при лечении ЭПО у пациентов с ХБП сопровождалось повышением риска смерти, частоты развития острого инфаркта миокарда, инсульта и повторных госпитализаций в связи декомпенсацией ХСН (17, 18). Возможно, это связано с влиянием препаратов ЭПО на процессы тромбообразования. Проводимое в настоящее время исследование Red-HF должно окончательно ответить на вопрос о возможности применения ЭПО у больных ХСН.
В то же время применение препаратов железа для коррекции анемии при ХСН представляется нам оправданным, учитывая высокую распространенность железодефицитных состояний в этой популяции, положительное влияние на качество жизни и переносимость физических нагрузок, а также отсутствие данных об увеличении смертности и частоты сердечно-сосудистых осложнений как по нашим данным, так и по данным литературы.
Материалы и методы
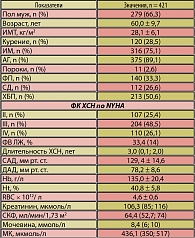
Обследован 421 пациент с ХСН с систолической дисфункцией II-IV ФК, средний возраст которых составил 60,0 ± 9,7 года, в стадии компенсации. Женщин было 142 (43,7%), мужчин – 279 (66,3%). Средняя длительность течения ХСН составила 3,0 (0,1; 2,0) года. Наиболее частыми причинами ХСН были перенесенный инфаркт (75,1%) и артериальная гипертония (АГ) (89,1%) (таблица 1).
У половины больных имелась ХБП (50,6%). Более 26% страдали СД 2 типа, нарушение ритма сердца по типу фибрилляции предсердий имели 33,3% пациентов. Чаще всего встречался III ФК ХСН (48,5%), реже II ФК – 25,4% и IV ФК – 26,1% больных. Все пациенты получали стандартную терапию ХСН: ИАПФ 370 (87,9%)/АРА II 18 (4,3%) пациентов соответственно, b-блокаторы – 363 (86,2%)/a-, b-блокаторы – 58 (13,8%), тиазидовые диуретики – 212 (50,4%), антагонисты альдостерона – 226 (53,7%).
Из основной группы был выделен 31 пациент с кардиоренальным анемическим синдромом, которым проводилась терапия Венофером (сахарат железа) в сравнении с плацебо в течение 24 недель (фаза коррекции и фаза стабилизации).
Критерии включения в группу: ФВ ЛЖ < 40%, стандартная терапия ХСН в течение 3 предшествующих месяцев, наличие железодефицита (уровень ферритина ниже 100 мкг/л или ниже 300 мкг/л, когда уровень насыщенности трансферрина железом ниже 20%), уровень гемоглобина < 135 г/л, креатинина £ 300 мкмоль/л. Исключались из исследования пациенты с врожденными пороками сердца, онкопатологией, постгеморрагической анемией, хроническими заболеваниями печени, гемохроматозами, находящиеся на гемодиализе, получающие препараты ЭПО и железа в течение 3 месяцев до рандомизации. До начала терапии препаратами железа и после лечения выполнялся 6-минутный тест с ходьбой, заполнялись опросники качества жизни.
Результаты обработаны статистически с использованием критерия t Стьюдента, проводился однофакторный корреляционный анализ. Использовали компьютерную программу Statistica for Windows 6,0. Показатели представлены как М ± SЕ. Различия достоверны при р < 0,05.
Результаты и обсуждения
Анемия выявлена у 122 (28,5%) пациентов, что согласуется с литературными данными. У 20,7% (87) пациентов с сердечной недостаточностью диагностирован КРАС.
У 63 пациентов был изучен обмен железа. Железодефицитная анемия диагностирована у 29 пациентов (46,1%), среди них смешанный дефицит железа и витамина В12 имели 2 (3,2%) пациента, 5 (6,3%) дефицит железа и фолиевой кислоты. Изолированная фолиеводефицитная анемия диагностирована у 6 (9,5%) больных, В12-дефицитная анемия у 5 (7,9%) больных. У 23 (36,5%) больных в отсутствии дефицитных состояний диагностирована АХЗ.
Средний уровень СКФ по формуле МDRD в группе больных с ХСН составил 64,4 (52,7; 74) мл/мин/1,73 м2. Кардиоренальный синдром (сочетание ХСН с ХБП) наблюдался у 50,6% больных, при этом его частота существенно различалась в группах пациентов с анемией и нормальным Нb (72,1% и 44,1% соответственно), что говорит о вкладе ХБП в развитие анемии у больных с ХСН. В группе анемии был достоверно выше уровень протеинурии 0,3 (0,0; 0,2) г/л против 0,07 (0,0; 0,0) г/л.
Все больные с анемией, были разделены на 2 группы по уровню СКФ: I – СКФ < 60 мл/мин/1,73 м2, II – СКФ > 60 мл/мин/1,73 м2. В группе пациентов со СКФ ниже 60 мл/мин/1,73 м2 преобладали больные более старшего возраста с АГ и СД (таблица 2).
В группе с СКФ < 60 мл/мин/1,73 м2 значения Hb (р < 0,001), гематокрита (р < 0,001) и эритроцитов (р < 0,001) были достоверно ниже.
Средние значения мочевины и мочевой кислоты были достоверно выше у больных с более выраженным снижением СКФ (р < 0,001). Анализ не выявил различий по уровню электролитов, холестерина крови.
При анализе показателей воспалительного профиля в группе СКФ < 60 мл/мин/1,73 м2 отмечались более высокие показатели С-РБ (р = 0,01).
При сравнении групп больных с кардиоренальным синдромом (КРС), выделенных в зависимости от наличия анемии, также было отмечено повышение С-РБ в 2 раза в группе пациентов с анемией. Полученные данные могут свидетельствовать о важной роли воспаления в развитии КРС, однако роль маркеров хронического системного воспаления как факторов риска развития анемии при этом синдроме требует дальнейшего изучения (таблица 3).
У 20 пациентов, получавших препарат железа Венофер в/в в течение 24 недель, достоверно увеличились значения Нb на 14% (р < 0,001), гематокрита на 4% (р < 0,001), эритроцитов на 7% (р < 0,001), сывороточного железа на 69% (р < 0,001), сатурации железа (р = 0,002), ферритина (р < 0,001), снизился уровень трансферрина (р < 0,001). На фоне терапии в/в препаратами железа достоверно увеличилась дистанция по результатам 6МТХ в сравнении с результатами теста, проведенного до начала терапии (279,1 (238; 340) м и 211,9 (180; 266) м соответственно), снизился ФК ХСН по NYHA и уровень С-РБ с 11,4 (3,4; 18) мг/дл до 5,8 (2,9; 8,6) мг/дл, улучшилось качество жизни (таблица 4).
При этом в группе пролеченных больных за время наблюдения не было отмечено нежелательных явлений, связанных с введением препарата, повторных госпитализаций, декомпенсации ХСН и тромбоэмболических осложнений.
Выводы
- В обследованной группе больных с ХСН и систолической дисфункцией (II-IV ФК по NYHA) было характерно сочетание кардиальной патологии с дисфункцией почек (50,6%) и с абсолютным железодефицитом (46,1%), а анемия была обусловлена чаще всего недостатком железа.
- Выявлен существенно более высокий уровень С-РБ в группе пациентов с анемией и кардиоренальным синдромом, что позволяет рассматривать воспаление в качестве фактора, способствующего развитию анемии у данной категории больных.
- Установлена прямая достоверная связь анемии с повышенным уровнем креатинина, протеинурии и снижением СКФ у пациентов с ХСН. Наличие анемии ассоциировано с низким уровнем холестерина у этих больных.
- На фоне терапии препаратом железа (Венофер) у пациентов с КРАС серьезных нежелательных явлений не выявлено. Отмечено увеличение толерантности к физической нагрузке, улучшение качества жизни, нормализация уровня гемоглобина, снижение С-РБ.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.