Лечение анемии при злокачественных опухолях. Эффективность Эпрекса
- Аннотация
- Статья
- Ссылки




Анемия как проявление опухолевого процесса – так называемая «раковая анемия» или связанная с лечением рака - важная клиническая проблема, получившая в последние годы новые возможности лечения.
Главными причинами анемии опухолевого процесса являются кровотечение, гемолиз, гиперспленизм, дефицит кофакторов гемопоэза (железо, эндогенный эритропоэтин, витамин В12, фолиевая кислота и др.), поражение костного мозга опухолевым процессом и собственно противоопухолевое лечение. При злокачественном процессе, также как и при ревматоидном артрите, СПИДе и ряде хронических инфекционных заболеваний, отмечается анемия хронического заболевания (АХЗ) (1).
Основным звеном в патогенезе АХЗ в настоящее время считают нарушение обмена железа в организме: клетки ретикуло-эндотелиальной системы активно захватывают и не возвращают железо в кровь. Это ведет к перераспределению железа из циркулирующей крови в ретикуло-эндотелиальную систему, ограничению доступности железа для созревания клеток-предшественников эритроидного ряда и железодефицитному эритропоэзу(2). Конечным результатом снижения уровня гемоглобина является уменьшение кислородной емкости крови и, соответственно, тканевая гипоксия.
Существует несколько механизмов, работа которых компенсирует недостаток кислородной емкости крови. Например, выработка в эритроцитах дополнительного количества 2,3-дифосфоглицерата приводит к уменьшению сродства кислорода к гемоглобину и ведет к увеличению диссоциации кислорода из эритроцитов в тканях (3,4). Этот механизм может компенсировать до половины дефицита кислорода при анемии (5). Следующий рубеж защиты организма – увеличение сердечного выброса, частоты дыхания, стимуляция выработки эндогенного эритропоэтина (6,7).
Эритропоэтин (ЭПО) – гликопротеин, гормон, играющий главную роль в регуляции выработки эритроцитов (8). В свою очередь гипоксия является главным стимулом для продукции эндогенного эритропоэтина (9).
Неадекватная гипоксии выработка эндогенного ЭПО может привести к развитию анемии. Необходимыми условиями полноценного эритропоэза являются также витамин В12, фолиевая кислота и железо.
До последнего времени в современной литературе, посвященной проблеме раковой анемии, не было однозначных указаний о том, при каких показателях Hb крови следует начинать лечение или профилактические мероприятия, какому методу лечения отдать предпочтение. Однако уже сегодня появились клинические руководства по лечению как пост-цитостатической, так и собственно раковой анемии (10).
Условно в лечении анемии можно выделить 2 подхода: патогенетический и симптоматический. К патогенетическому варианту можно отнести устранение причин анемии, в том числе эффективное противоопухолевое лечение, коррекцию дефицита кофакторов гемопоэза (железа, фолиевой кислоты) и алиментарных нарушений. Отдельно следует рассматривать необходимость устранения абсолютного или относительного дефицита эндогенного эритропоэтина – прямого стимулятора эритропоэза, вырабатываемого в основном, в почках. Примером симптоматического лечения является трансфузия эритроцитарной массы, восполняющая количественный дефицит эритроцитов.
Метод переливания крови и ее компонентов в истории медицины последнего столетия занимает одно из главных мест. Трансфузия эритроцитарной массы – признанный вариант лечения хронической анемии (11). Средний уровень гемоглобина крови в странах Европы, при котором назначается переливание эритроцитной массы, составляет 82 г/л. Принимая во внимание новые данные о значении анемии для качества жизни, эта точка отсчета неадекватна в большинстве случаев. Но, даже если показанием к гемотрансфузии будет Hb < 90 г/л, большую часть времени пациенты будут жить с субоптимальным уровнем гемоглобина. Главное преимущество трансфузии эритроцитной массы – быстрое и дозируемое увеличение концентрации гемоглобина крови следует использовать в случаях острой симптомной анемии.
Но в реальной клинической ситуации (особенно в случаях субоптимальной анемии) маловероятно, что онколог предложит пациенту и организует переливание эритроцитарной массы. Как правило, лечебные мероприятия ограничиваются перерывом в проведении противоопухолевого лечения с последующей редукцией доз цитостатиков, назначением препаратов железа, поливитаминов. Трансфузия в итоге проводится крайне редко, поскольку у практических врачей нет принятого руководства (так называемого стандарта) по лечению «раковой» анемии, и процедура возможна только по инициативе врача стационара. Для переливания крови необходима госпитализация в стационар, высока вероятность несвоевременного проведения процедуры из-за отсутствия эритромассы нужной группы крови и достаточного ее количества. Одна перелитая стандартная доза эритромассы позволяет увеличить концентрацию Hb на 10 г/л, и конечно для достижения и поддержания уровня Hb в пределах физиологической нормы понадобятся неоднократные гемотрансфузии. При этом пропорционально возрастает вероятность таких осложнений, как иммуносупрессия, аллергические реакции, перегрузка железом печени и миокарда, инфицирование пациента.
ЭПРЕКС – первый рекомбинантный человеческий эритропоэтин-альфа (ЭПО, эпоэтин-альфа, Procrit) зарегистрирован в 1993 году для лечения анемии при онкологических заболеваниях. Препарат аналогично эндогенному эритропоэтину стимулирует дифференцировку клеток-предшественников эритроидного ряда, воздействуя на митоз (8). Позднее появились препараты рекомбинантного эритропоэтина-бета (Рекормон), дарбепоэтин (Аранесп). Применение ЭПО позволяет в большинстве случаев компенсировать абсолютный или относительный дефицит эндогенного эритропоэтина, что в конечном итоге приводит к увеличению концентрации Hb крови.
ЭПО следует назначать при анемии 1, 2, 3-й степени, при быстром (1г/дл за 1 месяц) снижении уровня Hb на фоне лечения, при наличии противопоказаний к гемотрансфузии. Стандартный дозовый режим как при коррекции постцитостатической, так и раковой анемии, предполагает подкожное введение препарата по 10000 MЕ x 3 раза в неделю. Длительность применения ЭПО ограничивается, как правило, его эффективностью. В случае эффекта – повышение гемоглобина на 10 г/л за 4 недели лечения в дозе 10000 МЕ х 3 раза в неделю терапия продолжается до достижения границы физиологической нормы Hb (>110 г/л). Лечение может быть продолжено с редукцией дозы на 30% (ЭПО по 10000 МЕ х 2 раза в неделю) до достижения уровня Hb = 120 – 130 г/дл. В последующем препарат можно использовать повторно при рецидиве анемии. Эффективность ЭПО не зависит от концентрации в крови эндогенного эритропоэтина, уровня сывороточного железа и объективного статуса пациента. В таблице 1 предложена схема лечения анемии опухолевого процесса.
Феномен функционального дефицита железа (несоответствие количества доступного для синтеза гема железа потребностям ускоренного эритропоэза) может быть одним из причин недостаточной эффективности ЭПО. Помимо снижения трансферрина плазмы < 100 нг/мл, косвенным признаком дефицита железа является снижение насыщения трансферрина плазмы менее 20%. В этой ситуации одновременно с ЭПО рекомендуется прием пероральных препаратов железа в дневной дозе элементарного железа 200 мг (12). Однако, в рандомизированном исследовании Auerbach, при оценке эффективности ЭПО в стандартном режиме 10000 МЕ х 3 раза в неделю показано статистически достоверное улучшение результатов лечения ЭПО при одновременном применении препаратов парентерального железа по сравнению с использованием перорального железа или без применения железа (13). При парентеральном приеме железа эффект ЭПО был таким же как и в группе пациентов, не получавших железо. Учитывая вероятность нарушения процесса абсорбции железа в 12-перстной кишке, описанного при анемии опухолевого процесса, более обосновано использование парентеральной формы железа, например препарата ВЕНОФЕР.
Лечение ЭПО в стандартных дозах малоэффективно приблизительно у 30% пациентов (прирост Hb < 10 г/л за 4 недели), но при уточнении противопоказаний к применению рекомбинантного эритропоэтина это число может быть меньше. Относительными противопоказаниями являются: неконтролируемая артериальная гипертензия, кровотечение, тяжелые коагулопатии, гемоглобинопатии, активная инфекция, нарушение белково-синтетической функции печени, значительное снижение резервов костномозгового кроветворения после многократных курсов химиотерапии и лучевого лечения, неэффективность предшествующего применения ЭПО, неблагоприятный прогноз жизни (< 8 недель), кахексия.
Увеличение / нормализация уровня Hb крови – основные, объективные критерии эффективности ЭПО. Серия клинических исследований выявила непосредственную связь между концентрацией Hb и параметрами качества жизни. Следует отметить, что наибольшая выгода в качестве жизни отмечена при повышении уровня гемоглобина с субоптимального уровня (100 г/л) до нижней границы нормы (120 г/л по классификации EORTC). Дальнейшее повышение концентрации гемоглобина сопровождается незначительным улучшением показателей качества жизни (14, 15).
Анемия, развившаяся на фоне противоопухолевого лечения, как правило, углубляется от курса к курсу. Чем больше разрыв с физиологической нормой Hb, тем больше сил и, главное, времени потребуется организму пациента и лечащему врачу для его восстановления. То есть, выявление анемии есть показание к началу ее лечения. В исследовании Littlewood и соавторов было показано, что раннее назначение ЭПО по сравнению с отложенным началом терапии позволяет добиться быстрого прироста Hb (138 vs 128 г/л) и минимизировать потребности в гемотрансфузиях (7% vs 28%).
Профилактическое использование препаратов рекомбинантного эритропоэтина в онкологии проходит стадию клинических исследований. Современные руководства по лечению анемии воздерживаются от рекомендаций по превентивному введению ЭПО.
Эффективность ЭПРЕКСА в лечении постцитостатической анемии (собственный опыт)
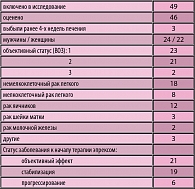
В отделении химиотерапии РОНЦ РАМН с 1999 году проводится исследование эффективности эпрекса в лечении платино-индуцированной анемии (16). Основываясь на клинических рекомендациях по применению ЭПО, мы с 1999 года провели изучение эффективности и безопасности применения ЭПРЕКСА (ЭПО) у 49 пациентов при лечении постцитостатической анемии, развившейся на фоне химиотерапии, включавшей препараты платины (цисплатин, карбоплатин).
Ниже приведены критерии включения в исследование:
- больные, получающие химиотерапию по поводу диссеминированного злокачественного процесса;
- комбинированная химиотерапия, включающая цисплатин (не < 80 мг/м2/курс) или карбоплатин (AUC=5-6);
- уровень Нb менее 95 г/л (анемия 2-3-4-й степени по классификации ВОЗ);
- коррекция возможного дефицита железа, фолиевой кислоты, В12 (поливитамины) до начала терапии ЭПРЕКСОМ.
Следует подчеркнуть, что одновременно с применением гемостимулирующей терапии по клиническим показаниям всем пациентам проводилась химиотерапия: препараты платины сочетались с этопозидом, навельбином, таксанами, нидраном, циклофосфаном, иринотеканом, топотеканом, гемзаром.
Эпрекс применяли в дозе 10000 МЕ п/кожно 3 раза в неделю в течение восьми недель при еженедельной оценке уровня Нb при одновременном использовании препаратов железа в дозе 150-200 мг/сут.
Лечение ЭПРЕКСОМ считалось эффективным при повышении уровня Нb на 20 г/л (по сравнению с исходным) через 4 и 8 недель лечения. При повышении уровня Нb менее чем на 10 г/л за 4 недели введения препарата лечение считалось неэффективным, применение ЭПО прекращали, при необходимости проводилась трансфузия эритроцитной массы. В таблице 7 представлена характеристика больных, включенных в анализ.
До момента включения в исследования пациенты в среднем получили 4 (1 – 8) курса химиотерапии. К этому моменту средний уровень Hb в анализируемой группе больных составил 87 г/л (56 – 95) г/л. У трех пациентов была анемия IV степени (< 65 г/л). Средний уровень Hb до начала химиотерапии был 112 г/л (91 – 149 г/л). Среди включенных в анализ, ранее получали лечение по поводу анемии 14 больных, из них переливание эритромассы – 6, препараты железа – 12, эритропоэтин – 2 пациента.
К промежуточной оценке эффективности после четырех недель применения ЭПРЕКСА 3 пациента выбыли досрочно. Целевой прирост уровня Hb > 10 г/л был отмечен в большинстве случаев: у 39 из 46 пациентов. Почти у половины пациентов (21 больной) отмечен прирост Hb > 20 г/л.
Дальнейшее применение ЭПРЕКСА у 39 пациентов через 8 недель было эффективным (прирост Hb > 20 г/л) в 71,4% случаев (25 больных). Для всей группы за 8 недель лечения средний прирост уровня Hb составил 22 г/л (95% ДИ: -19 – +62 г/л). Результаты применения ЭПО приведены в таблице 3.
Следует отметить, что в группе эффективной коррекции анемии спустя 4 недели после окончания введений ЭПРЕКСА средний уровень Hb составил 113 г/л (95% ДИ: 99 – 140г/л). Динамика изменений концентрации гемоглобина представлена в диаграмме 1.
Среди пациентов, не достигших целевого прироста (< 10 г/л) к промежуточной оценке (4 недели) преобладали пациенты со значительным объемом проведенной ранее химиотерапии. Анализ всех случаев неэффективности ЭПРЕКСА показал, что в эту группу попали, в основном, пациенты с распространенным, прогрессирующим опухолевым процессом. В тоже время у 2 пациентов с исходным прогрессированием болезни при применении эпрекса был зарегистрирован значимый прирост уровня Hb ( >20 г/л) на непродолжительное время.
Переносимость ЭПРЕКСА хорошая, из побочных эффектов, возможно связанных с применением препарата отмечены артериальная гипертензия – 2, боли в костях – 2, тромбофлебит – 1.
Препарат эффективен, удобен в использовании, побочные эффекты отмечаются редко и, как правило, не имеют клинического значения, что позволяет использовать его амбулаторно, у больных с сопутствующими заболеваниями, на фоне противоопухолевого лечения. Общая эффективность лечения постцитостатической (с препаратами платины) анемии ЭПРЕКСОМ по 10000 МЕ х 3 раза в неделю в течение 8 недель составила 71,8%. Средний прирост Hb за период лечения составил 22 г/л (-19 до 62 г/л). Через 4 недели после окончания применения ЭПРЕКСА в группе эффективного лечения средний уровень Hb существенно не изменился (Hb = 113 г/л).
Заключение
Большинство врачей привыкло считать неизбежным развитие легкой или умеренной анемии онкологических больных. Считается, что снижение уровня гемоглобина до 100 г/л, и даже до 80 г/л не приносит значимого вреда пациенту. Насколько ошибочна подобная точка зрения, показали исследования качества жизни в связи с анемией, при этом своевременная и адекватная коррекция анемии значимо улучшало благополучие пациентов. Показано достоверное влияние коррекции анемии на эффективность лучевого лечения, в том числе и в сочетании с химиотерапией (17, 18).
Опубликованы результаты рандомизированного плацебо-контролируемого исследования эффективности лечения анемии 375 больных получавших химиотерапию. Помимо снижения потребности в гемотрансфузиях выявлена значимая тенденция к увеличению выживаемости в группе, получавшей эпоэтин-альфа: медиана выживаемости к 1 году наблюдения составила 17 месяцев, в сравнении с 13 месяцев в группе плацебо. Группа итальянских исследователей проанализировала результаты лечения 394 пациентов, получавших химиотерапию с 5-фторурацилом по поводу метастатического колоректального рака. Оказалось, что анемия является значимым фактором прогноза эффективности проводимого лекарственного лечения (19). При сопутствующей анемии объективный эффект химиотерапии отмечен в 26,5% случаев, а в группе больных с нормальным уровнем Hb – 40,6%. Многофакторный анализ подтвердил, что уровень гемоглобина – независимый фактор прогноза продолжительности времени до прогрессирования и выживаемости больных c диссеминированным раком толстой кишки.
Результаты проспективных и ретроспективных исследований, проведенных за последнее десятилетие, убедительно свидетельствуют, что проблема анемии, ее влияние на больного явно недооценены. Внедрение в клиническую практику ряда новых цитостатиков, активное использование агрессивных режимов лечения, включая одновременную химио- и лучевую терапию (например, при локализованном мелкоклеточном раке легкого), использование высоких доз интерферонов и интерлейкинов позволяет улучшить эффективность лечения злокачественного заболевания. Но интенсификация лечения ухудшает качество жизни пациентов, требует активной поддерживающей терапии. При этом, улучшение функционального статуса больного, в том числе и своевременной коррекции анемии, может рассматриваться как резерв повышения эффективности противоопухолевого лечения.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.