Лечение функциональных заболеваний желудочно-кишечного тракта: современный взгляд на проблему. XXIV Российская гастроэнтерологическая неделя. Сателлитный симпозиум компании «Валента Фарм»
- Аннотация
- Статья
- Ссылки







Функциональная диспепсия как социальная проблема. Поиск оптимальной тактики терапии
Как отметил профессор кафедры пропедевтики, руководитель лаборатории исследований двигательной функции желудочно-кишечного тракта Клиники внутренних болезней, гастроэнтерологии и гепатологии им. В.Х. Василенко Первого Московского государственного медицинского университета (МГМУ) им. И.М. Сеченова, д.м.н. Александр Сергеевич ТРУХМАНОВ, диспепсия – самое частое проявление гастроэнтерологических заболеваний. Распространенность симптомов диспепсии среди населения разных стран в среднем составляет около 25%1–3.
Особое внимание сегодня эксперты уделяют такому функциональному заболеванию желудочно-кишечного тракта (ЖКТ), как функциональная диспепсия (ФД). И это не случайно: результаты 23-летнего шведского проспективного исследования (1988–2011 гг.) продемонстрировали рост распространенности ФД (за счет роста распространенности как постпрандиального дистресс-синдрома, так и синдрома боли в эпигастрии)4.
Еще совсем недавно серьезным считалось заболевание, которое было связано со стойкой нетрудоспособностью. На современном этапе в практику оценки влияния заболеваний на экономику включены такие понятия, как «абсентизм» и «презентизм». Абсентизм (от absence – отсутствие) подразумевает отсутствие человека на работе по причине какого-либо заболевания. Под презентизмом (присутствие) понимается существенное снижение производительности труда работающего человека на фоне какого-либо страдания.
Исходя из сказанного, ФД можно рассматривать как социально значимое заболевание. На приеме врача общей практики от 20 до 40% гастроэнтерологических жалоб составляют симптомы диспепсии, 25% пациентов с ФД обращаются к врачу более четырех раз в год.
Пациенты с ФД в 2,6 раза чаще оформляют листок нетрудоспособности и на три-четыре недели дольше пребывают на больничном листе по сравнению со средними показателями среди работоспособного населения. Например, ежегодные расходы на диагностику и лечение ФД в Великобритании составляют 1 млрд фунтов стерлингов, в США – 18 млрд долларов.
В соответствии с Римскими критериями IV, диагноз ФД устанавливают в отсутствие органического заболевания и при наличии одного или нескольких из следующих симптомов: тяжесть в эпигастрии после еды, быстрое насыщение, боль и чувство жжения в эпигастрии в течение последних трех месяцев при общей продолжительности симптомов диспепсии не менее шести месяцев.
В зависимости от преобладания в клинической картине тех или иных симптомов выделяют следующие клинические варианты ФД: синдром боли в эпигастрии (боль или жжение в эпигастрии, возникающие как минимум один раз в неделю), постпрандиальный дистресс-синдром (чувство переполнения желудка или раннее насыщение после еды при приеме пищи в обычном объеме, возникающие как минимум три раза в неделю) и смешанный вариант.
Патогенетические механизмы ФД разнообразны и могут включать психосоциальные факторы, нарушение аккомодации желудка, замедление эвакуации из желудка, измененную миоэлектрическую активность, нарушение моторики тонкой кишки. Нарушение аккомодации (адаптивного расслабления в ответ на поступление пищи в желудок) наблюдается у 41% пациентов с ФД5. Определенную лепту вносит висцеральная гиперчувствительность, которую можно определить с помощью желудочного баростат-теста. Однако данный метод используется только в научно-исследовательских центрах и практически недоступен в условиях рутинной практики.
Вопрос о взаимосвязи ФД и инфекции Helicobacter pylori и необходимости эрадикации последней у пациентов с ФД остается дискутабельным. В Киотском консенсусе 2015 г. в качестве отдельной нозологической формы выделена диспепсия, ассоциированная с инфекцией H. pylori. Однако следует избегать гипердиагностики инфекции H. pylori как причины ФД.
Основными патофизиологическими механизмами, лежащими в основе развития ФД, считаются расстройства гастродуоденальной моторики, воспалительные изменения в слизистой оболочке желудка и двенадцатиперстной кишки, висцеральная гиперчувствительность. Поэтому особый интерес представляют препараты с многофакторным механизмом действия, регулирующие гастродуоденальную моторику и уменьшающие висцеральную гиперчувствительность. К таким препаратам относится тримебутин.
Тримебутин (Тримедат®), действуя на периферические мю-, каппа- и дельта-опиатные рецепторы, в том числе находящиеся непосредственно на гладкой мускулатуре на всем протяжении ЖКТ, регулирует моторику без влияния на центральную нервную систему. Таким образом, тримебутин восстанавливает нормальную физиологическую активность мускулатуры кишечника при различных заболеваниях ЖКТ, связанных с нарушениями моторики. Нормализуя висцеральную чувствительность, тримебутин обеспечивает анальгетический эффект при абдоминальном болевом синдроме.
Тримебутин, синтезированный в 1969 г., успешно применяется у пациентов с ФД. Так, метаанализ 25 рандомизированных контролируемых исследований (РКИ) с участием 4473 пациентов с ФД продемонстрировал терапевтическую эффективность тримебутина, сопоcтавимую с эффективностью метоклопрамида и более выраженную по сравнению с эффективностью мозаприда, домперидона, итоприда6.
В другом исследовании было показано, что добавление тримебутина к стандартной терапии ингибиторами протонной помпы (ИПП) пациентам с гастроэзофагеальной рефлюксной болезнью (ГЭРБ) в сочетании с синдромом раздраженного кишечника повышает эффективность лечения ГЭРБ7.
Исследование TREND: эффективность тримебутина в лечении пациентов с функциональной диспепсией
Ассистент кафедры пропедевтики внутренних болезней Первого МГМУ им. И.М. Сеченова, к.м.н. Светлана Станиславовна КАРДАШЕВА представила участникам симпозиума результаты неинтервенционной наблюдательной программы TREND (Trimedat® for the treatment of Functional Dyspepsia), посвященной оценке эффективности тримебутина (Тримедат®) у пациентов с ФД.
Протокол исследования был одобрен локальным комитетом по этике при Первом МГМУ им. И.М. Сеченова (протокол № 11–16 от 14.12.2016). Исследование проводилось на базе Клиники пропедевтики внутренних болезней, гастроэнтерологии и гепатологии им. В.Х. Василенко Первого МГМУ им. И.М. Сеченова.
После скрининга, в котором участвовали свыше 500 пациентов с гастроэнтерологическими жалобами, в исследование были включены 100 пациентов в возрасте от 18 до 65 лет (27 мужчин, 73 женщины, средний возраст 31,95 ± 10,9 года) с установленным в соответствии с Римскими критериями IV диагнозом ФД, не принимавшие спазмолитиков и прокинетиков как минимум в течение семи дней до включения в исследование. На этапе скрининга для исключения органических заболеваний пациентам проводились эндоскопическое исследование верхних отделов ЖКТ, ультразвуковое исследование (УЗИ) брюшной полости и стандартное лабораторное исследование.
Дизайн исследования предусматривал заполнение опросника «7 × 7» (семь симптомов за семь дней) до начала исследования и на 7-й, 14-й, 28-й дни лечения. Опросник разработан Российской гастроэнтерологической ассоциацией (РГА) при поддержке компании «Валента Фарм» и рекомендован к применению в клинической практике для оценки выраженности и динамики симптомов ФД и синдрома раздраженного кишечника (СРК). Пациенты также заполняли опросник SF-36 до начала лечения и на 28-й день лечения.
Результаты показали, что в исследуемой группе синдром ФД в 36% случаев сочетался с другими заболеваниями ЖКТ: в 15% случаев – с ГЭРБ, в 21% – с СРК. Клинические варианты синдрома ФД распределялись следующим образом: у 45% пациентов отмечался синдром боли в эпигастрии, у 52% – смешанный вариант, у 3% – постпрандиальный дистресс-синдром.
Всем пациентам назначали Тримедат® (тримебутин) в стандартной дозе 200 мг три раза в сутки в течение 28 дней.
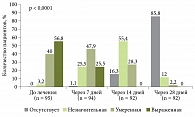
При сравнении симптомов на 7-й, 14-й и 28-й день лечения и до лечения отмечалось статистически значимое уменьшение частоты и интенсивности боли в эпигастральной области (р < 0,0001).
Уже через семь дней лечения у большинства пациентов уменьшились частота и интенсивность боли в эпигастральной области. Через 14 дней лечения ежедневная боль в эпигастрии регистрировалась лишь у 5% больных, а у 16% пациентов она полностью была купирована. Интенсивность боли в эпигастральной области в большинстве случаев стала незначительной (55%) или умеренной (28%).
Через 28 дней терапии препаратом Тримедат® боль в эпигастральной области отсутствовала у 86% пациентов, незначительная боль один-два раза в неделю сохранялась у 14% участников исследования (рис. 1).
На фоне лечения зафиксировано статистически значимое уменьшение частоты и степени выраженности жжения в эпигастральной области (р < 0,0001). Через 28 дней лечения у 85% пациентов жжение в эпигастрии отсутствовало.
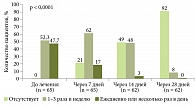
Тримедат® продемонстрировал эффективность и в отношении снижения чувства переполнения в эпигастральной области после еды и раннего насыщения, которое отмечалось уже на 7-й день лечения. Через 28 дней терапии чувство переполнения в эпигастральной области после еды исчезло у 92% пациентов, чувство раннего насыщения – у 91% (рис. 2).
Кроме основных симптомов ФД часть пациентов испытывала тошноту и отрыжку воздухом. Лечение способствовало быстрому уменьшению выраженности тошноты и отрыжки, а затем полному купированию указанных симптомов у всех пациентов.
Данные опросника SF-36 продемонстрировали статистически значимое улучшение показателей физического и психического компонентов здоровья у пациентов с ФД: к 28-му дню терапии средний балл физического здоровья увеличился с 48 до 53, психического – с 48 до 52 (р < 0,0001).
Таким образом, применение тримебутина (Тримедат®) у пациентов с ФД сопровождается уменьшением выраженности основных симптомов – боли и жжения в эпигастрии, чувства тяжести и переполнения в эпигастрии после еды, чувства быстрого насыщения. Уменьшение частоты возникновения и выраженности симптомов диспепсии сопровождается достоверным повышением показателей качества жизни, характеризующих состояние физического и психического здоровья.
СРК: особенности работы системы «мозг – кишечник» и комплексные подходы к терапии
По данным заведующего кафедрой терапии и клинической фармакологии Северо-Западного государственного медицинского университета им. И.И. Мечникова, д.м.н., профессора Владимира Ильича СИМАНЕНКОВА, в Санкт-Петербурге СРК страдают около 450 тыс. человек.
В настоящее время в качестве базовой концепции развития функциональных заболеваний (ФЗ) ЖКТ рассматривается биопсихосоциальная модель. В рамках этой модели формирования ФЗ ЖКТ центральное место занимает дисфункция оси «головной мозг – ЖКТ». Наличие изменений и симптомов со стороны ЖКТ облигатно связано с психосоциальными факторами и деятельностью центральной нервной системы (ЦНС).
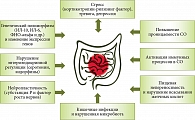
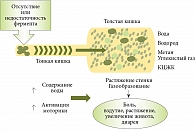
В качестве ключевых факторов патогенеза СРК рассматривают генетическую предрасположенность, психоэмоциональный стресс, кишечные инфекции, повышение проницаемости слизистой оболочки, активацию в ней иммунных процессов, пищевую непереносимость и нарушение всасывания желчных кислот, нарушение энтероэндокринной регуляции (рис. 3)8.
Особого внимания заслуживает висцеральная гиперчувствительность, которая считается базисным патофизиологическим механизмом ФЗ ЖКТ. Изменение чувствительности зачастую связано с изменением функционирования оси «мозг – кишечник».
Механизмы, лежащие в основе висцеральной гиперчувствительности, представлены не только периферической гиперсенситивностью, но и центральной сенситизацией, связанной с повреждением тканей и субклиническим воспалением.
Заслуживает внимания еще один факт: нервные волокна экспрессируют рецепторы для медиаторов иммунных клеток. Иммунные медиаторы связываются с рецепторами нервных клеток и приводят либо к усилению, либо подавлению функции кишечника9. Таким образом, стрессогенные факторы способны влиять на иммунную реактивность, а измененная иммунная реактивность – на восходящие сигналы ЦНС.
По оценкам, у 96% больных СРК доминирующим симптомом является боль. В основе болевого синдрома зачастую лежит гладкомышечный спазм. Однако хронический болевой синдром также сопровождается вторичным изменением стрессорного реагирования, субклиническим и нейрогенным воспалением, нейротрофическими изменениями тканей. В итоге формируется порочный круг.
В основе функционирования толстой кишки лежит очень сложный физиологический механизм, в котором одна из важнейших ролей принадлежит энкефалинергической опиоидной системе. Баланс между возбуждающими и тормозящими нейротрансмиттерами в случае заболевания нарушается. Энкефалинергическая система, воздействуя прямо и опосредованно через нейромедиаторы, такие как ацетилхолин, серотонин, норадреналин, допамин, оксид азота, оказывает многоуровневое и многостороннее влияние на деятельность кишечника.
Часто встречается и так называемый синдром перекреста – наличие у пациента одновременно нескольких функциональных заболеваний ЖКТ. ФД и СРК имеют общие патофизиологические механизмы развития. Ключевым из них и при СРК, и при ФД является висцеральная гиперчувствительность. Кроме того, для ФД и СРК характерна психиатрическая коморбидность.
Возвращаясь к вопросам функционирования энкефалинергической системы, Владимир Ильич напомнил, что энкефалическая система состоит из рецепторов, расположенных на поверхности клеток, и их эндогенных лигандов (эндорфины, энкефалины). В ЖКТ представлены в основном три подтипа опиатных рецепторов – мю, дельта и каппа.
Тримебутин (Тримедат®) – неспецифический агонист трех основных типов опиатных рецепторов (мю, дельта и каппа), расположенных в том числе на гладкомышечных клетках на всем протяжении ЖКТ. Тримебутин оказывает модулирующее влияние на тонус гладкомышечных клеток и перистальтическую активность ЖКТ в зависимости от их исходного состояния.
Важно, что тримебутин (Тримедат®) не проникает через гематоэнцефалический барьер, а следовательно, не вызывает привыкания.
Тримебутин воздействует на висцеральную чувствительность ЖКТ. В основе анальгетического действия тримебутина (препарат Тримедат®) лежит его влияние на антиноцицептивную систему организма с повышением порога болевой чувствительности, модификацией оценки боли.
Благодаря действию на различные типы опиатных рецепторов тримебутин восстанавливает нормальную физиологическую активность мускулатуры кишечника. Еще одно фармакологическое свойство препарата – ускорение эвакуации из желудка.
Перечисленные эффекты позволяют считать тримебутин одним из высококонкурентных препаратов при синдроме перекреста, поскольку он работает в разных отделах ЖКТ – от желудка до толстой кишки.
Кокрейновский обзор 56 РКИ подтвердил эффективность тримебутина в лечении СРК10.
Эффективность тримебутина в лечении СРК продемонстрирована также в метаанализе 26 РКИ11.
Авторы еще одной работы на основании анализа экспериментальных данных и результатов 12 РКИ пришли к выводу, что тримебутин действует на моторику ЖКТ и висцеральную чувствительность – ключевые мишени медикаментозной терапии СРК12.
Двойное слепое рандомизированное плацебоконтролируемое исследование показало, что применение препарата Тримедат® (200 мг три раза в день в течение месяца) эффективно устраняет запоры у пациентов с СРК.
Результаты недавно опубликованной работы продемонстрировали, что среди пациентов с СРК с преобладанием в клинической картине запора через 30 дней после окончания лечения ремиссия сохраняется у 80% пациентов, получавших тримебутин13.
Таким образом, тримебутин является гармонизатором моторики за счет:
- ингибирования высвобождения ацетилхолина из нейронов энтеральных сплетений и нейромодуляции активности ацетилхолина в отношении гладких мышц ЖКТ;
- высвобождения эффектов эндогенных антихолинергических стресс-лимитирующих систем ЖКТ;
- блокировки передачи болевых и неболевых стимулов в NMDA-синапсах нейронов задних спинномозговых ганглиев на вставочные нейроны, что уменьшает передачу патологических стимулов в ЦНС с последующим уменьшением эффекторного ответа;
- увеличения толерантности к болевым и механическим стимулам – нивелирования висцеральной гиперчувствительности14.
Применение препарата Тримедат® (тримебутин) при функциональных заболеваниях ЖКТ способствует контролю боли и спазмов, нормализации моторики15–21.
Функциональная билиарная патология как побочный элемент пищевой адаптации. Результаты исследования TRIBUNE
Функциональные расстройства билиарного тракта, которые диагностируются с частотой 10–20% в популяции, представляют собой комплекс клинических симптомов, развивающихся в результате моторно-тонической дисфункции желчного пузыря, желчных протоков и сфинктеров. Как отметила доцент кафедры пропедевтики внутренних болезней Первого МГМУ им. И.М. Сеченова, к.м.н. Юлия Олеговна ШУЛЬПЕКОВА, дискоординация между сокращениями желчного пузыря и тонусом сфинктеров билиарной системы лежит в основе формирования абдоминального болевого синдрома билиарного типа.
Согласно Римским критериям IV, для билиарной боли характерны следующие признаки: локализация в эпигастральной области/правом подреберье, длительность 30 минут и более, при этом боль быстро нарастает, достигая плато, рецидивирует с разными интервалами (не ежедневно), нарушает активность пациента, нередко требует обращения за неотложной помощью, не связана с моторикой кишечника, положением тела, приемом антацидов/антисекреторных препаратов.
Функциональные расстройства желчного пузыря характеризуются приступами типичной билиарной боли, отсутствием органических изменений желчного пузыря, снижением фракции его опорожнения.
Сегодня основной причиной дисфункции желчевыводящих путей, в частности желчного пузыря, считается наличие литогенной желчи (желчи, перенасыщенной холестерином), обусловленное как нерациональным питанием, так и генетической предрасположенностью к перенасыщению желчи. На фоне изменения состояния гладкомышечных клеток и реакции на холецистокинин нарушается расслабление шейки желчного пузыря в ответ на холецистокинин, пузырь не может эвакуировать содержимое. Развивается функциональная обструкция на уровне пузырного протока и двенадцатиперстной кишки.
Функциональное расстройство сфинктера Одди (ФРСО) билиарного типа сопровождается приступами типичной билиарной боли, повышением активности печеночных ферментов или расширением желчного протока, отсутствием органических изменений. Развитие дискинезии сфинктера Одди у пациентов, перенесших холецистэктомию, вероятно, связано с повышением объемной нагрузки на общий желчный проток (депонирование желчи) и сфинктер Одди. При холецистэктомии возможно повреждение невральных путей регуляции.
Экспертами РГА разработаны алгоритмы диагностики дисфункции желчного пузыря и сфинктера Одди.
Диагностика дисфункции желчного пузыря предусматривает прежде всего оценку характера боли, уровня печеночных и панкреатических ферментов, исключение органических заболеваний такими рутинными методами, как УЗИ, гастроскопия. В отсутствие органических заболеваний целесообразно провести ультразвуковую холецистографию, чтобы оценить сократимость желчного пузыря. Если данное исследование провести невозможно, но имеются аргументы в пользу нарушенной функции желчного пузыря, врач вправе диагностировать функциональное расстройство желчного пузыря. При нормальной фракции выброса желчного пузыря устанавливается диагноз функциональной билиарной боли.
Алгоритм диагностики дисфункции сфинктера Одди несколько сложнее, так как эти пациенты перенесли холецистэктомию, у них не исключено наличие камней в желчных протоках или стриктур. Для лучшего осмотра зоны сфинктера рекомендуется проводить магнитно-резонансную холангиопанкреатографию, а также эндоУЗИ панкреатобилиарной зоны. Отсутствие органической патологии и структурных изменений позволяет диагностировать ФРСО билиарного типа.
Для купирования билиарной боли традиционно используются спазмолитики. В рекомендациях РГА по диагностике и лечению дискинезии желчевыводящих путей в перечень спазмолитических средств включен тримебутин (Тримедат®). Тримебутин – агонист периферических мю-, каппа- и дельта-опиоидных рецепторов. Как известно, в билиарном тракте половина нейронов имеет опиоидные рецепторы. Кроме того, тримебутин блокирует Na+- и Ca2+-каналы гладкомышечных клеток ЖКТ, обеспечивая спазмолитическое действие, снижает висцеральную чувствительность и индуцирует третью фазу мигрирующего моторного комплекса.
В исследовании Э.П. Яковенко и соавт. (2014) показано, что четырехнедельный курс терапии тримебутином (Тримедат®) в дозе 600 мг/сут способствовал купированию клинических симптомов у большинства больных с дисфункцией желчного пузыря и сфинктера Одди билиарного типа22.
Ю.О. Шульпекова представила результаты неинтервенционной наблюдательной программы TRIBUNE (Trimedat® for Biliary Functional diseases patientes), проведенной на базе Клиники пропедевтики внутренних болезней, гастроэнтерологии и гепатологии им. В.Х. Василенко университетской клинической больницы № 2 Первого МГМУ им. И.М. Сеченова с целью изучения опыта применения препарата Тримедат® (тримебутина) в рутинной практике врача амбулаторного и стационарного звена в лечении пациентов с функциональными заболеваниями желчевыводящих путей. Информационными партнерами исследования выступили РГА и Российское общество по изучению печени. Задачами наблюдательной программы были изучение выраженности билиарной боли и диспепсических симптомов у пациентов с функциональными заболеваниями желчного пузыря и желчевыводящих путей и анализ практики применения препарата Тримедат® у этой категории пациентов.
В программу были включены 100 пациентов в возрасте от 18 до 65 лет (33% мужчин, 67% женщин, средний возраст 42,2 ± 13,2 года). В соответствии с формулировками Римского консенсуса IV, подавляющее большинство участников исследования (83%) имели функциональное расстройство желчного пузыря, 16% – ФРСО.
Всем пациентам были проведены необходимые для исключения органических заболеваний диагностические исследования: общий и биохимический анализ крови, анализ кала на скрытую кровь, УЗИ органов брюшной полости, эзофагогастродуоденоскопия с прицельным осмотром фатерова сосочка. Для дополнительного подтверждения дисфункции желчного пузыря проводилась ультразвуковая холецистография до и после лечения. Для надежного исключения органических изменений желчных путей у пациентов, перенесших холецистэктомию, проводилась магнитно-резонансная холангиопанкреатография.
Дизайн программы предусматривал оценку симптомов по Шкале оценки желудочно-кишечных симптомов, разработанной и валидизированной специалистами Воронежской государственной медицинской академии им. Н.Н. Бурденко, до начала лечения, а также во время визитов к врачу на 7-й, 14-й и 28-й дни от начала терапии препаратом Тримедат®.
Пациенты (n = 95) получали препарат Тримедат® (тримебутин) в стандартной дозе 200 мг три раза в день в течение 28 дней.
Динамика выраженности билиарной боли на фоне лечения. На фоне применения препарата сильная боль купировалась уже к 14-му дню. По мере использования препарата снижалась доля пациентов с умеренной болью, возрастала доля пациентов с незначительной болью и незначительными неприятными ощущениями в подложечной области, не связанными с приемом пищи, функцией кишечника и положением тела. К 28-му дню терапии препаратом Тримедат® билиарная боль и дискомфорт в подложечной области не беспокоили большинство участников исследования (71,7%).
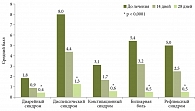
Динамика выраженности желудочно-кишечных синдромов на фоне лечения. Через 28 дней лечения препаратом Тримедат® отмечалось достоверное уменьшение выраженности не только билиарной боли, но также диарейного, диспепсического, констипационного и рефлюксного синдромов (рис. 4).
Проведенное по окончании терапии повторное исследование фракции опорожнения желчного пузыря подтвердило эффективность терапии препаратом Тримедат®: если до начала терапии фракция опорожнения желчного пузыря менее 50% имела место у 64% больных, то через 28 дней терапии – только у 15% пациентов.
На основании полученных результатов были сформулированы следующие выводы:
- применение препарата Тримедат® у пациентов с функциональными расстройствами желчного пузыря и сфинктера Одди сопровождается уменьшением тяжести основных симптомов – билиарной боли, тошноты, вздутия живота;
- у значительной части пациентов с дисфункцией желчного пузыря увеличивается фракция опорожнения желчного пузыря, что свидетельствует о нормализации оттока желчи, предположительно за счет нормализации давления в двенадцатиперстной кишке и тонуса билиарных сфинктеров.
Тримебутин включен в клинические рекомендации РГА по лечению дискинезии желчевыводящих путей, желчнокаменной болезни, синдрома раздраженного кишечника, функциональной диспепсии, по ведению пациентов с абдоминальной болью. Препарат также упоминается в рекомендациях Римского консенсуса IV по лечению дискинезии желчного пузыря и сфинктера Одди.
ГЭРБ: моно- или комбинированная терапия, выбор правильной тактики лечения
Следующее свое выступление профессор кафедры пропедевтики внутренних болезней, руководитель лаборатории исследований двигательной функции желудочно-кишечного тракта Клиники внутренних болезней, гастроэнтерологии и гепатологии им. В.Х. Василенко Первого МГМУ им. И.М. Сеченова, д.м.н. Александр Сергеевич ТРУХМАНОВ начал с оценки распространенности различных клинических форм ГЭРБ. Согласно статистике, у 60% пациентов с ГЭРБ регистрируется неэрозивная форма, у 37% – эрозивный эзофагит, 3% – пищевод Барретта23. Таким образом, пациенты с неэрозивной формой представляют собой наиболее распространенную группу больных ГЭРБ. Спектр и выраженность у них клинической симптоматики, снижение качества жизни сопоставимы с таковыми у пациентов с рефлюкс-эзофагитом.
Несомненно, актуальной темой для клиницистов является и эрозивный рефлюкс-эзофагит, который характеризуется множественными осложнениями. Непрерывное рецидивирование эрозивного эзофагита – основа развития стриктур пищевода. Именно наличие рецидивирующих эрозий пищевода служит субстратом для развития пищевода Барретта, относящегося к факультативным предраковым заболеваниям. В настоящее время для установления диагноза «пищевод Барретта» необходимо эндоскопическое и гистологическое подтверждение метаплазии эпителия слизистой оболочки пищевода по кишечному типу.
Как известно, антисекреторная терапия считается базисной у пациентов с ГЭРБ, но в ряде случаев терапия ИПП неэффективна.
Характер рефлюктата при ГЭРБ может определяться содержимым желудка (пепсин, соляная кислота, компоненты пищи), а также дуоденальным содержимым (желчь, бикарбонат и ферменты поджелудочной железы). Кишечная метаплазия часто ассоциирована с рефлюктатом, в состав которого входит не только соляная кислота желудочного сока, но и содержимое двенадцатиперстной кишки. У пациентов с ГЭРБ кислотный рефлюктат присутствует в 50% случаев, слабокислый – в 40%.
Цитотоксическое действие конъюгированных, тригидроксильных желчных кислот и лизолецитина усиливается при смешанном рефлюксе в присутствии соляной кислоты. Неконъюгированные и дигидроксильные желчные кислоты и трипсин наиболее токсичны при нейтральном и слабощелочном рН. На фоне применения ИПП неконъюгированные желчные кислоты начинают доминировать над конъюгированными, а длительная антисекреторная терапия выступает в роли патогенетического фактора метаплазии и дисплазии эпителия24.
Не следует забывать и о развивающемся на фоне билиарного рефлюкса рефлюкс-гастрите. К характерным морфологическим признакам этого варианта поражения желудка можно отнести феномен фовеолярной гиперплазии, пролиферацию гладкомышечных клеток в собственной пластинке, а также изменение продукции мукоцитами муцинов, играющих важную роль в протекции слизистой оболочки.
Без сомнения, лечение желчного гастрита и ГЭРБ на фоне дуоденогастрального рефлюкса требует комплексного подхода, направленного на повышение эффективности терапии, снижение риска развития осложнений и выраженности клинических проявлений, улучшение качества жизни больных. Для этого стандартные схемы лечения с ИПП и урсодезоксихолевой кислотой дополняют антацидами/альгинатами для быстрого купирования симптомов и адсорбции желчных кислот и лизолецитина, а также адсорбентами и прокинетиками25, 26.
Прокинетики (например, регулятор моторики с прокинетической активностью Тримедат®) способствуют восстановлению физиологического состояния пищевода, воздействуя на патогенетические механизмы ГЭРБ, уменьшая количество преходящих расслаблений нижнего пищеводного сфинктера и улучшая пищеводный клиренс путем стимуляции двигательной функции нижележащих отделов пищеварительного тракта25, 26.
Антациды также занимают важное место в лечении ГЭРБ. Одним из ярких представителей нового поколения антацидов является препарат Антарейт® (магалдрат + симетикон). В доклинических исследованиях изучено и доказано цитопротективное действие магалдрата, обусловленное способностью увеличивать секрецию слизи желудка в ответ на воздействие повреждающих факторов, таких как этанол, индометацин, ацетилсалициловая кислота, стресс27. В другом исследовании показано, что магалдрат стимулирует эндогенный синтез простагландина E2 в слизистой оболочке желудка in vitro и in vivo, что также способствует цитопротекции клеток слизистой оболочки желудка28.
В рандомизированном плацебоконтролируемом исследовании с участием 100 пациентов, госпитализированных по поводу различных тяжелых заболеваний, применение магалдрата (800 мг каждые четыре часа) снижало частоту кровотечений из верхних отделов ЖКТ по сравнению с плацебо. Разница между группами была статистически значимой, что позволило исследователям рекомендовать магалдрат в качестве средства для профилактики кровотечений из стрессиндуцированных язв больным, госпитализированным по поводу различных тяжелых заболеваний29.
Таким образом, лечение и ГЭРБ, и гастрита должно проводиться с учетом таких патогенетических факторов, как дуоденогастральный и дуоденогастроэзофагеальный рефлюксы. Назначение прокинетиков (Тримедат®) и антацидов (Антарейт®) в составе комплексной терапии этих заболеваний повышает ее эффективность.
Антарейт® – уникальный антацид нового поколения
Доктор медицинских наук, в.н.с., научный руководитель Института фармакоинформатики (ИФИ) при ФИЦ ИУ РАН, заместитель директора по научной работе РСЦ Института микроэлементов ЮНЕСКО при РНИУ РГМУ им. Н.И. Пирогова, профессор кафедры фармакологии и клинической фармакологии ФГБОУ ВО ИвГМА Ольга Алексеевна ГРОМОВА сфокусировала внимание аудитории на основных клинико-фармакологических характеристиках препарата Антарейт® – нового невсасывающегося антацида, в состав которого входят магалдрат (антацид) и симетикон (пеногаситель).
Уже почти 1000 лет антациды используются для лечения повышенной кислотности, рефлюкс-эзофагита, изжоги, отрыжки кислым. Однако устаревшие антацидные средства только нейтрализуют соляную кислоту, что вызывает вторичную гиперсекрецию желудочного сока и усугубляет эрозивные процессы. Между тем современное антацидное средство должно отличаться быстрым началом действия, сохранением процесса пищеварения, удержанием уровня рН в диапазоне 3–5, отсутствием вторичной гиперсекреции желудочного сока, низким газообразованием и вспениванием, защитой слизистой оболочки желудка, отсутствием алюмотоксикоза.
Антацид нового поколения Антарейт® – препарат, работающий по принципу фармакологического синергизма. Состав и структура магалдрата определяют механизм его действия. В отличие от смеси аморфных (неравномерных, нестабильных) по структуре веществ, к которым относятся антациды на основе гидроксидов алюминия/магния, магалдрат представляет собой специфическое кристаллическое (упорядоченное стабильное) вещество. Магалдрат состоит из кристаллов гидрохлорида алюминия и магния в форме слоев решеток, что определяет его поэтапное реагирование с соляной кислотой и позволяет устанавливать и поддерживать идеальный стабильный pH в желудке между 3 и 5.
Профессор О.А. Громова представила пошаговый механизм действия магалдрата. Растворение приводит к обводнению кристаллов магалдрата, и за одну-две минуты первый слой расходуется, кислотность по pH снижается. Важно, что образующиеся при растворении кристаллов магалдрата частицы характеризуются стабильным размером и содержат структурированный, плотно упакованный гидроксид алюминия. Секреция алюминия из этих частиц происходит постепенно и достаточно медленно, что способствует поддержанию нетоксических концентраций ионов алюминия и предупреждению возникновения алюмотоксикоза.
При достижении pH > 5 химическая реакция останавливается. Оставшиеся слои сохраняются до тех пор, пока количество соляной кислоты в просвете желудка вновь не возрастет. Далее включается в действие следующий слой магалдрата. Это постепенное реагирование с соляной кислотой в зависимости от величины pH способствует длительному (до трех часов) поддержанию комфортного диапазона внутрижелудочного pH (3–5).
Магалдрат также оказывает обволакивающий и даже репаративный эффект. Так, частицы гексакваалюминия, образующиеся при растворении магалдрата, обволакивают область изъязвления, причем их размер (2 мкм) облегчает миграцию эпителиоцитов и фибробластов в процессе репарации стенки желудка30. Кроме того, магалдрат проявляет антиоксидантный эффект и умеренные свойства блокатора H2-гистаминовых рецепторов, стимулирует синтез простангландина E2 и секрецию слизи клетками слизистой оболочки желудка31.
Магалдрат адсорбирует желчные кислоты и их токсичное производное лизолецитин, которые повреждают слизистую оболочку желудка и пищевода. Показано, что магалдрат в дозе 800 мг демонстрирует наилучшие показатели адсорбции желчных кислот по сравнению с другими антацидами32, 33.
Уникальные фармакологические свойства позволяют рассматривать препарат Антарейт® в качестве оптимального антацидного препарата.
Микробиота, короткоцепочечные жирные кислоты и их значение для функции кишечника
Последние десятилетия научное медицинское сообщество особое внимание уделяет изучению микробиоты как сложной ассоциации микроорганизмов, находящихся в постоянной связи с макроорганизмом. Великий русский ученый Илья Ильич Мечников утверждал, что «многочисленные и разнообразные ассоциации микроорганизмов, населяющие пищеварительный тракт человека, в значительной степени определяют физическое и духовное здоровье».
По словам д.м.н., профессора кафедры гастроэнтерологии ФГБУ ДПО «Центральная государственная медицинская академия» УД Президента РФ Марии Дмитриевны АРДАТСКОЙ, на современном этапе при оценке патофизиологических аспектов заболеваний все большее значение придается взаимодействию оси «кишечник – микробиота – мозг», которая включает в себя эндокринные, иммунные и нейрогуморальные пути.
Популяционный состав микробиоты насчитывает более 10–30 тысяч видов. Преобладают представители филов Bacteriodes и Firmicutis, за ними следуют Actinobacteria, Proteobacteria, Archea.
Результаты исследований позволили выделить три энтеротипа кишечной микробиоты человека – Bacteriodes, Prevotella, Ruminococcus, а также установить, что большинство микроорганизмов обитает в толстой кишке (около 70% всех микроорганизмов, населяющих организм человека). Предполагается, что, зная энтеротип, можно прогнозировать особенности обмена веществ и предрасположенность к определенным заболеваниям.
С биоразнообразием тесно связаны еще две ключевые характеристики микробиоты – стабильность (устойчивость) и функциональная избыточность34. Биоразнообразие повышает устойчивость микробных сообществ к различным экологическим факторам. Стабильность микробиоты во многом определяется состоянием ее «ключевых» видов, составляющих так называемое ядро микробиоты35.
Функциональная избыточность – неотъемлемое свойство микробиоты кишечника, характеризующее выполнение сходных метаболических функций филогенетически различными микроорганизмами, то есть фактически возможность замещения одних видов другими без потери функции. Биологический смысл функциональной избыточности – поддержание функциональной стабильности микробиоты и обеспечение ей определенных эволюционных преимуществ в мутуалистических взаимоотношениях с макроорганизмом34, 36, 37.
Вероятнее всего, филогенетическое ядро микробиоты кишечника составляют представители родов Alistipes, Anaerostipes, Bacteriodes, Bifidobacterium, Blautia, Butyrivibrio, Clostridium, Collinsella, Coprococcus, Dorea, Eubacterium, Faecalibacterium, Parabacteroides, Prevotella, Ruminococcus, Roseburia, Subdoligranulum38. Как минимум половина родов, претендующих на ключевые позиции в микробиоте, относятся к бутират-продуцирующим микроорганизмам. Остальные – продуценты еще двух основных короткоцепочечных жирных кислот (КЦЖК) – пропионата и ацетата, а также важнейших интермедиаторов микробного метаболизма – лактата, сукцината и формиата39.
К основным функциям нормальной кишечной микробиоты относятся защитная (обеспечение колонизационной резистентности), иммунизирующая, регулирование моторной активности толстой кишки, метаболическая (синтез КЦЖК), витаминов, бактериоцинов, антиоксидантов, участие в метаболизме желчных кислот и стероидов).
Низкомолекулярные соединения микробного происхождения всегда присутствуют в биологических жидкостях человека, а нарушение гомеостаза этих молекул служит фактором развития различных заболеваний. Независимо от индивидуальных различий в составе кишечной микробиоты кишечный микробиоценоз у каждого человека функционирует как целая экосистема и метаболический орган, который обеспечивает необходимое количество и профиль конечных метаболитов – КЦЖК, в первую очередь уксусной, пропионовой, масляной.
Несмотря на вариации концентраций КЦЖК при их измерении в кале у разных людей, их соотношение стабильно – 60 : 20 : 20 (ацетат : пропионат : бутират). Уровень и соотношение КЦЖК является важным параметром кишечного гомеостаза, который должен поддерживаться в заданном диапазоне40. Дело в том, что именно на КЦЖК ложится основная функциональная нагрузка в осуществлении энерогообеспечения эпителия, колонизационной резистентности, моторной активности кишечника, усиления местного иммунитета, поставки субстратов глюконеогенеза и липогенеза и т.д.41 Не менее 95% КЦЖК, вырабатываемых микробиотой, адсорбируется колоноцитами и направлено на их энергообеспечение и обеспечение нормального функционирования плотных клеточных контактов и реализуется на местном уровне42.
В экспериментальных и клинических исследованиях показано, что прием масляной кислоты вызывает ускорение насыщения, снижение массы тела и увеличение эндогенной продукции глюкагоноподобного пептида 143. Необходимо отметить, что межклеточные контакты – это специализированные клеточные структуры, скрепляющие клетки при формировании тканей, создающие барьер проницаемости и служащие для межклеточной коммуникации. Масляная кислота фактически локально поддерживает и осуществляет барьерную функцию кишечной стенки, способствуя поддержанию нормального функционирования этих плотных контактов, предотвращая таким образом проникновение низкомолекулярных соединений, токсинов и даже бактериальную транслокацию.
Ученые оценивали роль микробиоты кишечника, инкретинов и жировой ткани в развитии сахарного диабета 2-го типа и неалкогольной жировой болезни печени. Показано, что дисбаланс микробиоты кишечника приводит к воспалению, секреции цитокинов воспаления и инсулинорезистентности. Так, при сахарном диабете 2-го типа нарушается продукция бутирата и снижается количество бутират-продуцирующих бактерий. Нарушение баланса микробиоты кишечника способствует нарушению интестинального барьера и увеличению уровня липополисахаридов плазмы. Это ведет к активации провоспалительных процессов (через активацию Toll-подобных рецепторов-4) и снижению чувствительности к инсулину периферических тканей44.
Помимо диеты коррекция нарушений микробиоты кишечника предусматривает применение ряда лекарственных средств: анти-, про-, пре- и метабиотиков. При этом класс пребиотиков является одним из наиболее значимых. Пребиотики, метаболизируясь в конечном итоге до метаболитов, могут оказывать благое влияние на организм человека. Лактитол (Экспортал®) наряду с дозозависимым слабительным эффектом обладает выраженным пребиотическим эффектом. Лактитол расщепляется бактериями толстой кишки с образованием короткоцепочечных жирных кислот. Являясь источником энергии для сахаролитических бактерий толстой кишки, лактитол оказывает пребиотический эффект. Одновременно с этим продукты метаболизма лактитола в толстой кишке повышают осмотическое давление и делают содержимое кишечника более вязким за счет удержания воды, способствуют увеличению объема кала, снижают pH содержимого толстой кишки, что приводит к стимуляции кишечной моторики. В совокупности это обуславливает слабительный эффект.
В исследовании in vitro сравнительный анализ концентрации метаболитов лактитола и лактулозы показал, что при ферментации лактитола образуется в 10 раз больше масляной кислоты, чем при ферментации лактулозы. Следовательно, эффект лактитола на локальные и системные процессы более выраженный. Вероятно, этой метаболизацией и объясняется низкая частота побочных эффектов в виде метеоризма при приеме лактитола (препарат Экспортал®) и, естественно, более высокий уровень приверженности пациентов его использованию.
Указанные эффекты были продемонстрированы в рамках наблюдательной программы по изучению применения лактитола у пациентов с хроническими запорами (n = 100). Помимо слабительного эффекта лактитол продемонстрировал высокую активность в отношении продукции бутирата: содержание масляной кислоты в кале пациентов, получавших лактитол, в два раза превышало аналогичный показатель у пациентов, получавших лактулозу. Этим могут объясняться хорошая переносимость лактитола и редкие побочные эффекты в виде метеоризма45.
Таким образом, Экспортал® (лактитол) не только нормализует работу кишечника, но также способствует восстановлению кишечной микробиоты, ее локальных и системных функций.
Роль питания в развитии и лечении функциональных заболеваний ЖКТ. Непереносимость компонентов продуктов питания
Как отметила Валерия Олеговна КАЙБЫШЕВА, к.м.н., старший научный сотрудник научно-исследовательской лаборатории хирургической гастроэнтерологии и эндоскопии Российского национального исследовательского медицинского университета им. Н.И. Пирогова, прием пищи – жизненно важная потребность человека, необходимая для пополнения запасов энергии, поддержания жизнедеятельности, обеспечения синтетических процессов, роста и созревания организма. В то же время компоненты продуктов питания могут вызывать раздражение слизистой оболочки желудочно-кишечного тракта и даже индуцировать развитие тяжелых заболеваний, объединенных в широком смысле общим термином «нежелательные реакции на компоненты продуктов питания». Нежелательные реакции на компоненты продуктов питания могут развиваться по типу пищевой аллергии, аутоиммунных заболеваний и пищевой непереносимости46.
В основе пищевой непереносимости лежит генетически детерминированное нарушение синтеза ферментов, участвующих в расщеплении или абсорбции определенного нутриента. Отсутствие или функциональная неполноценность фермента, участвующего в переваривании того или иного компонента пищи, приводит к нарушению его абсорбции, ускорению перистальтики кишки, задержке в просвете кишечника жидкости, возникновению боли и водянистой диареи.
Согласно последним статистическим данным, пищевая непереносимость наблюдается примерно у 20% населения планеты, 3/4 из них в качестве триггера возникновения симптомов называют углеводы47–51.
Особенно актуальна проблема непереносимости углеводов среди больных с СРК, поскольку до 50–84% из них утверждают, что возникновение или увеличение выраженности симптомов со стороны ЖКТ связано с приемом продуктов, содержащих такие углеводы, как лактоза, фруктоза, фруктаны, галактаны49–53.
При пищевой непереносимости, несмотря на наличие клинических симптомов со стороны ЖКТ, не удается выявить изменений в периферической крови, отсутствуют морфологические изменения слизистой оболочки тонкой и толстой кишки. Пищевая непереносимость клинически проявляется болью в животе, вздутием, диареей (рис. 5)54. Эти симптомы возникают через несколько часов после приема в пищу непереносимых продуктов.
У части пациентов с пищевой непереносимостью выявляются и экстраинтестинальные симптомы: хроническая усталость, тревожность, нарушение сна, боли в костях и суставах, онемение конечностей, мигрень, выпадение волос и проч.55
Существует множество теорий развития внекишечных проявлений пищевой непереносимости. Одна из них объясняет внекишечные проявления пищевой непереносимости феноменом «синдрома повышенной проницаемости кишечника» (leaky gut syndrom). Речь идет об увеличении транс- и парацеллюлярной проницаемости слизистой оболочки тонкой кишки вследствие повреждающего действия крупномолекулярных веществ, не подвергшихся должному ферментативному расщеплению. Увеличение проницаемости кишечного барьера для иммуногенных белков приводит к их попаданию в кровеносное русло и развитию иммуноиндуцированного воспаления в периферических тканях.
Как правило, больным с пищевой непереносимостью устанавливают диагноз «функциональная диспепсия» или «синдром раздраженного кишечника» и назначают лечение без учета возможного влияния пищевых продуктов на возникновение симптомов.
В клинической практике наиболее часто наблюдается непереносимость углеводов (фруктозы, лактозы, фруктанов и галактанов и т.д.). Непереносимость белков встречается крайне редко. Реакции на пищевые белки чаще протекают с вовлечением иммунной системы: пищевая аллергия, аутоиммунные реакции (целиакия).
Согласно результатам популяционных исследований, из плохо переносимых продуктов, содержащих простые и сложные углеводы, пациенты с СРК наиболее часто называют фрукты и овощи, свежий пшеничный хлеб, бобовые, лук, чеснок, алкоголь, молоко.
Нормальная физиология переваривания углеводов включает процесс расщепления ферментами пищеварительного тракта дисахаридов, олигосахаридов, полисахаридов до моносахаридов. Слюнные железы и поджелудочная железа вырабатывают амилазу, расщепляющую крахмал и гликоген (полисахариды, состоящие из молекул глюкозы) до дисахарида мальтозы. Дисахаридазы щеточной каймы тонкой кишки метаболизируют дисахариды до моносахаридов: лактаза расщепляет молочный сахар лактозу на молекулу глюкозы и молекулу галактозы, мальтаза – дисахарид мальтозу на две молекулы глюкозы, сахараза – сахарозу на глюкозу и фруктозу, трегалаза – трегалозу на две молекулы глюкозы. Образовавшиеся моносахариды глюкоза, фруктоза, галактоза транспортируются через мембрану энтероцита с помощью транспортных белков-переносчиков. В случае генетически детерминированного отсутствия фермента или белка-транспортера либо при их сниженной функциональной активности молекулы углеводов не подвергаются достаточному метаболизму и абсорбции. Неабсорбированные углеводы, оказывая выраженное осмотически активное действие, обусловливают задержку жидкости в просвете тонкой кишки, ускорение кишечной перистальтики, развитие осмотической диареи. Попадая в нерасщепленном виде в просвет толстой кишки, углеводы подвергаются метаболизму бактериальными ферментами толстокишечной микрофлоры с образованием короткоцепочечных жирных кислот, молочной кислоты, углекислого газа, метана, водорода и воды, вызывающих раздражение толстой кишки и активизацию ее моторики. Образование большого количества газов в просвете толстой кишки в свою очередь приводит к возникновению боли и вздутию живота.
Как уже отмечалось, одной из причин пищевой непереносимости может быть генетически обусловленное отсутствие фермента, отвечающего за расщепление или всасывание углевода. Например, мальабсорбция глюкозы-галактозы – редкое аутосомно-рецессивное заболевание, в основе развития которого лежит дефект гена SLCSA1, кодирующего синтез белка – котранспортера глюкозы и галактозы и двух молекул натрия через мембрану эпителиальных клеток тонкой кишки в кровеносное русло. В результате нарушения синтеза белка-транспортера глюкоза и галактоза не всасываются, а подвергаются метаболизму бактериальными ферментами в толстой кишке. Выраженное осмотическое действие глюкозы и галактозы в тонкой кишке приводит к развитию тяжелой диареи и обезвоживанию. Диагностика мальабсорбции глюкозы-галактозы основана на характерной клинической картине: раннее (после рождения) начало диареи, отсутствие клинического улучшения на фоне безлактозной диеты. Верификацию диагноза проводят по результатам генетического тестирования на наличие мутации гена SLCSA1. Лечение мальабсорбции глюкозы-галактозы включает строжайшую диету с исключением из рациона молока и молочных продуктов, при метаболизме которых образуется галактоза, а также сахара и сладостей, являющихся источниками глюкозы56. Но чаще в популяции встречается непереносимость углеводов, обусловленная не полным отсутствием фермента, отвечающего за переваривание того или иного углевода, а недостаточной функциональной активностью фермента. По такому механизму развиваются характерные симптомы непереносимости при переедании продуктов, содержащих фруктозу (фрукты и кондитерские изделия), трегалозы (грибы и дрожжи), фруктанов и галактанов (овощи и фруты). Так, мальабсорбция фруктозы обусловлена функциональной несостоятельностью белка – транспортера фруктозы, проявляющейся только при чрезмерном употреблении в пищу продуктов, содержащих фруктозу. Доза фруктозы, которую способен усвоить практически каждый человек в отсутствие дискомфорта в ЖКТ, составляет 10–15 г (300 г груш, 250 г яблок, 100 г кураги). Необходимо отметить, что глюкоза увеличивает активность фермента – транспортера фруктозы, в связи с чем при добавлении сахара к фруктам способность к абсорбции фруктозы значительно возрастает57.
Фруктаны и галактаны – крупномолекулярные углеводы, которые в большом количестве содержатся в фасоли, чечевице, салате, капусте, луке, чесноке, моркови, свекле, орехах, пшенице, ржи и т.д. У человека практически отсутствуют ферменты, расщепляющие связи во фруктанах и галактанах, содержащихся преимущественно во фруктах и овощах. Так, отсутствие фермента альфа-галактозидазы, расщепляющего 1- и 6-галактозные связи, приводит к тому, что лишь 5–15% поступивших с пищей фруктанов и галактанов абсорбируется в тонкой кишке. Оставшаяся доля этих углеводов поступает в толстую кишку, вызывая сильнейшее вздутие, боль и диарею.
Таким образом, ряд углеводов плохо расщепляются или всасываются в тонкой кишке, поступают в толстую кишку и ферментируются бактериями с образованием газов. Речь идет об олигосахаридах (фруктанах и галактанах), дисахаридах (лактозе, трегалозе), моносахаридах (фруктозе) и полиолах. Они плохо перевариваются и в организме здоровых людей. Однако, несмотря на вздутие и боль в животе, в слизистой оболочке кишечника отсутствует воспаление. За счет бактериального брожения фруктанов и галактанов в толстой кишке продуцируется большое количество короткоцепочечных жирных кислот, что благоприятно влияет на эпителий слизистой оболочки и рост микрофлоры. Рекомендованная Всемирной организацией здравоохранения доза пищевых волокон – не менее 30 г/сут. Вместе с тем обычный рацион современного человека удовлетворяет потребность в пищевых волокнах только на 30–60%. Большинство здоровых людей (о больных ФД и СРК говорить не приходится) ограничивают употребление пищевых волокон, чтобы избежать развития метеоризма. Пациентам с симптомами пищевой непереносимости на фоне приема овощей и фруктов рекомендуется применение фермента альфа-галактозидазы. Альфа-галактозидаза гидролизует сложные углеводы, сокращает «микробное переваривание» сложных углеводов с образованием газов, предупреждает развитие метеоризма. Применение данного фермента позволяет увеличить в рационе прием пищевых волокон без развития метеоризма.
В ряде клинических исследований показана эффективность альфагалактозидазы при метеоризме. В частности, в двойном слепом перекрестном исследовании эффективности альфа-галактозидазы у лиц с непереносимостью олигосахаридов наблюдалось статистически значимое снижение частоты метеоризма на фоне приема альфа-галактозидазы58.
В рандомизированном двойном слепом плацебоконтролируемом исследовании с участием 52 детей с выраженным метеоризмом на фоне двухнедельного приема альфа-галактозидазы значительно снизилась доля пациентов с метеоризмом (р = 0,024) (по сравнению с группой плацебо)59. Альфа-галактозидаза включена в национальные рекомендации по лечению больных с СРК. В России альфа-галактозидаза выпускается в виде биологически активной добавки к пище Орликс®.
Прием Орликса предотвращает вздутие живота без ограничения пищевых волокон в рационе. Схема приема: 1–3 таблетки с первыми порциями пищи.
Заключение
Функциональные заболевания ЖКТ не представляют угрозы для жизни пациентов, однако значительно снижают качество их жизни. Сегодня для эффективного лечения функциональных заболеваний пищеварительной системы и повышения качества жизни пациентов в арсенале практического врача имеется широкий выбор препаратов гастроэнтерологического профиля с доказанной эффективностью, представленных в производственном портфеле компании «Валента Фарм».
Результаты наблюдательных программ TREND и TRIBUNE продемонстрировали эффективность препарата Тримедат® (тримебутин) у пациентов с функциональной диспепсией, функциональными расстройствами желчного пузыря и сфинктера Одди. Данные ряда исследований показали, что применение препарата Тримедат® (тримебутин) при функциональных заболеваниях ЖКТ способствует контролю боли и спазмов, нормализации моторики.
Назначение регулятора моторики с прокинетической активностью Тримедат® (тримебутин) и препарата Антарейт® (комбинация антацида нового поколения – магалдрата и противопенного агента симетикона) в составе комплексной терапии ГЭРБ патогенетически обосновано и способствует повышению ее эффективности.
На современном этапе количественные и качественные сдвиги в составе микробиоты ЖКТ рассматриваются в качестве важного патогенетического фактора в развитии функциональных заболеваний ЖКТ. Препарат Экспортал® (лактитол) способствует не только нормализации работы кишечника, но также и восстановлению кишечной микробиоты, что положительно сказывается на работе всего организма.
Непереносимость углеводов зачастую становится причиной возникновения абдоминальной боли и вздутия живота и у практически здоровых людей, и у пациентов с функциональными заболеваниями ЖКТ. Пациентам с выраженными симптомами пищевой непереносимости, обусловленной употреблением продуктов, содержащих олигосахариды с 1- или 6-галактозной связью (например, фасоль, чечевица, капуста, морковь, фисташки, виноград и др.), в качестве альтернативы элиминационной диете может быть рекомендовано применение биологически активной добавки Орликс®, содержащей фермент альфа-галактозидазу.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.