Микробиоценозы открытых полостей и мукозальный иммунитет
- Аннотация
- Статья
- Ссылки
- English
Введение
Микрофлора человека является основой его микроэкологии и оказывает непосредственное влияние на жизнедеятельность и состояние макроорганизма. Микробиоценоз открытых полостей макроорганизма – динамическая микроэкологическая система, которая выполняет или регулирует многочисленные функции макроорганизма. В систему микробиоценоза входит макроорганизм, его микрофлора (совокупность типичных для определенного биологического вида и конкретного биотопа ассоциаций микроорганизмов) и окружающая среда. Для окружающей среды характерны единство и способность к саморегуляции, она является интегральной частью организма хозяина и, в частности, местного иммунитета. Человеку свойственен только ему присущий микроэкологический гомеостаз. Показатели состояния микробиоценозов отражают состояние реактивности макроорганизма – способности организма отвечать на воздействия внешней среды изменением своей жизнедеятельности, тем самым адаптироваться к различным условиям обитания.
Единство системы микробиоценозов слизистых открытых полостей и мукозального иммунитета
Слизистые открытых полостей макроорганизма представляют собой единую систему. Их барьерная функция определяется состоянием колонизационной резистентности – способностью микрофлоры и макроорганизма совместно защищать экосистему слизистых от патогенных микроорганизмов; является показателем состояния микробиоценоза биотопа [1–5].
Под местным (мукозальным) иммунитетом подразумевается комплекс клеточных и секреторных неспецифических и специфических реакций, включающий барьерные функции клеток кожи и слизистых оболочек, фагоцитарную активность нейтрофилов и макрофагов, Т-клеточный иммунитет, антитела, антимикробные белки внешних секретов, ингибиторы ферментов, цитокины. Местный иммунитет не отождествляется с секреторным иммунитетом, но в качестве его центрального звена рассматривается В-клеточный ответ лимфоидной ткани слизистых оболочек с участием железистого эпителия, поставляющего секреторный компонент.
Понятие местного иммунитета в настоящее время включает совокупность реагирования всех клеток лимфоидного ряда, заселяющих слизистые оболочки, совместно с макрофагами, нейтрофильными и эозинофильными гранулоцитами, тучными клетками и другими клетками соединительной ткани и эпителия [3, 6–11]. Следовательно, микробиоценозы слизистых открытых полостей и мукозальный иммунитет можно рассматривать как интегральную структурно-функциональную систему организма.
Взаимодействие микрофлоры биотопа с толл-подобными рецепторами
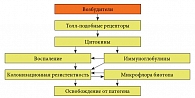
При изучении урогенитальных хламидиоза и уреаплазмоза, острых инфекционных заболеваний верхних дыхательных путей, в том числе острых и хронических бронхитов, установлена взаимосвязь толл-подобных рецепторов (Toll-like receptor, TLR) и микрофлоры биотопа. TLR контролируют запуск цитокинового каскада местной антиинфекционной резистентности, через который активируются иммуноглобулиновое звено и воспалительная реакция. Микрофлора биотопа определяет колонизационную резистентность слизистых (рис.), характеризующую течение инфекционного процесса, выраженность клинических и лабораторных проявлений и исход заболевания (излечение, хронизация). Колонизационная резистентность выступает как неотъемлемая часть мукозального иммунитета [7, 8, 12–19].
Функцию TLR оценивали оригинальным запатентованным методом определения уровня экспрессии генов TLR с помощью полимеразной цепной реакции (ПЦР) в реальном времени с обратной транскрипцией с использованием специфических праймеров. Предложенный метод оценки TLR можно рассматривать как дополнительный лабораторный тест, уточняющий клинические формы и прогнозирующий исход заболевания [8, 14, 20–22].
Установлено, что патогенные и условно-патогенные микроорганизмы (УПМ), попадая на слизистые, взаимодействуют с TLR эпителиальных клеток и запускают через активизацию цитокиновой системы воспалительную реакцию. TLR-2 и TLR-4 реагируют на бактериальные патогены, а TLR-3 и TLR-8 – на вирусные. При взаимодействии возбудителя с чувствительными для него клеточными элементами слизистых TLR клеток отвечают экспрессией генов как на патогенные, так и на условно-патогенные микроорганизмы, а при взаимодействии возбудителя с нечувствительными для него клетками эпителия слизистых – только на УПМ.
При остром и хроническом инфекционных процессах ведущими этиологическими факторами инфекционного процесса являются ассоциации из бактериальных и вирусных патогенов, а также УПМ. Различные уровни активации экспрессии генов TLR-2, TLR-4, TLR-3, TLR-8 зависят от качественного состава микробных сообществ (в частности, от превалирования грамположительных или грамотрицательных возбудителей или вирусных патогенов), присутствующих на слизистых оболочках открытых полостей организма. Активация экспрессии генов TLR-2, TLR-4, TLR-3, TLR-8 происходит более выраженно в ответ на патогенные и условно-патогенные микроорганизмы и менее выраженно – на нормофлору. Показатели уровней обсемененности УПМ прямо коррелируют с показателями уровней экспрессии генов TLR-2, TLR-4, TLR-3, TLR-8. Уровни экспрессии генов TLR-2, TLR-4, TLR-3, TLR-8 служат критериями оценки выраженности урогенитального хламидиоза и воспалительного процесса. Повышение экспрессии генов TLR-2, TLR-4, TLR-3, TLR-8 коррелирует с тяжестью клинических проявлений, а при выздоровлении их снижение свидетельствует об эрадикации возбудителя. Естественная или приобретенная супрессия генов TLR-2, TLR-4, TLR-3, TLR-8 обусловливает хроническое течение инфекции. При остром инфекционном процессе выявление низких уровней TLR-2, TLR-4, TLR-3, TLR-8 указывает на начало хронизации инфекционного процесса.
При инфекционных поражениях открытых полостей организма родовой и видовой состав патогенных и условно-патогенных микроорганизмов, выделенных от больных, служит дополнительным объективным критерием тяжести течения инфекционного процесса, а также позволяет дифференцированно судить об эффективности проводимой антибактериальной терапии и вносить необходимые коррективы в нее. Острое течение инфекционного процесса сопровождается достоверным снижением уровней индигенной микрофлоры в пристеночном и просветном биотопах слизистых, повышенной колонизацией их УПМ, многократным повышением уровней экспрессии генов TLR-2, TLR-4, TLR-3, TLR-8, цитокинов (интерлейкин (ИЛ)-1-бета, ИЛ-8, интерфенон (ИФН) гамма), фактора некроза опухоли (ФНО) альфа, иммуноглобулинов (Ig) IgG, IgA, sIgA, IgM и секреторного компонента (sc) и выраженностью местной воспалительной реакции (выявлена достоверная корреляционная зависимость между изменениями уровней перечисленных факторов), что свидетельствует о хорошей местной антиинфекционной резистентности. Хроническое течение инфекционного процесса, по сравнению с острым течением, сопровождается при обострении менее выраженными достоверными снижением уровней индигенной микрофлоры в пристеночном и просветном биотопах слизистых, повышением УПМ, повышением уровней экспрессии генов TLR-2, TLR-4, TLR-3, TLR-8, цитокинов ИЛ-1-бета, ИЛ-8, ИФН-гамма, ФНО-альфа, иммуноглобулинов IgG, IgA, sIgA, IgM и sc и слабо выраженной местной воспалительной реакцией, что свидетельствует о нарушении и снижении мукозальной антиинфекционной резистентности [8, 15, 22–25].
С учетом приведенных выше сведений и положений для оценки колонизационной резистентности слизистых открытых полостей организма была предложена оригинальная методология оценки нарушений их микробиоценозов [16, 26–31, 32, 33]*. При оценке состояния мукозального иммунитета предлагается следующая трактовка показателей выраженности нарушений микробиоценозов (дисбактериозов): высокая степень нарушения микробиоценоза свидетельствует о хорошем состоянии мукозального иммунитета и антиинфекционной резистентности. Чем ниже степень нарушения микробиоценоза, тем хуже состояние мукозального иммунитета и антиинфекционной резистентности (происходит хронизация инфекционного процесса и удлиняется период выздоровления).
Оценка выраженности нарушений микробиоценоза влагалища
Нормоценоз влагалища. Наличие на поверхности эпителиоцитов менее 25 бактериальных клеток, представленных грамположительными палочками. Количество лейкоцитов менее 10 в поле зрения. Отсутствие ключевых клеток (I степень чистоты мазка). Содержание в отделяемом 6–8 lg КОЕ/г лактобацилл. Содержание в соскобном материале 7–10 lg КОЕ/г лактобацилл. Отсутствие в отделяемом и в соскобном материале условно-патогенной факультативно-анаэробной и облигатно-анаэробной микрофлоры. Концентрация в смыве IgA 0 мкг/мл, sIgA ≤ 10 мкг/мл, IgM 0 мкг/мл, sc ≤ 10 мкг/мл.
Промежуточный тип микробиоценоза влагалища. Наличие на поверхности эпителиоцитов 25–50 бактериальных клеток, представленных грамположительными палочками, единичными грамположительными кокками и грамотрицательными палочками. Количество лейкоцитов 10–20 в поле зрения. Отсутствие ключевых клеток (II степень чистоты мазка). Содержание в отделяемом 4–5 lg КОЕ/г лактобацилл, 3–4 lg КОЕ/г условно-патогенной факультативно-анаэробной или облигатно-анаэробной микрофлоры и/или содержание в соскобном материале 5–6 lg КОЕ/г лактобацилл, 1–2 lg КОЕ/г условно-патогенной факультативно-анаэробной или облигатно-анаэробной микрофлоры. Концентрация в смыве IgA ≤ 10 мкг/мл, sIgA 11–15 мкг/мл, IgM ≤ 10 мкг/мл, sc 10–25 мкг/мл.
Дисбиоз влагалища. Наличие на поверхности эпителиоцитов 50–100 бактериальных клеток, представленных грамположительными палочками, грамположительными кокками и грамотрицательными палочками, при количестве лейкоцитов 20–40 в поле зрения. Наличие ключевых клеток менее 5 в поле зрения (III степень чистоты мазка). Содержание в отделяемом 1–3 lg КОЕ/г лактобацилл, 5–7 lg КОЕ/г условно-патогенной факультативно-анаэробной микрофлоры и 3–4 lg КОЕ/г условно-патогенной облигатно-анаэробной микрофлоры и/или содержание в соскобном материале 3–4 lg КОЕ/г лактобацилл, 3–4 lg КОЕ/г условно-патогенной факультативно-анаэробной микрофлоры и 5–7 lg КОЕ/г условно-патогенной облигатно-анаэробной микрофлоры. Концентрация в смыве IgA 11–15 мкг/мл, sIgA 16–30 мкг/мл, IgM 11–20 мкг/мл, sc 26–50 мкг/мл.
Бактериальный вагинит. Наличие на поверхности эпителиоцитов не менее 100 бактериальных клеток, представленных единичными грамположительными палочками и обильной грамотрицательной и грамположительной палочковой и кокковой флорой, при количестве лейкоцитов не менее 40 в поле зрения. Количество ключевых клеток не менее 5 в поле зрения (IV степень чистоты мазка). Отсутствие в отделяемом лактобацилл. Содержание в отделяемом 5–6 lg КОЕ/г монокультуры условно-патогенной факультативно-анаэробной или облигатно-анаэробной микрофлоры и/или содержание в соскобном материале 1–3 lg КОЕ/г лактобацилл, 6–8 lg КОЕ/г монокультуры условно-патогенной факультативно-анаэробной или облигатно-анаэробной микрофлоры. Концентрация в смыве IgA > 15 мкг/мл, sIgA > 30 мкг/мл, IgM > 20 мкг/мл, sc > 50 мкг/мл.
Оценка выраженности нарушений микробиоценоза цервикального канала
Нормоценоз микробиоценоза цервикального канала. Количество лейкоцитов < 4 в поле зрения. Содержание в соскобном материале 1–2 lg КОЕ/г УПМ. Концентрация в смыве IgG ≤ 8 мкг/г белка, sIgA ≤ 7 мкг/г белка, sc ≤ 8 мкг/г белка.
Промежуточный тип микробиоценоза цервикального канала. Количество лейкоцитов 8–10 в поле зрения. Содержание в соскобном материале 2–3 lg КОЕ/г УПМ. Концентрация в смыве IgG 10–13 мкг/г белка, sIgA 11–14 мкг/г белка, sc 13–19 мкг/г белка.
Дисбиоз микробиоценоза цервикального канала. Количество лейкоцитов 14–40 в поле зрения. Содержание в соскобном материале 3–4 lg КОЕ/г УПМ. Концентрация в смыве IgG 30–40 мкг/г белка, sIgA 20–30 мкг/г белка, sc 30–40 мкг/г белка.
Бактериальный вагинит микробиоценоза цервикального канала. Количество лейкоцитов > 40 в поле зрения. Содержание в соскобном материале > 4 lg КОЕ/г УПМ. Концентрация в смыве IgG > 40 мкг/г белка, sIgA > 30 мкг/г белка, sc > 40 мкг/г белка.
Оценка выраженности нарушений микробиоценоза ротоглотки
Нормоценоз. Микроэкологические нарушения отсутствуют. Наличие индигенной микрофлоры: Streptococcus spp. в количестве 5–6 lg КОЕ/г, Neisseria spp. – 4–6 lg КОЕ/г при концентрации в слюне IgA < 20 мкг/мл, sIgA < 20 мкг/мл, IgM 0 мкг/мл, IgG < 50 мкг/мл, sc < 50 мкг/мл.
Промежуточный тип (I степень дисбиотических нарушений). Характеризуется нарастанием нормофлоры (Streptococcus spp. – до 6–7 lg КОЕ/г, Neisseria spp. – 6–7 lg КОЕ/г) и появлением УПМ в количестве до 3–4 lg КОЕ/г при концентрации в слюне IgA 20–50 мкг/мл, sIgA 20–50 мкг/мл, IgM < 10 мкг/мл, IgG 50–100 мкг/мл, sc 50–100 мкг/мл.
Дисбиоз (II степень дисбиотических нарушений) ротоглотки. Повышение количества нормофлоры (Streptococcus spp. – 6–7 lg КОЕ/г, Neisseria spp. – 6–7 lg КОЕ/г), повышение уровня факультативно-анаэробной УПМ до 4–5 lg КОЕ/мл, появление вирулентных вариантов УПМ, характеризующихся выраженными факторами патогенности, при концентрации в слюне IgA 50–100 мкг/мл, sIgA 50–100 мкг/мл, IgM 10–30 мкг/мл, IgG 100–200 мкг/мл, sc 100–200 мкг/мл.
Выраженный воспалительный процесс (III степень дисбиотических нарушений). Характеризуется значительным повышением содержания Streptococcus spp. – 7–8 lg КОЕ/г, Neisseria spp. – 7–8 lg КОЕ/г, УПМ и количества вирулентных микроорганизмов до 6–8 lg КОЕ/мл при концентрации в слюне IgA > 100 мкг/мл, sIgA > 100 мкг/мл, IgM > 30 мкг/мл, IgG > 200 мкг/мл, sc > 200 мкг/мл.
Оценка выраженности нарушений микробиоценоза кишечника
Нормоценоз. Содержание кишечной палочки ≥ 8 lg КОЕ/г, лактобацилл ≥ 7 lg КОЕ/г, бифидобактерий ≥ 9 lg КОЕ/г, отсутствие УПМ при содержании в копрофильтратах IgA < 10 мкг/мл, sIgA < 10 мкг/мл, IgM 0 мкг/мл, IgG < 10 мкг/мл, sc < 10 мкг/мл.
I степень дисбактериоза кишечника. Характеризуется повышенным или пониженным содержанием кишечной палочки (≥ или ≤ 8 lg КОЕ/г), снижением содержания лактобацилл (≤ 6 lg КОЕ/г) и бифидобактерий (≤ 9 lg КОЕ/г) при содержании в копрофильтратах IgA ≤ 10 мкг/мл, sIgA ≤ 10 мкг/мл, IgM ≤ 5 мкг/мл, IgG 10–20 мкг/мл, sc ≤ 10 мкг/мл.
II степень дисбактериоза кишечника. Характеризуется сниженным содержанием кишечной палочки (≤ 8 lg КОЕ/г), лактобацилл (≤ 6 lg КОЕ/г) и бифидобактерий (≤ 8 lg КОЕ/г), появлением УПМ в количестве ≥ 4 lg КОЕ/г, при содержании в копрофильтратах IgA 10–20 мкг/мл, sIgA 10–20 мкг/мл, IgM 5–10 мкг/мл, IgG 20–40 мкг/мл, sc 10–20 мкг/мл.
III степень дисбактериоза кишечника. Характеризуется значительным снижением содержания кишечной палочки с неизмененными ферментативными свойствами (≤ 6 lg КОЕ/г), появлением слабоферментирующей и/или гемолизирующей кишечной палочки (≥ 4 lg КОЕ/г), значительным содержанием лактозонегативных энтеробактерий, грамотрицательных, глюкозу не ферментирующих бактерий, кокковой флоры (≥ 6 lg КОЕ/г), резким снижением содержания лактобацилл и бифидобактерий – ≤ 5 lg КОЕ/г и ≤ 7 lg КОЕ/г соответственно, при содержании в копрофильтратах IgA > 20 мкг/мл, sIgA > 20 мкг/мл, IgM > 10 мкг/мл, IgG > 40 мкг/мл, sc > 20 мкг/мл.
Заключение
Впервые выявлено, что взаимодействие микробиоценозов слизистых открытых полостей макроорганизма носит динамический характер, обеспечивает жизненно необходимый оптимальный уровень реактивности макроорганизма и его антиинфекционную резистентность. Это подтверждает роль микроорганизмов в обучении защитных систем макроорганизма в процессе онтогенеза. Установлено, что запуск инфекционного процесса невозможен без взаимодействия микроорганизмов биотопов слизистых и возбудителей инфекционных заболеваний с TLR.
Впервые представлен алгоритм функционирования колонизационной резистентности слизистых как интегральной составляющей местной антиинфекционной резистентности и мукозального иммунитета в целом. Благодаря предложенному запатентованному способу оценки колонизационной резистентности слизистых представляется возможным объективно оценивать степень нарушения микробиоценозов. Регистрация показателей уровней TLR, цитокинов и иммуноглобулинов слизистых имеет диагностическое и прогностическое значение, а также позволяет судить об эрадикации патогена.
Microbiocenoses of open cavities and mucosal immunity
S.S. Afanasyev1, V.A. Aleshkin1, Ye.A. Voropayeva1, M.S. Afanasyev2, V.V. Slobodenyuk1, A.V. Karaulov2
1 Gabrichevsky Moscow Research Institute of Epidemiology and Microbiology
2 I.M. Sechenov First Moscow State Medical University
Contact person: Aleksandr Viktorovich Karaulov, drkaraulov@mail.ru
On presentational volume of clinical studies have shown that the interaction of the microbiocenoses of mucous of macroorganism's open cavities is dynamic in nature, provides a vital optimum level of macroorganism reactivity and its anti-infective resistance. Thereby significantly reaffirmed the role of microorganisms in the macroorganism's defense systems training in ontogeny. The interaction of microorganisms of mucous biotopes and pathogens of infectious diseases with TLR is a necessary factor in starting of infection process. For the first time have presented the algorithm of mucosal colonization resistance functioning as an integral part of the local anti-infective resistance and mucosal immunity in general. The proposed patented method for evaluating mucosal colonization resistance can objectively assess the degree of microbiocenoses impairment; it can be regarded as semi-quantitative method of the objective assessment and their mucosal immunity. Recording of TLR, cytokines and mucosal Ig levels has diagnostic and prognostic value, as well as an indicator of pathogen eradication.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.