Молекулярная диагностика – новый диагностический инструмент при назначении АСИТ
- Аннотация
- Статья
- Ссылки
- English
Введение
Сегодня можно с уверенностью сказать, что диагностический арсенал врача-аллерголога пополнился концептуально новым методом – молекулярной диагностикой (МД). В ее основе лежит рутинный способ определения уровня специфических IgE-антител. Но не к цельным аллергенам (экстрактам), а к их множественным белковым составляющим. Компоненты аллергенов могут быть классифицированы как семейства белков исходя из их функций и структуры.
История развития МД в аллергологии насчитывает не одно десятилетие, и только последние годы этот метод с доказанной обоснованностью и информативностью занял прочное место в аллергологическом обследовании.
Основным алгоритмам практического применения МД посвящен ряд литературных обзоров. На практическую значимость метода указал более 16 лет назад профессор R. Valenta в своей первой основополагающей публикации [1].
В настоящее время в распоряжении специалистов имеется международный согласительный документ по молекулярной диагностике WAO/ARIA/GALEN, в котором дано определение метода и изложены основные аспекты его возможного использования. Русский перевод документа опубликован в приложении к «Российскому аллергологическому журналу» и является методическим пособием по МД для клиницистов [2]. Без сомнения, проведение МД позволит оптимизировать назначение аллергенспецифической иммунотерапии (АСИТ).
Как показал анализ мнения лечащих врачей, дополнительные обследования 450 полисенсибилизированных пациентов в рамках эпитопной диагностики позволили в 20% случаев разрешить спорные клинические ситуации [3]. Та же аналогия отмечалась в исследовании, проведенном J. Sastre и соавт., с участием 141 пациента. Примерно 60% больных продемонстрировали совпадение между стандартной и молекулярной диагностикой, что способствовало рациональной коррекции выбора АСИТ у большого числа пациентов [4].
Есть ряд указаний на целесообразность подобной диагностики на этапе анализа нежелательных явлений и уточнения характеристик триггера, вызвавшего определенную реакцию. Так, местные и системные реакции чаще наблюдаются у пациентов с сочетанной сенсибилизацией к Phl p1 + Phl p5 [5].
P. Schmid-Grendelmeier при анализе 737 пациентов с атопией, получавших АСИТ, установил, что наилучшего клинического результата достигли пациенты с истинной сенсибилизацией. У большого процента пациентов с сенсибилизацией в рамках перекрестных реакций на компоненты не зафиксировано удовлетворительного ответа [6, 7].
Выявление спектра сенсибилизации, формулировка диагноза и назначение АСИТ значительно усложняются, если по результатам традиционных методов аллергологического специфического обследования выявляется полисенсибилизация и клинико-анамнестические данные недостаточно информативны.
Согласно статистическим данным, пациенты с моносенсибилизацией встречаются гораздо реже. Во многих ситуациях мультиположительные результаты, полученные при использовании стандартных методик, могут быть связаны с наличием в экстрактах диагностических аллергенов перекрестных молекул (паналлергенов). Профилины, полькальцины и PR-белки часто выявляются в различных экстрактах. Например, у пациента с сенсибилизацией к злаковым травам из-за содержания профилинов и полькальцинов в большинстве пыльцевых экстрактов может иметь место положительная реакция на пыльцу березы [8].
Для практического врача важен безошибочный выбор причинно-значимого лечебного аллергена на основе доказанной истинной или перекрестной сенсибилизации. Сформулированные в большинстве клинических исследований выводы подтверждают, что МД прочно занимает третью позицию в последовательности комплексного аллергологического обследования у пациентов с полисенсибилизацией [2].
Индивидуальная карта с последующим обоснованным и безопасным назначением АСИТ – единственный метод, способный повлиять на причину заболевания. Он идеально вписывается в концепцию персонализированной медицины.
Помимо данных, полученных в крупных когортных исследованиях, необходимо накапливать клинические наблюдения для наглядной демонстрации процесса анализа результатов МД и их практического применения. У практикующего врача сложности, связанные с интерпретацией результатов исследования, могут начаться уже с номенклатуры из-за отсутствия привычных названий экстрактов аллергенов. При расширенном обследовании специалист получает зашифрованный ребус, требующий детального анализа. Некоторые клиники и лаборатории для удобства разрабатывают стандартные наборы тестов, ориентированные на определенные нозологии для внутреннего использования, что позволяет упростить трактовку полученных результатов.
Рассмотрим клинические случаи из нашей практики. Мы постарались проиллюстрировать значимые для рутинной работы аллерголога моменты, касающиеся информативности применения МД в случае назначения АСИТ. При ретроспективном анализе с дополнительным обследованием семи пациентов с развитием системной реакции на фоне проведения АСИТ водно-солевыми аллергенами полыни результаты МД в пяти клинических случаях показали высокий уровень минорных стабильных компонентов полыни w233(nArt v3). Это согласуется с результатами когортных исследований, свидетельствующими о повышенном уровне риска анафилаксии при проведении АСИТ у пациентов с возможной перекрестной сенсибилизацией. Немногочисленные наблюдения косвенно указывают на необходимость определенной настороженности в случае проведения АСИТ при наличии у пациента высоких показателей сенсибилизации к стабильным минорным компонентам.
Клинический случай 1
Пациент А., 48 лет. Обратился с жалобами на эпизодически возникающие в конце июля – августа чихание, слезотечение, зуд в носу. Проявления особенно усиливались во время командировок в южные регионы России. При более детальном опросе выявлен поздний дебют проявлений. Перечисленные симптомы беспокоили пациента в течение нескольких лет. У аллерголога не наблюдался, принимал самостоятельно антигистаминные препараты, интраназальные топические глюкокортикостероиды с положительным эффектом. Последний сезон больного беспокоили присоединившиеся приступы ночного удушья. Круглогодичные симптомы отрицает. Однако при употреблении в пищу орехов на фоне обострения ринита в последний сезон зафиксированы выраженное першение в горле и отечность мягкого неба. Примечательно, что термически обработанные (жареные) орехи подобных симптомов не вызывали. Осенью 2015 г. при скарификационном кожном обследовании выявлена сенсибилизация к пыльце полыни, амброзии и березе в отсутствие сезонных жалоб на ринит и конъюнктивит во время пыления деревьев.
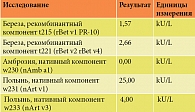
Для уточнения истинного спектра сенсибилизации и решения вопроса о назначении аллергенспецифического лечения было проведено дополнительное обследование с определением специфических IgE к аллергокомпонентам березы, амброзии и полыни на аппарате Phadia 250. Результаты обследования представлены в табл. 1.
Интерпретация результатов:
- менее 0,35 – антитела отсутствуют (класс 0);
- 0,35–0,70 – низкий уровень антител (класс I);
- 0,70–3,50 – умеренный уровень антител (класс II);
- 3,50–17,5 – повышенный уровень антител (класс III);
- 17,5–50,0 – высокий уровень антител (класс IV);
- 50,0–100 – очень высокий уровень антител (класс V);
- более 100 – экстремально высокий уровень антител (класс VI).
Окончательный диагноз: бронхиальная астма, атопическая форма, впервые выявленная. Поллиноз. Пыльцевая аллергия к пыльце полыни. Латентная сенсибилизация к пыльце березы. Перекрестная пищевая аллергия к орехам с клинической картиной орального синдрома.
В данном случае на основании результатов обследования подтверждена истинная сенсибилизация к полыни, что согласуется с клиническими симптомами заболевания. Выявлена латентная сенсибилизация к березе, не требующая лечения из-за отсутствия клинических проявлений. Симптомы пищевой аллергии, видимо, связаны с перекрестной реакцией на пыльцу березы. Этот факт косвенно подтверждается отсутствием реакций на термически обработанный продукт, поскольку истинные аллергены более устойчивы к температурной обработке. У больного целесообразно исключить феномен узнавания, то есть связывания IgE-антител и запуска иммунного ответа к похожим аллергенным молекулам (гомологам). Например, IgE-антитела связываются и реагируют как с Bet v1 пыльцы березы, так и с Cor a1 лесного ореха из-за структурного сходства.
Отрицательный результат на выявление главного компонента амброзии, возможно, также обусловлен потенциальной реализацией положительной кожной реакции на компоненты аллергена и не требует лечения смесью аллергена. Применение монокомпонентного лечения снижает риск различных реакций. Если исследовать ответ на все молекулы, можно получить достаточно репрезентативный IgE-профиль. В данном случае из экономических соображений оценивался главный компонент амброзии, то есть одна молекула. Поэтому характеристика IgE-профиля была менее точной.
Таким образом, описательная точность IgE-профиля определяется тестами, назначенными врачом. Спектр был ограничен ввиду низкой распространенности амброзии в центральном регионе.
Клинический случай 2
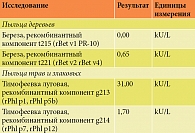
Пациент С., 19 лет. После одного курса АСИТ сублингвальными рекомбинантными аллергенами злаковых трав с ранее подтвержденной кожной чувствительностью к пыльце березы и смеси злаковых трав симптомы ринита и конъюнктивита сохранялись с конца мая по конец июня. Ранее при назначении первого курса АСИТ сенсибилизация к березе была расценена как латентная. Пациент остался недоволен лечебным эффектом. По его оценке, временные границы старта симптомов сдвинулись на более ранние сроки. Юноше было предложено пройти эпитопную диагностику для более детального уточнения спектра сенсибилизации и целесообразности продолжения последующих курсов АСИТ. Кроме того, при сомнительных данных анамнеза следовало уточнить характер сенсибилизации к березе. Результаты обследования представлены в табл. 2.
Интерпретация результатов:
- менее 0,35 – антитела отсутствуют (класс 0);
- 0,35–0,70 – низкий уровень антител (класс I);
- 0,70–3,50 – умеренный уровень антител (класс II);
- 3,50–17,5 – повышенный уровень антител (класс III);
- 17,5–50,0 – высокий уровень антител (класс IV);
- 50,0–100 – очень высокий уровень антител (класс V);
- более 100 – экстремально высокий уровень антител (класс VI).
Была подтверждена истинная сенсибилизация к компонентам rPhl p1 и rPhl p5, на минорные участки rPhl p7 и 12 получен умеренно высокий уровень показателей. Кроме того, был выявлен низкий уровень специфических IgE к rBet v2 и rBet v4 и отрицательный к Bet v1, что исключало истинную сенсибилизацию к березе и целесообразность проведения АСИТ к данному виду сенсибилизации.
Клинические проявления в сезон цветения деревьев могут быть связаны с перекрестными свойствами профилинов Bet v2, Phl p12, а также кальций-связывающих белков Bet v4 и Phl p7, а не с истинной сенсибилизацией к ним. Кожная чувствительность может быть обусловлена именно компонентами экстракта.
Пациенту предложили продолжить лечение рекомбинантным аллергеном злаковых трав. Подготовлены рекомендации, касающиеся элиминационных мероприятий.
Заключение
Вместе с традиционным диагностическим алгоритмом, включая подробный аллергоанамнез, используется ряд методов кожного тестирования, выполняются провокационные тесты и определяются специфические IgE в сыворотке крови. Молекулярная диагностика делает возможным измерение IgE-антител к определенным компонентам структуры аллергена.
По сравнению с другими методами специфического тестирования основной проблемой на пути более масштабного внедрения МД представляется сложная схема интерпретации, которую в каждом случае аллергологу придется решать при получении анализа.
Конечно, преждевременно рассматривать МД как метод, всецело заменяющий традиционное аллергологическое обследование. Скорее МД можно считать высокоинформативным дополнением к индивидуальному подходу в аллергологической практике с целью более точной диагностики, способствующим более точечным терапевтическим и элиминационным назначениям. Например, применение МД в диагностических аллергологических алгоритмах у кандидатов на проведение АСИТ способно решить ряд вопросов, связанных с выбором метода, типа аллергена, риском нежелательных явлений, а также помочь разработать индивидуальную элиминационную схему, что позволит оптимизировать и концептуально поменять подходы к АСИТ [9–11].
Возможности МД не ограничиваются оптимизацией процессов АСИТ. Это активно развивающееся научное направление затрагивает такие аспекты аллергологии, как пищевая и лекарственная аллергия. Свою нишу практического применения метод получил при аллергических заболеваниях кожи, перспективном направлении сенсибилизации к эпидермальным аллергенам. Открываются новые структурные и функциональные особенности различных белков-компонентов, что может сыграть важную роль при оценке риска развития аллергической реакции на разные аллергены.
В будущем использование надежных биомаркеров в диагностике аллергических заболеваний может стать определяющим при рассмотрении иммунотерапии в контексте таргетной персонализированной терапии.
Высокая скорость обновлений и получение актуальных данных по указанному научному направлению требуют от специалистов постоянного совершенствования знаний и владения информацией.
D.S. Fomina, Ye.N. Bobrikova
Russian Medical Academy of Postgraduate Education
Moscow Municipal Clinical Hospital № 52
Contact person: Darya Sergeyevna Fomina, daria_fomina@mail.ru
Molecular diagnostics opens up opportunities for differential detection of genuine and cross reactiveness, which if great clinical importance not only for diagnostics of true sensitization range and justified selection of pathogenetic therapy,
but for forecasting risks related to allergen-based therapy, namely systemic reactions and anaphylactic manifestations.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.