Сепсис и его клинико-диагностические аспекты
- Аннотация
- Статья
- Ссылки
- English

Введение
Первое упоминание о сепсисе как процессе разложения тел различного генеза в присутствии бактерий появилось в повествованиях Гомера около трех тысяч лет назад [1].
Термин «сепсис» (греч. σήψη – гниение), введенный в IV в. до нашей эры, подразумевал поражение организма продуктами разложения и гниения собственных тканей [2]. Впервые в значении, близком к современному пониманию, термин применил Гиппократ около 2000 лет назад.
В процессе перехода от эмпирического опыта к научному методу изучения хирургических инфекций ключевую роль сыграли открытия Луи Пастера – одного из основоположников таких наук, как микробиология и иммунология [3]. Теория о первостепенной роли микроорганизма в развитии инфекционного процесса стала доминирующей.
В настоящее время проблема сепсиса актуальна не только в России, но и в мире вследствие высоких показателей заболеваемости и смертности в отделениях интенсивной терапии и реанимации (ОРИТ) (25–50%) [4]. Кроме того, указанный патологический процесс имеет социально-экономические последствия. Перечислим аргументы, подтверждающие важность обозначенной проблемы:
- диагностика и своевременное лечение затруднены, поскольку сепсис характеризуется симптомами, которые можно интерпретировать как признаки иного заболевания;
- высокая резистентность большого количества людей к различным антибиотикам затрудняет терапию;
- недостаточная информированность населения о симптомах сепсиса влечет за собой позднее обращение за медицинской помощью. При затяжном течении не исключена потеря трудоспособности (инвалидность).
Понятие сепсиса полностью сформировалось лишь в XXI в. [5].
Под сепсисом понимают полиэтиологическую инфекционную болезнь, характеризующуюся развитием воспалительной реакции и дальнейшей генерализацией процесса. Сепсис сопровождается также возникновением токсемии и бактериемии, полиорганным поражением.
Материал и методы
Проанализированы и обобщены актуальные данные о состоянии проблемы диагностики и лечения сепсиса. Поиск соответствующих зарубежных и отечественных научных публикаций осуществляется в электронных базах PubMed, CyberLeninka, Embase, Goоgle Scholar, Medline.
Результаты и обсуждение
Распространенность сепсиса, по крайней мере в индустриализованных странах, составляет от 50 до 110 случаев на 110 тыс. населения в год [6].
Обобщенные результаты исследования EPIC II в отличие от данных девяти российских центров, которые приняли в нем участие, свидетельствуют о более высокой частоте инфекций в нашей стране: 51,9 против 59% [7]. Частота грамотрицательных инфекций в России достигает 74,1%.
По данным исследования, проведенного в Московской клинике факультетской хирургии, частота госпитальных инфекций с развитием синдрома системной воспалительной реакции организма и полиорганной дисфункции составляет 90,4%. При этом инфекционные осложнения приводят к развитию сепсиса в 41,9% случаев, септического шока (СШ) – в 4,5% [8].
Согласно данным исследования РИОРИТ (Распространенность Инфекций в Отделениях Реанимации и Интенсивной Терапии), в рамках регистрационного периода доля пациентов с инфекционными заболеваниями различной локализации и степени тяжести, находившихся в ОРИТ, составила 34,1%. При этом у 21,2% пациентов (6,88% общего числа госпитализированных в ОРИТ с инфекцией) развился СШ. Показано, что распространенность инфекций зависит от типа отделения и профиля госпитализируемых пациентов. Инфекционный процесс чаще наблюдался в отделениях общего профиля и отделениях реанимации для кардиологических больных [9].
Этиология
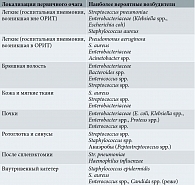
Возбудителями сепсиса могут быть различные патогенные и условно патогенные бактерии. В большинстве крупных многопрофильных медицинских центров преобладают грамотрицательные микроорганизмы. Этиология сепсиса может зависеть от локализации первичного очага (ПО) (табл. 1).
Патогенез
Входными воротами инфекции являются, в частности, рана, катетер, эндотрахеальная трубка. Первичным очагом может быть любой острый или хронический гнойно-воспалительный процесс, например абсцесс, флегмона, фурункул, пневмония, пиелит, ангина. Локализация ПО различна – как на коже и слизистых оболочках, так и во внутренних органах.
Кратковременное присутствие возбудителя в крови (бактериемия) возможно при ряде инфекций, но благодаря защитным механизмам организма кровь быстро очищается. Такое состояние не может рассматриваться как сепсис. Даже длительная бактериемия, например при брюшном тифе или тифоподобной форме сальмонеллеза, неравнозначна сепсису, ведь она подразумевает лишь циркуляцию в крови инфекционного агента [10].
При сепсисе бактериемия сопровождается формированием вторичных очагов инфекции (метастазов). Время их образования, а также локализация не имеют каких-либо закономерностей, то есть сепсис протекает ациклически. Так, при инфекции с ПО на клапанах сердца могут возникнуть метастазы в мозге и почках. Обычно поражаются легкие, почки, кожа, суставы, эндокард, сосуды [11]. В клинико-патогенетическом аспекте данный процесс рассматривается как септикопиемия и характеризуется образованием гнойников.
Если на месте вторичных очагов воспаление не развивается, что свидетельствует об отсутствии не только приобретенного, но и врожденного иммунитета, данный процесс называется септицемией. Для него характерны выраженный токсикоз и отсутствие гнойных метастазов.
Бактериемия при сепсисе всегда сопровождается токсинемией и развитием синдрома интоксикации. В тяжелых случаях может возникнуть СШ (инфекционно-токсический шок).
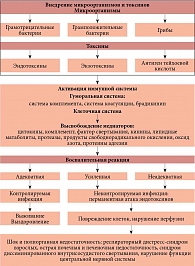
Как правило, сепсис сопровождается нарушением всех видов обмена, гомеостаза, гемостаза, водно-электролитного баланса, а также накоплением токсичных метаболитов в крови, нарушением функции печени и почек [12]. Патогенез представлен на рисунке.
Перечислим основные этапы патогенеза сепсиса:
- выход медиаторов воспаления (Т-лимфоцитов, макрофагов, эндотелиоцитов, тромбоцитов) в ответ на воздействие патогенных микроорганизмов. В этот момент цитокины выполняют защитную функцию на локальном уровне: участвуют в процессах регенерации тканей, активируют другие клетки – эффекторы воспаления и т.д. [13];
- выброс небольшого количества цитокинов в системный кровоток. Цитокины выполняют также защитную функцию, но уже на системном уровне. Наблюдается баланс между провоспалительными (интерлейкин (ИЛ) 1, ИЛ-6, ИЛ-8, фактор некроза опухоли (ФНО)) и противовоспалительными (ИЛ-4, ИЛ-10, ИЛ-14, растворимые рецепторы к ФНО) медиаторами [14];
- генерализация воспалительной реакции. При выраженном воспалении и изменении реактивности макроорганизма цитокины накапливаются в системном кровотоке в чрезмерных количествах. Начинают преобладать их деструктивные эффекты, такие как повреждение эндотелия, запуск диссеминированного внутрисосудистого свертывания крови, моно- и полиорганная дисфункция [15].
Вследствие полиорганной дисфункции печени, почек и кишечника появляются новые повреждающие факторы: лактат, мочевина, билирубин, продукты перекисного окисления липидов, нейромедиаторы, альдегиды и т.д. Эти факторы усиливают деструктивные процессы в организме [16].
Осложнения и причины смерти при сепсисе
При сепсисе самостоятельное излечение исключено. К непосредственным причинам летального исхода могут привести инфекционно-токсический шок, недостаточность одного или нескольких органов (например, почек, легких, сердца), отек головного мозга, синдром диссеминированного внутрисосудистого свертывания крови, анемия, тромбоэмболия сосудов жизненно важных органов [17]. Подобное разделение крайне важно, поскольку на основании этого происходит санация ПО.
По характеру течения сепсис классифицируют на молниеносный, острый, подострый, хронический [1]. Кроме того, сепсис подразделяют на две формы – септикопиемию, вызываемую кокковой флорой и проявляющуюся множеством пиемических очагов, и септицемию, вызываемую грамотрицательной палочковидной флорой, протекающую без гнойных очагов или с их небольшим количеством [18]. Однако не всегда можно четко разграничить эти два варианта.
Согласно современной клинической классификации сепсиса, выделяют:
- синдром системной воспалительной реакции (ССВР), характеризующийся наличием двух или более признаков: температура > 38 °С или < 36 °С, частота сердечных сокращений ≥ 90 в минуту, частота дыхательных движений > 20 в минуту или гипервентиляция (РаСО2 ≤ 32 мм рт. ст.), уровень лейкоцитов крови > 12 × 109/мл, или 10% [19];
- сепсис-синдром системной воспалительной реакции на проникновение в организм микроорганизмов, характеризующийся наличием очага инфекции и двух или более признаков ССВР [20];
- тяжелый сепсис, при котором сепсис сочетается с органной дисфункцией, гипотензией, нарушением тканевой перфузии (повышение концентрации лактата, олигурия, острое нарушение сознания) [21];
- септический шок, представляющий собой сепсис с признаками тканевой и органной гипоперфузии и артериальной гипотонии, не купируемой с помощью инфузий. При данном патофизиологическом процессе применяют катехоламины [22].
Клиническая картина
Если выявлены входные ворота или ПО, инкубационный период составляет 1–5 суток. Отмечаются следующие клинические симптомы: слабость, лихорадка, озноб, интоксикация, анорексия, головная боль, расстройства сознания, тахикардия, артериальная гипотензия, увеличение размеров печени и селезенки, изменения в крови.
Сепсис начинается остро, реже – постепенно.
Для сепсиса характерна атипичная и изнуряющая температурная кривая. В течение нескольких часов температура тела достигает фебрильных значений, наблюдается выраженный озноб, а при снижении температуры – обильное потоотделение [23].
При осмотре кожи и слизистых оболочек выявляются бледность кожных покровов и высыпания на коже. Сыпь может быть пустулезной, геморрагической, возможно наличие петехий [24].
Существует вероятность возникновения сухой гангрены дистальных фаланг на пальцах рук и ног. Возможно образование инфильтратов, флегмон, абсцессов, часто сопровождающихся вялой воспалительной реакцией (септические очаги) [25].
Не исключено появление дистрофических изменений кожи, таких как пролежни. Существует вероятность развития гнойных артритов, при которых суставы становятся отечными, резко болезненными при движении, а кожа над ними приобретает гиперемированный оттенок [26].
Следует отметить, что для сепсиса не характерно вовлечение в патологический процесс лимфатической системы. Возможны развитие септической пневмонии, тромбоэмболического синдрома и поражение клапанов сердца [27].
Диагностика
О сепсисе говорят при наличии ПО инфекции, входных ворот, характерных клинических проявлений, а также вторичных септических очагов [28].
Эти данные подтверждаются выделением возбудителя из образцов, взятых из крови, мочи, ликвора, мокроты, гнойного экссудата и других очагов инфекции.
Посев проводится многократно, до начала антибиотикотерапии. После выделения культуры необходимо определить ее чувствительность к широкому спектру антибактериальных препаратов.
Лабораторные методы включают [29]:
- выделение возбудителя из крови и его посев на питательные среды. Через 4–8 дней оценивают количество выросших колоний микроорганизмов, идентифицируют возбудитель. В ходе посева также определяют чувствительность возбудителя к антибиотикам, что позволяет подобрать адекватную антибактериальную терапию;
- выделение генетического материала возбудителя в крови. Этим методом можно в течение часа определить до 30 различных бактерий и грибов, ставших причиной возникновения сепсиса;
- прокальцитониновый тест позволяет установить уровень прокальцитонина в крови больного (патогномоничный признак развития сепсиса).
На текущий момент основными маркерами сепсиса являются С-реактивный белок (СРБ), ИЛ-6, прокальцитонин (PCT), пресепсин (P-SEP) и новый биологический маркер нейтрофил CD64 [30] (табл. 2).
При постановке диагноза также учитывают изменения в общем и биохимическом анализах крови:
- анемию;
- повышенное содержание лейкоцитов;
- тромбоцитопению;
- повышенное содержание билирубина и остаточного азота;
- сниженный уровень кальция и хлоридов.
Дифференциальная диагностика при сепсисе представляет собой сложный процесс, поскольку необходимо провести разграничение с широким спектром заболеваний, сопровождающихся выраженной и длительной лихорадкой. К ним относятся острые инфекционные заболевания, такие как тифопаратифозные инфекции, бруцеллез, лептоспироз, малярия, риккетсиозы и геморрагические лихорадки. Дифференциальная диагностика также проводится с гнойно-воспалительными заболеваниями: абсцессом, флегмоной, пиелонефритом, холангитом, пневмонией и др. Кроме того, необходимо учитывать такие заболевания, как милиарный туберкулез, неспецифические заболевания соединительной ткани, онкологические заболевания [31].
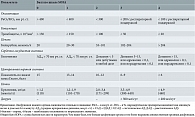
Выраженность органной дисфункции оценивают по шкале SOFA (Sequential Organ Failure Assessment) [32]. Шкала имеет высокую информационную значимость при небольшом количестве параметров. Она позволяет определять в количественном выражении тяжесть органосистемных нарушений и доступна для использования в большинстве отечественных медицинских организаций (табл. 3). В международных документах данная рекомендация получила статус лучшей клинической практики.
Быстрое ухудшение состояния пациента с увеличением значения по шкале SOFA на 2 балла и более свидетельствует о прогрессировании органной дисфункции. В случае известных хронических заболеваний исходный уровень множественной органной дисфункции по шкале SOFA может быть принят за нулевое значение [33].
Лечение
Результаты проведенных исследований указывают на то, что сепсис требует немедленного начала интенсивной терапии. Установлено, что за каждый час задержки перевода из приемного отделения в ОРИТ частота летального исхода увеличивается на 1,4% [34]. Контроль источников инфекции крайне важен именно в первые 6–12 часов.
Выживаемость при сепсисе существенно повышают ранняя адекватная антимикробная терапия, восстановление нормальной клеточной перфузии и своевременный контроль источника инфекции [35].
В клинических рекомендациях Минздрава России 2020 г. обозначены основные моменты в лечении пациентов с сепсисом [36].
Санация источника инфекции
- Необходимо быстро выявить источник инфекции и провести его хирургическую санацию в течение 12 часов с момента постановки диагноза.
- При панкреонекрозе хирургическое вмешательство следует отложить до появления демаркации некротизированных тканей.
- При тяжелом сепсисе следует использовать наименее травматичный метод (например, чрескожную пункцию вместо разреза).
- Если источником сепсиса или СШ является сосудистый доступ, его необходимо ликвидировать немедленно после установки нового.
Антимикробная терапия
- В первый час после постановки диагноза СШ или тяжелого сепсиса без шока должны быть назначены антимикробные препараты внутривенно.
- Стартовая антимикробная терапия проводится 1–3 препаратами, активными против всех предполагаемых возбудителей, проникающих в очаг инфекции.
- Режим антимикробной терапии пересматривается ежедневно для его возможного ослабления.
- Снижение уровня PCT или аналогичных маркеров следует использовать для отмены антибактериальной терапии у пациентов без подтвержденной инфекции.
- Комбинированная эмпирическая терапия необходима пациентам с нейтропенией и тяжелым сепсисом, полирезистентными патогенами и инфекциями, осложненными дыхательной недостаточностью и СШ.
Она не должна назначаться более чем на 3–5 дней, деэскалация проводится после определения чувствительности возбудителя к антибиотику.
- Длительность терапии составляет 7–10 дней. Длительный курс назначается пациентам с медленным улучшением, недренированными очагами инфекции, бактериемией, грибковыми и вирусными инфекциями или иммунодефицитами.
- Антивирусная терапия у пациентов с тяжелым сепсисом или СШ вирусной этиологии должна быть начата как можно быстрее.
- При тяжелых воспалительных заболеваниях неинфекционной природы антимикробные препараты не используются.
Гемодинамическая поддержка и сопутствующая терапия
При тяжелом сепсисе и СШ используется инфузионная терапия:
- кристаллоиды – препараты выбора;
- препараты гидроксиэтилкрахмала использовать не рекомендуется;
- альбумин применяется у пациентов, требующих больших доз кристаллоидов;
- начальная водная нагрузка у пациентов с септической гипоперфузией и подозрением на гиповолемию должна составлять не менее 30 мл/кг кристаллоидов (часть дозы может быть заменена альбумином). В некоторых случаях требуются бóльшие дозы и скорость введения;
- введение кристаллоидов следует продолжать до улучшения гемодинамики: изменения пульсового давления, вариабельности ударного объема, артериального давления и частоты сердечных сокращений.
Вазопрессоры
- Использование вазопрессоров направлено на поддержание среднего уровня артериального давления ≥ 65 мм рт. ст.
- Норэпинефрин – препарат выбора.
- Адреналин может использоваться в качестве второго вазопрессора или замены норадреналина при необходимости.
- Вазопрессин в дозе 0,03 ед/мин может использоваться одновременно с норадреналином для поддержания систолического давления и снижения дозы норадреналина.
- Низкие дозы вазопрессина не рекомендованы в качестве монотерапии гипотензии при сепсисе, а дозы выше 0,03–0,04 ед/мин должны оставаться в резерве для «терапии отчаяния».
- Допамин в качестве альтернативного вазопрессора должен назначаться только пациентам определенных групп (например, с низким риском тахиаритмии, брадикардией).
- Фенилэфрин не рекомендован для лечения, за исключением случаев:
- тахиаритмии, обусловленной приемом норадреналина;
- стойкой гипотензии при высоком сердечном выбросе;
- «терапии отчаяния», когда комбинация инотропов/вазопрессоров и низких доз вазопрессина не позволяет достичь целевых значений среднего артериального давления.
- Использование допамина в низких дозах для защиты почек не рекомендовано в силу неэффективности.
- Для контроля артериального давления всем пациентам, нуждающимся в вазопрессорах, необходимо как можно раньше установить артериальный катетер.
Инотропная терапия
- Добутамин в дозе до 20 мкг/кг/мин может быть назначен или добавлен к вазопрессорам в случае:
- дисфункции миокарда с увеличением давления наполнения и низким сердечным выбросом;
- сохраняющейся гипоперфузии при адекватном внутрисосудистом объеме и нормальном среднем уровне артериального давления.
- Не использовать стратегию увеличения сердечного индекса выше нормальных значений.
Глюкокортикостероиды
- Не использовать гидрокортизон внутривенно для лечения СШ у взрослых, если инфузионная терапия и вазопрессоры способны поддерживать стабильную гемодинамику. При нестабильной гемодинамике возможно использование внутривенного гидрокортизона 200 мг/сут.
- Не применять тест стимуляции адренокортикотропного гормона для оценки потребности в глюкокортикостероидах у взрослых с СШ.
- Постепенно отменять гидрокортизон при отмене вазопрессоров.
- Не назначать глюкокортикостероиды при сепсисе без шока.
- Гидрокортизон применять в виде постоянной инфузии.
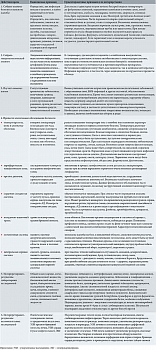
С учетом изложенного алгоритм ведения пациента с сепсисом можно представить следующим образом (табл. 4) [37].
Заключение
Сепсис остается одной из нерешенных проблем современной медицины во всем мире. По оценкам, сепсис является причиной 20% всех летальных исходов в мире. В 2019–2020 гг. было проведено исследование эпидемиологии сепсиса на примере Швеции. По состоянию на 2019 г. зафиксирован 295 531 случай госпитализаций, в 457 из них имели место клинические критерии сепсиса. Заболеваемость сепсисом среди госпитализированных пациентов составила 4,1%, что соответствует 747 пациентам с сепсисом на 100 тыс. человек [38].
Согласно данным исследований, проведенных в ОРИТ Санкт-Петербурга, в 2006–2007 гг. частота встречаемости сепсиса среди пациентов ОРИТ составила 35 случаев на 100 человек, в 2015 г. – 15 случаев [39].
Имеются сложности с сопоставлением данных о сепсисе, тяжелом сепсисе и СШ, а также с оценкой информации о внебольничном и внутрибольничном сепсисе. Расширение знаний об эпидемиологических особенностях сепсиса позволяет менять подходы к диагностике заболевания.
Крайне важна профилактика сепсиса. Среди основных профилактических мероприятий можно выделить повышение осведомленности населения о сепсисе, выявление лиц, подверженных риску развития заболевания, своевременную диагностику, а также лечение сопутствующих заболеваний, способных спровоцировать развитие сепсиса и ухудшить его течение.
Эпидемиологическая ситуация по сепсису продолжает ухудшаться из-за роста числа резистентных к антибиотикам штаммов бактерий, доли грибковых агентов, несвоевременного начала антибактериальной терапии, неблагоприятного состояния здоровья пациентов и других факторов.
Для улучшения качества жизни пациентов важны своевременная диагностика и лечение сепсиса. Лечение хронических инфекционных заболеваний, минимизация управляемых факторов риска, разработка программ скрининга для населения призваны снизить уровень заболеваемости сепсисом и смертности от него в будущем.
Ye.V. Sibirskaya, PhD, Prof., N.A., D.D. Volchek
Russian Children’s Clinical Hospital – a Branch of N.I. Pirogov Russian National Research Medical University
Russian University of Medicine
N.I. Pirogov Russian National Research Medical University
Tula City Clinical Hospital of Emergency Medicine named after D.Ya. Vanykin
Medical Institute of Tula State University
Contact person: Nikita A. Semin, flowwyone@yandex.ru
The article discusses the etiology, pathogenesis, prevalence and diagnosis of sepsis. Special attention is paid to modern methods of treatment: antibacterial and detoxification therapy, correction of water-electrolyte balance, maintenance of hemodynamics. The need for knowledge of algorithms for managing patients with sepsis is emphasized.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.