Наследственные ангиоотеки – принципы диагностики и терапии
- Аннотация
- Статья
- Ссылки

Введение
Ангиоотек (АО) – это результат локального повышения проницаемости подслизистых и подкожных капилляров и венул, клинически характеризуется локализованным внезапно возникающим транзиторным и часто рецидивирующим отеком кожи или слизистых оболочек. Ангиоотек может возникать в сочетании с явлениями крапивницы или протекать в изолированном варианте, не сопровождаясь образованием волдырей и зудом.
В настоящее время в зависимости от классификационного признака ангиоотеки подразделяются следующим образом [4].
I. По клинической характеристике.
1. По течению: острый (до 6 недель) и хронический (более 6 недель).
2. По сочетанию с крапивницей: изолированный и сочетанный.
II. По возможному механизму развития.
1. С преимущественным вовлечением системы комплемента: наследственный и прибретенный.
1.1. Наследственный ангиоотек:
- 1-й тип – абсолютный дефицит С1-ингибитора (изолированный ангиоотек);
- 2-й тип – относительный дефицит С1-ингибитора (изолированный ангиоотек);
- 3-й тип – без дефицита С1-ингибитора (изолированный ангиоотек).
1.2. Приобретенный ангиоотек (приобретенный дефицит С1-ингибитора):
- 1-й тип – абсолютный (изолированный ангиоотек);
- 2-й тип – относительный c образованием аутоантител к С1-ингибитору (изолированный ангиоотек).
2. С участием других механизмов.
2.1. Вызываемый ингибиторами ангиотензин-превращающего фермента (АПФ) (изолированный ангиоотек).
2.2. Обусловленный гиперчувствительностью к лекарственным препаратам, пищевым продуктам, укусам и ужалениям насекомыми (в большинстве случаев сочетается с крапивницей).
2.3. Возникающий на фоне очаговой инфекции (может быть сочетанным).
2.4. Ассоциированный с аутоиммунными заболеваниями (может быть сочетанным).
3. Идиопатический (может быть сочетанным).
Из всего многообразия изолированных АО отдельного внимания заслуживают комплементзависимые ангиоотеки. Комплементзависимые отеки бывают наследственного и приобретенного характера. Для практической медицины наследственный АО (НАО) представляет серьезную проблему в связи с тяжестью обострений и высокой вероятностью развития тяжелых осложнений, которые в некоторых случаях приводят к летальному исходу.
Определение и классификация комплементзависимых ангиоотеков
Наследственный ангиоотек (НАО)
НАО – аутосомно-доминантное хроническое заболевание, относящееся к группе первичных иммунодефицитов, характеризующееся эпизодическим АО любой области тела. Причиной заболевания является снижение функции белка, ингибирующего С1-эстеразу, что приводит к неконтролируемой активации ряда белковых каскадов в сыворотке крови, главным образом классического пути активации комплемента и брадикининового каскада [1].
Наследственный комплементзависимый отек встречается редко и составляет не более 2% от всех случаев АО. В общей популяции распространенность НАО составляет 1:10 000 – 1:150 000 человек. Достоверных данных о распространенности НАО среди населения России нет в связи с низкой выявляемостью данного заболевания и отсутствием достаточной информированности врачей других специальностей об этом заболевании. НАО относят к разряду первичных иммунодефицитов. Больные НАО являются гетерозиготами, то есть имеют один нормальный и один измененный ген, отвечающий за синтез и функционирование С1-ингибитора. Мутация характеризуется аутосомно-доминантным типом наследования, хотя приблизительно 25% случаев НАО обусловлены спонтанной мутацией. Частота мутации гена составляет в среднем 1:100 000. В 2009 г. впервые среди населения РФ описан случай аутосомно-рецессивного наследования НАО, в зарубежной литературе описано лишь два случая подобного типа наследования. Несмотря на единичность этих данных, они существенно расширяют наши представления о типах наследования НАО [2].
Существуют два клинически идентичных типа НАО, определить которые можно лишь при исследовании компонентов комплемента в крови. Различают 2 фенотипических варианта заболевания: НАО 1-го типа и НАО 2-го типа. Некоторые исследователи выделяют 3-й тип НАО – эстрогензависимые отеки, однако до настоящего времени этот тип не выделен как самостоятельная нозологическая единица, так как не имеет четко и единообразно описанной этиологической и патогенетической картины. Отдельные авторы определяют его как наследственные эстрогензависимые ангиоотеки, то есть ангиоотеки, связанные исключительно с влиянием эстрогенов, с предположительным аутосомно-доминантным или Х-сцепленным доминантным типом наследования заболевания. Некоторые исследователи выделяют группу пациентов с рецидивирующими ангиоотеками и семейным анамнезом заболевания, у которых была выявлена локализованная в 5-й хромосоме мутация в гене, кодирующем 12-й фактор свертываемости крови. Наличие указанного генетического дефекта влечет за собой изменение его функциональной активности и, как следствие, нарушение кининового профиля, что приводит к повышению продукции брадикинина [3]. Отличительной особенностью болезни является зависимость симптомов от высокого уровня эстрогенов, соответственно, обострения болезни происходят во время беременности, применения пероральных контрацептивов или заместительной терапии эстрогенами при лечении климактерического синдрома. Первые две формы НАО обусловлены генетически детерминированным абсолютным или относительным дефицитом С1-ингибитора, при третьей его форме концентрация и функция С1-ингибитора не изменены.
НАО 1-го типа встречается у 85% всех пациентов с НАО. Болезнь отличается абсолютным дефицитом С1-ингибитора, при этом уровень С1-ингибитора варьирует в пределах 5–30% от нормальных значений. Дефицит С1-ингибитора обусловлен отсутствием гена, кодирующего С1-ингибитор, или различными его мутациями. Мутация заключается в разнообразных включениях, или делециях, одного или нескольких нуклеотидов в области гена, кодирующего С1-ингибитор. В случае если уровень С1-ингибитора нормальный или повышен, следует тестировать его функциональные характеристики для подтверждения НАО 2-го типа [1].
НАО 2-го типа составляет 15% среди всех типов НАО, отличается снижением функциональной активности С1-ингибитора, хотя уровень С1-ингибитора может оставаться в пределах или быть несколько выше нормы. У пациента вырабатывается нормальное или повышенное количество неправильно функционирующего С1-ингибитора. Нефункционирующий ингибитор не расходуется, накапливается в сыворотке крови и регистрируется в повышенном количестве.
Приобретенный ангиоотек (ПАО)
Помимо генетически детерминированного встречается приобретенный дефицит С1-ингибитора, что выражается приобретенными ангиоотеками (ПАО). ПАО отличается отсутствием у больных отягощенного наследственного анамнеза и поздним началом заболевания (в возрасте 40 лет и старше). Распространенные и редкие причины ПАО могут быть связаны с патологией желудочно-кишечного тракта (ЖКТ), гепатобилиарной системы и поджелудочной железы, системы органов дыхания, сердечно-сосудистой системы, нервной системы, опорно-двигательного аппарата, мочевыделительной системы, половых органов, эндокринного и метаболического генеза. ПАО может возникать при гематологических заболеваниях и иммунодефицитных состояниях, а также при распространенных инфекционных и паразитарных заболеваниях. Так, описаны случаи приобретенных комплементзависимых отеков на фоне ВИЧ-инфекции, множественной миеломы, различных лимфопролиферативных заболеваний, коллагенозов, хронических гепатитов В и С. Нередко приобретенные комплементзависимые отеки манифестируют за несколько лет до развития основного заболевания (табл. 1). Иногда такой АО является первым клиническим проявлением лейкоза [5].
Выделяют 2 типа приобретенных комплементзависимых отеков:
- ПАО 1-го типа связан с повышением катаболизма ингибитора С1 эстеразы при лимфопролиферативных заболеваниях;
- при ПАО 2-го типа происходит продукция IgG- и IgM-аутоантител к ингибитору С1 эстеразы, что приводит к его инактивации.
Развитие ПАО связано с образованием иммунных комплексов при лимфопролиферации, которые в избыточном количестве активируют систему комплемента, приводя к выработке большого количества анафилотоксинов.
Механизмы развития комплементзависимых отеков
Несмотря на прогресс в изучении биохимических маркеров и молекулярных характеристик наследственных отеков, механизмы, лежащие в основе запуска и разрешения атак, остаются неизвестными. Основной механизм отеков при НАО связан с эффектами медиаторов – брадикинина, гистамина, производных арахидоновой кислоты, цитокинов.
При наследственном дефекте системы комплемента нарушается продукция ингибитора С1 эстеразы вследствие мутации гена С1-ингибитора. Уровень С1-ингибитора снижен или он функционально малоактивен, что ограничивает активацию системы комплемента.
При дефиците С1-ингибитора увеличивается содержание калликреина, который, в свою очередь, повышает образование брадикинина. Недостаточность С1-ингибитора приводит к неконтролируемой активации ранних компонентов комплемента, локальный дефицит ингибитора С1 приводит к нарушению регуляции и повышению продукции вазоактивных пептидов. Накапливаясь в избыточном количестве, кинины вызывают расширение и повышение проницаемости сосудов микроциркуляторного русла, интерстициальный отек, набухание коллагеновых волокон, сглаживание сосочков дермы, что клинически проявляется отеком. В настоящее время обсуждается ведущая роль брадикинина в развитии симптомов комплементзависимых отеков. Брадикинин (БК) – это нанопептид, вырабатываемый при активации контактной системы, который может потенциально повышать сосудистую проницаемость путем связывания со своим рецептором (B2-рецептор к брадикинину) на эндотелиальных клетках сосудов. В зависимости от фармакологических свойств выделяют 2 подтипа рецепторов к брадикинину: BKR1 и BKR2 [7]. В настоящее время брадикинин считается ответственным за клинические симптомы ангиоотека, повышая сосудистую проницаемость, вызывая расширение сосудов и сокращение висцеральной гладкой мускулатуры. После воздействия инициирующего фактора недостаточность C1-ингибитора ведет к неадекватной выработке БК и повышению проницаемости сосудов, и выход жидкости в ткани вызывает незудящий отек.
При ПАО на фоне лимфопролиферативных заболеваний образуется большое количество антиидиотипических антител, формируются иммунные комплексы и происходит повышенное потребление С1q-компонента комплемента. В отличие от НАО, где синтез С1-ингибитора имеет дефект, ПАО характеризуется наличием большого числа аутоантител, действующих на молекулы C1q и, следовательно, на С1-ингибитор. Повышенный катаболизм С1q превосходит регуляторные возможности С1-ингибитора, создается относительный дефицит последнего, что приводит к развитию комплементзависимых отеков.
Клиническая картина комплементзависимых отеков
Для всех типов комплементзависимых отеков характерна особая клиническая картина, знание особенностей которой помогает в диагностике данной патологии.
Обычно НАО дебютирует в первые 2 десятилетия жизни, чаще в пубертатный период. У 40% больных заболевание развивается в возрасте до 5 лет (первые признаки НАО могут возникнуть уже в возрасте нескольких месяцев, но чаще после 1–2 лет жизни), у 50% больных – до 12 лет, а у 75% – до 15 лет. Однако необходимо помнить, что частота спонтанных мутаций при НАО составляет 25%, и у этой группы пациентов может отсутствовать семейный анамнез НАО. Несмотря на ранний дебют заболевания, у многих пациентов оно остается нераспознанным на протяжении десятков лет; типичными ошибочными диагнозами являются «аллергический» или «идиопатический ангионевротический отек» и «анафилаксия».
АО провоцируют характерные особые триггеры. Любой из факторов, способных вызвать активацию комплемента по классическому пути, калликреин-кининовой системы или каскада свертывания крови, способствует возрастанию потребности в С1-ингибиторе и является потенциальным триггером обострения: механическая травма, интенсивность которой может быть разной – от легкого сдавления одеждой или легкого ушиба до перелома кости, – хирургическое вмешательство, малоинвазивные диагностические процедуры, экстракция зуба; лекарственные препараты: ингибиторы АПФ, пероральные контрацептивы, содержащие эстроген, препараты гормоно-заместительной терапии; инфекции, стресс, алкоголь [1, 6]. Хронические очаги инфекции, нередко не имеющие ярких клинических проявлений, такие как хеликобактерная инфекция, ассоциированы с более упорным течением НАО. Таким образом, острые приступы НАО возникают как спонтанно, так и под действием триггеров, причем 50% случаев НАО провоцируются травмой и хирургическими вмешательствами, а 30–40% приступов – психоэмоциональным стрессом. Молекулярные механизмы действия триггерных факторов на сегодняшний день изучены недостаточно. Исключение составляет применение ингибиторов АПФ у пациентов с НАО, которое в дальнейшем приводит к повышению уровня БК в тканях и плазме. Таким образом, не удивительно, что пациенты с НАО отвечают на прием ингибиторов АПФ увеличением частоты атак [7].
Для изолированных комплементзависимых АО характерна медленная динамика симптомов: отеки достаточно медленно нарастают в течение 12–36 часов и разрешаются в течение 2–5 дней, а абдоминальные симптомы исчезают в течение 12–24 часов. Пациенты указывают на неэффективность глюкокортикостероидов и антигистаминных препаратов при купировании отеков. Периодичность возникновения отеков может варьировать от еженедельных до 1 раза в год. Интервалы между обострениями у каждого больного индивидуальны: у нелеченых пациентов отеки могут возникать каждые 7–14 дней, также характерны ремиссии заболевания от 7–10 дней до 12 месяцев, возможны непрерывные атаки каждые 3 дня, а также латентное (субклиническое) течение. Данный значительный разброс в тяжести течения заболевания отмечается даже у родственников. Следует отметить, что у некоторых больных АО возникают только после значительной травмы, у других обострения проявляются достаточно часто, вне зависимости от внешних воздействий, на протяжении многих лет.
Клиническая картина НАО характеризуется появлением у больных рецидивирующих плотных безболезненных незудящих отеков, локализующихся практически на любых участках тела: верхних и нижних конечностях (руки, стопы, бедра и др.), на лице (периорбитальная область, губы), полости рта (язык, мягкое небо), туловище, гениталиях, а также подслизистом слое верхних дыхательных путей, желудочно-кишечного и урогенитального трактов. НАО характеризуется следующими особенностями: бледный, очень плотный, имеющий четкую границу со здоровой кожей, захватывающий от 3–4 см в диаметре до больших участков; без гиперемии («холодные отеки»), с чувством «напряжения», «распирания тканей», при надавливании на отек ямки не остается. Для НАО характерны болезненные отеки лица, туловища, конечностей, нередко одной и той же локализации («цикличные отеки»).
Атаки наследственных отеков обычно идут по предсказуемому пути. Многие атаки начинаются с продрома или ауры – обычно дрожь, покалывание, слабость, разбитость, мраморность кожи. Зуд и крапивница для НАО не характерны, однако примерно треть всех случаев АО сопровождается гигантской кольцевидной эритемой (erithema annulare), обильными бледными высыпаниями мультиформного характера, не сопровождающимися зудом, жжением и местной гиперемией.
При поражении верхних дыхательных путей отек обычно располагается выше гортани, захватывая губы, язык и глотку. АО может распространяться на верхние дыхательные пути с вовлечением пищевода, гортани и проявляется дисфагией, дисфонией, симптоматикой обструкции дыхательных путей, напоминающей в ряде случаев бронхиальную астму, и прогрессировать вплоть до асфиксии. Отеки гортани, проявляющиеся осиплостью голоса, афонией, стридорозным дыханием, хотя бы один раз в жизни отмечаются у 50% больных. В тяжелых случаях они приводят к асфиксии и смерти. До 25% больных погибают от отека гортани в возрасте до 30 лет. При вовлечении слизистых оболочек различных органов развивается следующая клиника: пищевода – дисфагия; желудка – тошнота, рвота; кишечника – боли в животе, клиника кишечной непроходимости; мочевого пузыря – дизурия, анурия; мозговых оболочек, внутреннего уха – тошнота, рвота, головокружение, менингеальные симптомы. Более чем у половины больных наблюдаются выраженные абдоминальные отеки, вызванные отеком различных участков слизистой оболочки ЖКТ. Во время абдоминальных отеков кожные симптомы, как правило, остаются или усиливаются. Развитию приступов абдоминальных отеков при НАО часто предшествуют ощущения спазмов в околопупочной области, слабость, тошнота, спастические боли в эпигастрии. Некоторые пациенты предъявляют жалобы на ощущения «отеков внутренних органов». Отек в области абдоминальных органов часто сопровождается выраженным болевым абдоминальным синдромом, тошнотой, рвотой и диареей. Клиническая картина нередко напоминает «острый живот» или кишечную непроходимость. Клинически болевой синдром проявляется в виде разлитой боли в брюшной полости, кишечных колик, возможна тонкокишечная непроходимость. У ряда пациентов наблюдается первичный генез рецидивирующей тонкокишечной непроходимости как forme fruste (приостановление в развитии или скрытое течение заболевания), и только исследование концентрации С4-фракции комплемента позволяет правильно поставить диагноз. Боли в животе бывают настолько интенсивными, что их иногда называют «брюшная мигрень», а сопровождающие болевой симптом общие явления (тахикардия, колебания артериального давления (АД), головокружение, головная боль и др.) – «вегетативная буря». Выброс жидкостей в интерстициальное и перитонеальное пространство во время абдоминальных атак может привести к клинически значимой гипотонии. Необходимо учитывать, что у части пациентов многие годы может наблюдаться клиника только изолированных абдоминалгий, что невероятно затрудняет постановку диагноза у данной категории пациентов. Около 30% больных подвергаются хирургическому вмешательству в связи с подозрением на острую хирургическую патологию. У больных НАО даже описан феномен «географического живота» – результат операций, характеризующийся наличием многочисленных послеоперационных рубцов. Пациентам проводят лапаротомию, обусловленную отеком внутренних органов (аппендэктомию, холецистэктомию, нефрэктомию, гинекологические операции), при операции выявляют ограниченный отек кишечника, признаки асептического воспаления. При ультразвуковом обследовании и компьютерной томографии отмечается отек слизистой оболочки интестинальной стенки, а также свободная жидкость в брюшной полости.
Тяжесть симптомов наследственных отеков очень вариабельна и не коррелирует с плазменным уровнем С1-ингибитора [3, 6]. Другие факторы, такие как полиморфизм рецепторов к БК или вариации уровня или функциональности киназ, по всей вероятности, влияют на тяжесть болезни, но эти факторы не до конца изучены.
Симптомы ПАО развиваются после 4-го десятилетия жизни и нередко на несколько лет опережают другие симптомы субклинически протекающего лимфопролиферативного заболевания. В остальном клиника абсолютно идентична наследственным АО.
Диагностика комплементзависимых отеков
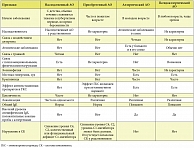
Существуют определенные трудности ранней диагностики НАО, особенно при атипичном течении заболевания. В связи с тем что несвоевременная постановка диагноза НАО обусловливает высокий процент смертности (20–30% пациентов умирают от отека гортани), всем пациентам с изолированными ангиоотеками следует проводить тщательное клиническое обследование, так как отечный синдром встречается не только при НАО, ПАО, но и вследствие других причин. Больным с отеками без симптомов крапивницы и кожного зуда следует уделять особое внимание, так как у них может быть НАО с синдромом недостаточности С1-ингибитора, носящий наследственный характер [5]. Очень важно проводить дифференциальную диагностику НАО с другими типами отеков (табл. 2).
При анализе анамнестических данных следует обратить внимание на семейный анамнез, возраст больного при дебюте заболевания, характерные триггеры, динамику развития отеков. Пациенты, страдающие рецидивирующим абдоминальным синдромом, при котором заболевания ЖКТ не подтверждаются лабораторно-функциональными и диагностическими методами, нуждаются в дополнительном обследовании для исключения патологии системы комплемента. Кроме того, следует обращать внимание на неэффективность традиционной терапии: антигистаминных препаратов, глюкокортикостероидов (эффект слабый или отсутствует), норадреналина, антибиотиков, противопаразитарных препаратов, ферментов. Лабораторное обследование является обязательным для подтверждения диагноза.
Согласно международным рекомендациям [9, 10], выделяют следующие клинические критерии диагноза НАО:
- Большие критерии:
- самостоятельно проходящий невоспалительный ангиоотек без уртикарной сыпи; медленно нарастающий и длящийся более 12 часов;
- спонтанно проходящая боль в животе неясной этиологии; часто рецидивирующая и длящаяся более 6 часов, может сопровождаться яркими диспептическими симптомами;
- рецидивирующий отек гортани.
- Малые критерии:
- семейный анамнез рецидивирующего ангиоотека, и/или болей в животе, и/или отека гортани;
- дебют заболевания в возрасте до 20 лет.
К лабораторным критериям диагноза НАО относят [9, 10]:
- уровни антигена C1-ингибитора эстеразы, составляющие < 50% от нормы (при двух отдельных определениях) у пациента в возрасте более 1 года вне приступа;
- уровни функциональной активности C1-ингибитора эстеразы < 50% от нормы (при двух отдельных определениях) у пациента в возрасте более 1 года вне приступа;
- мутация гена C1-ингибитора эстеразы, приводящая к нарушению синтеза и/или функции соответствующего белка.
Диагноз может быть установлен при наличии одного большого клинического критерия и одного лабораторного критерия.
Для НАО 1-го типа характерен низкий уровень C1-ингибитора, тогда как при НАО 2-го типа уровень C1-ингибитора может сохраняться в норме или даже превышать нормальные значения при низких показателях функциональной активности C1-ингибитора. При снижении компонентов комплемента С8 и С9 возможно более тяжелое течение. У детей исследования уровня компонента комплемента С4 и уровня и функциональной активности С1-ингибитора рекомендуется проводить в возрасте старше 1 года. Определение уровня С4 является основным оправданным по затратам скрининговым тестом при наследственных отеках, хотя в редких случаях компонент комплемента С4 может быть нормальным между атаками. При нормальном уровне С4-фракции вероятность отсутствия НАО у пациента составляет 96% и, как правило, нет необходимости в дальнейших диагностических процедурах. Следует подчеркнуть важность обследования близких родственников больного, так как лица с неустановленным диагнозом НАО в 35% случаев подвержены риску смерти.
Диагностика НАО в педиатрической практике имеет ряд особенностей. Следует помнить, что у детей именно НАО являются главными причинами изолированных ангиоотеков. Функциональная недостаточность C1-ингибитора, как следствие аутоиммунного процесса, у детей встречается крайне редко. Самой большой проблемой на сегодняшний день является поздняя диагностика НАО у детей и подростков. Считается, что у 85% пациентов с НАО первые симптомы дебютируют до 20 лет, но, к сожалению, только у 35% всех пациентов заболевание диагностировано в этом возрасте. Установление клинического диагноза НАО у детей представляет трудности, потому что заболевание может протекать с симптомами, часто встречаемыми в детском возрасте (боль в животе, пастозность конечностей, трудности при глотании, охриплость голоса или острое диспноэ). Даже при наличии семейного анамнеза часто вышеуказанные симптомы не связывают с НАО, и поэтому диагностика заболевания несвоевременна.
При подозрении на приобретенный рецидивирующий АО в каждом случае следует исключить диагноз лимфопролиферативного заболевания, системной красной волчанки, гепатита или других инфекций.
Важным отличием ПАО является низкий уровень С1q-компонента комплемента, поэтому определение С1q имеет существенное значение для дифференциальной диагностики приобретенных и наследственных комплементзависимых отеков. Кроме того, у пациентов с ПАО целесообразно исследование уровня антитела к С1-ингибитору для исключения аутоиммунного механизма ПАО.
Лечение наследственных ангиоотеков
Лечение наследственных изолированных ангиоотеков проводится в соответствии с международными рекомендациями [4, 9, 10].
Текущие рекомендации по лечению НАО предполагают проведение следующих мероприятий:
- первичная профилактика АО;
- долговременная вторичная профилактика АО;
- краткосрочная вторичная профилактика АО;
- лечение острого приступа / неотложное лечение АО.
Первичная профилактика
Предполагает выявление триггерных факторов приступов:
- инфекции (например, Helicobacter pylori);
- эстрогены: контрацептивы и заместительная гормональная терапия;
- лекарственные препараты: ингибиторы АПФ / блокаторы рецепторов AT-1;
- физический и эмоциональный стресс (жара/холод, чрезмерная физическая нагрузка).
Решение о начале лечения должно приниматься в результате сотрудничества пациента и врача.
Длительная профилактика
приступов НАО
Показаниями для назначения профилактической терапии являются:
- более 1 тяжелого приступа НАО в месяц или
- более 1 абдоминального приступа в год или
- отеки в области лица и шеи или
- частые периферические отеки или
- отеки в области гениталий.
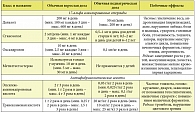
В качестве длительной базисной терапии НАО используют препараты из группы аттенуированных андрогенов, ингибиторов фибринолиза (табл. 3).
У всех пациентов назначенные дозы базисного препарата должны медленно стремиться к наиболее низким, достаточным для контроля заболевания. Основным ориентиром при подборе дозы является клиника заболевания – отсутствие рецидивов. Лабораторные тесты неинформативны и не являются ориентиром для дозирования.
Экстренная профилактика приступов НАО
Оперативные вмешательства, малоинвазивные диагностические процедуры, стоматологические манипуляции могут послужить причиной приступа АО. Вследствие этого больные с НАО нуждаются в специальной подготовке перед оперативными вмешательствами (экстракции зубов, эндоскопические исследования, полостные операции и др.).
В России с целью профилактики рекомендуется назначать даназол из расчета 10 мг/кг/сут (максимальная суточная доза – 600 мг) за 5 дней до и 2 дня после вмешательства, или блокаторы фибринолиза за 48 ч до и 48 ч после вмешательства (аминокапроновая кислота 8–12 г/сут в 3–4 приема перорально или транексамовая кислота 1–3 г/сут в 2–3 приема). При срочных операциях за 1 час до операции или непосредственно перед оперативным вмешательством назначаются инфузии 300–400 мл свежезамороженной плазмы или 200–300 мл 5% раствора эпсилон-аминокапроновой кислоты (транексамовой кислоты) 25 мг/кг/сут в/в капельно.
Лечение острого приступа НАО
При остром приступе НАО необходимо прежде всего увеличить дозу базисной терапии даназолом или эпсилон-аминокапроновой кислоты. В Российской Федерации при лечении приступа НАО применяют свежезамороженную плазму, которая содержит С1-ингибитор, из расчета 10–15 мл/кг/сут. В сравнении с андрогенами свежезамороженная плазма более дорогая и связана с риском инфицирования (гепатит В и С, ВИЧ-инфекции), но в целом считается более эффективной в предотвращении или минимизации атак. Для купирования приступа АО также возможно применение 5% раствора эпсилон-аминокапроновой кислоты, оказывающей антифибринолитическое действие, по 100–200 мл одномоментно внутривенно капельно, а затем по 100 мл внутривенно капельно каждые 4 часа до купирования отека. Лучшей переносимостью обладает транексамовая кислота (25 мг/кг массы тела каждые 3–4 часа внутривенно капельно или через рот). При развитии отека гортани наряду с вышеперечисленными препаратами используются:
- фармакотерапия; госпитализация в ЛОР-отделение;
- интубация, а в тяжелых случаях – трахеотомия;
- оксигенотерапия и охлаждение льдом (применение оксигенотерапии 2–6 л/час с целью достижения более 95%-го насыщения кислородом периферической крови);
- в случае распространенного отека шеи обнаружение трахеи может быть затруднено; может потребоваться неотложная кониотомия.
Прямой осмотр дыхательных путей не рекомендован и нежелателен, если нет возможности немедленного развертывания реанимационных процедур, так как проведение данной процедуры может повлечь за собой резкое ухудшение состояния. При выраженном болевом синдроме у пациентов с абдоминальными отеками необходимо проводить адекватное обезболивание под постоянным наблюдением хирурга, так как длительно существующий отек стенки кишечника может вызвать некроз и потребовать оперативного лечения. Пациенты с сопутствующей гипотензией должны быть госпитализированы и пролечены с агрессивной регидратацией, с целью восстановления сосудистого объема.
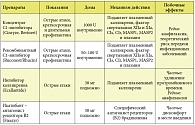
В настоящее время для лечения НАО рекомендованы и применяются на практике в различных странах препараты, представленные в таблице 4 [10].
В России зарегистрирован специфический антагонист рецепторов (В2) брадикинина Фиразир (икатибант), применяющийся для лечения острых приступов НАО. Фиразир – синтетический декапептид с аналогичной БК структурой и одинаковой аффинностью к В2-рецепторам, специфичен к В2-рецепторам и обладает достаточным биологическим периодом полувыведения. Вводится подкожно в острую фазу отека по 3 мл (шприц в комплекте с иглой инъекционной).
Противопоказаниями для применения препарата являются:
- повышенная чувствительность к компонентам препарата (активному веществу и вспомогательным веществам);
- одновременный прием ингибиторов АПФ;
- детский возраст до 18 лет (эффективность и безопасность применения не установлены).
Икатибант рекомендуется применять с осторожностью при сопутствующей ишемической болезни сердца (ИБС), поскольку, учитывая свойства антагониста рецепторов БК 2-го типа, нельзя исключить возможность ухудшения функции миокарда и снижения коронарного кровообращения. Препарат также может снижать положительный нейропротективный эффект БК поздней фазы, хотя отмечен факт положительного влияния блокады рецепторов B2 в острый период нарушения мозгового кровообращения. Следовательно, назначать икатибант пациентам в первые недели инсульта следует только при развитии жизнеугрожающих отеков, под строгим наблюдением врача [8, 9].
Препарат рекомендован для самостоятельного введения пациентами.
На сегодняшний момент проведены основополагающие международные клинические исследования эффективности и безопасности Фиразира. В частности, исследования FAST-1 и -2 были проспективными двойными слепыми рандомизированными многоцентровыми исследованиями III фазы, разработанными для сравнения эффективности и безопасности подкожно применявшегося икатибанта с плацебо (исследование FAST-1) или с применявшейся внутрь транексамовой кислотой (исследование FAST-2) у взрослых пациентов с дефицитом C1-ингибитора. В исследования включались только пациенты с умеренными или очень выраженными приступами НАО 1-го и 2-го типа. Всего в 67 исследовательских центрах по всему миру было рандомизировано 130 пациентов. Основной целью была оценка эффективности икатибанта у пациентов с наследственным ангионевротическим отеком 1-го и 2-го типа, проявляющимся кожными и/или абдоминальными приступами. В данных исследованиях было установлено, что антагонист рецептора B2 брадикинина Фиразир (икатибант) эффективен в лечении всех изучавшихся типов острых приступов. При большинстве (~90%) приступов требовалась только одна инъекция Фиразира для полного разрешения клиники заболевания. По оценке пациентов, Фиразир приводил к первому улучшению симптомов в исследовании FAST-1 через 48 минут (плацебо – через 16,9 часа), а в исследовании FAST-2 – через 48 минут (транексамовая кислота – через 7,9 часа). На фоне лечения Фиразиром открытым методом ларингеальных приступов медиана времени, проходившего до первого уменьшения симптомов, составляла в исследовании FAST-1 0,3–1,2 часа, а в исследовании FAST-2 – 0,3–4,0 часа. За время проведения исследования не отмечалось развития серьезных нежелательных явлений, препарат хорошо переносился. Наиболее частыми побочными реакциями в клинических исследованиях у больных были местные признаки воспаления – покраснение, отек, ощущение боли, жара, жжения, зуд кожи. В целом реакции были слабо выраженными, кратковременными, не требовали дополнительной терапии. Фиразир безусловно является достойным альтернативным вариантом лечения острых приступов НАО, так как характеризуется высокой эффективностью и хорошей переносимостью [8].
Лечение приобретенных ангиоотеков
Основой терапии ПАО является лечение основного заболевания. При приобретенном дефиците С1-ингибитора эстеразы его концентрат и андрогены менее эффективны. У таких больных больший эффект отмечается при использовании препаратов, обладающих антифибринолитической активностью. При аутоиммунном ПАО для снижения продукции аутоантител возможно применение плазмафереза, циклоспорина и другой иммуносупрессивной терапии. Лечение приступа приобретенных АО проводится по тем же принципам, что и при наследственных АО [5].
Вместо заключения
В ноябре 2004 г. во Франции была зарегистрирована Международная организация пациентов с недостаточностью ингибитора C1 (International Patient Organization for C1 Inhibitor Deficiencies, HAEI). Организация оказывает помощь специалистам в области НАО, а также национальным организациям и группам пациентов с НАО по всему миру. Целью международной организации пациентов НАО является облегчение доступа к эффективной диагностике и лечению наследственного ангионевротического отека. 16 мая 2012 г. HAEI объявила Днем НАО, посвятив этому событию вебсайт (www.haeday.org), на котором можно отправить улыбку-картинку всем пациентам и врачам, связанным с НАО, да и вообще всему миру. Все улыбки отображаются на интерактивной карте, и можно видеть, из какой страны и города прислана улыбка. Хочется отметить, что и в Российской Федерации на сегодняшний момент также создана организация пациентов с недостаточностью ингибитора C1. Для повышения качества оказания медицинской помощи данной группе пациентов, в том числе на этапах своевременной диагностики заболевания, необходимо проведение образовательных программ для врачей разных специальностей, в том числе терапевтов, педиатров, хирургов, отоларингологов, реаниматологов.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.