Непереносимость глютена с позиций физиологии пищеварения
- Аннотация
- Статья
- Ссылки
- English



Введение
Непереносимость глютена – белка, который содержится в таких злаках, как пшеница, рожь, ячмень и овес, – может быть обусловлена тремя основными механизмами. Первый и наиболее известный механизм непереносимости глютена ассоциируется с целиакией. Это заболевание, по мнению экспертов Всемирной организации здравоохранения (ВОЗ), является аутоиммунным и характеризуется поражением слизистой оболочки тонкой кишки (СОТК) (Т-клеточно-опосредованная энтеропатия) у генетически предрасположенных лиц [1]. Второй механизм непереносимости глютена связан с атопической формой пищевой аллергии на пшеницу, что может сопровождаться появлением в крови общего и специфических иммуноглобулинов класса Е (IgE) к отдельным белкам злаков. Следует подчеркнуть, что белок пшеницы является одним из наиболее значимых пищевых антигенов [2]. Кроме атопической реакции на белки злаков, в организме может формироваться третий механизм непереносимости, связанный с выработкой антител класса IgG, который называют пищевой гиперчувствительностью. В этом случае в организме помимо кожных очень часто развиваются и кишечные проявления реакции на белки злаков, которые могут сопровождаться метеоризмом, вздутием и болями в животе, а также неустойчивым стулом.
В настоящее время непереносимость глютена, как правило, связывают с целиакией, которую уже не считают редким заболеванием. В западных странах в результате проведенных эпидемиологических исследований целиакию выявляют у 1% населения. В то же время число диагностированных случаев целиакии значительно ниже данного показателя. Например, в Италии с 60-миллионным населением «ожидаемое» количество больных должно составлять 600 тыс. человек. В действительности диагноз установлен не более чем у 100 тыс. пациентов [3]. В Москве, где число жителей превышает 10 млн человек, по расчетам, количество больных целиакией должно составлять не менее 100 тыс. человек. По мнению известного финского патолога Р. Collin, количество жителей Москвы, больных целиакией, достигает 50 тыс. Однако в настоящее время в Москве число детей и взрослых с диагнозом «целиакия» более чем на порядок меньше. Почему из года в год в Москве при диагностике целиакии выявляется ничтожно малое число больных? Может быть, это связано с ошибками диагностики? Или наряду с несколькими сотнями больных, у которых выявлена целиакия, у сотен тысяч она протекает латентно, а еще у десятка тысяч «больных» не исключена «потенциальная целиакия»?
Этиология и патогенез целиакии
Наиболее точное определение целиакии дал в 1996 г. швейцарский врач Л. Бине [4]: «Целиакия, которую также называют глютенчувствительной энтеропатией, определяется как хроническое заболевание, при котором наблюдается характерное, хотя и неспецифическое, поражение слизистой оболочки тонкой кишки, вызывающее нарушение всасывания; при этом восстановление характерного поражения слизистой оболочки наступает при исключении из диеты глиадинов пшеницы, ржи и аналогичных им проламинов ячменя и овса. Заболевание встречается как у детей, так и у взрослых и всегда сопровождается характерными гистологическими изменениями слизистой оболочки, выявляемыми при биопсии. При этом в проксимальных отделах тонкой кишки наблюдается полная атрофия ворсинок (плоская поверхность слизистой), гипертрофия крипт и выраженная инфильтрация собственной пластинки слизистой оболочки лимфоцитами и плазматическими клетками. У большинства пациентов после исключения из диеты глютена происходит восстановление нормальной структуры слизистой оболочки. От пациента к пациенту клиническая симптоматика целиакии варьирует в довольно широких пределах, основополагающим моментом при этом является протяженность участка тонкой кишки, затронутого поражением (атрофией)». Рассмотрим эти положения, которые касаются целиакии, последовательно и более подробно.
Целиакия является хроническим заболеванием, и в его основе лежат генетические факторы, которые до сих пор не обнаружены. И сделать это, очевидно, непросто, поскольку даже среди однояйцевых близнецов, которые несут абсолютно одинаковые гены, целиакия развивается у обоих только в 75% случаев [5]. Следовательно, для возникновения и манифестации заболевания помимо «генов целиакии» и глютена необходим еще один триггер или целый ряд триггеров.
Около 30% популяции являются носителями гетеродимеров DQ2/DQ8 без каких-либо клинических и морфологических признаков целиакии, а среди носителей данных аллелей число больных целиакией составляет около 1%.
При целиакии наблюдается характерное, хотя и неспецифическое поражение СОТК. Характерными особенностями поражения СОТК у больных с нелеченой целиакией являются: полная атрофия (или субатрофия) ворсинок, гипертрофия крипт и выраженная инфильтрация собственной пластинки слизистой оболочки лимфоцитами и плазматическими клетками. При этом в составе кишечного эпителия значительно увеличивается число межэпителиальных лимфоцитов (МЭЛ), которое, как правило, превышает 40% и может достигать 100% и более. Из этого определения следует важный вывод о том, что патогенез больных с нелеченой целиакией всегда сопровождается характерными гистологическими изменениями СОТК. Отсутствие атрофических изменений свидетельствует об отсутствии целиакии. Именно поэтому гистологические исследования до сих пор являются «золотым стандартом» диагностики целиакии, несмотря на то что на протяжении многих лет врачи продолжают искать более простой и менее инвазивный метод диагностики этого заболевания.
Критерии диагностики
В 1992 г. M.N. Marsh [6] разработал классификацию, в основе которой лежат три основных критерия целиакии: атрофия ворсинок, гипертрофия крипт и повышенное число МЭЛ. В 1999 г. G. Oberhuber модифицировал эту классификацию [7]. Поставить диагноз «целиакия», опираясь на эти морфологические критерии и классификацию по Marsh – Oberhuber, не составляет особого труда, однако, пересматривая гистологические препараты, где патоморфологами на основании классификации по Marsh уверенно поставлен диагноз «целиакия», мы отмечали значительное число ошибок, которые, как правило, ведут к гипердиагностике этого заболевания. В чем причина ошибок при использовании трех простых морфологических критериев и почему морфологическая диагностика целиакии продолжает зависеть от мастерства патолога? На чем основано утверждение P. Collin о том, что «если при диагностике целиакии патолог говорит вам, что гистология отрицательная, то я бы предпочел не верить патологу»?
Во-первых, классификация целиакии по Marsh основана не на количественной, а на качественной оценке структуры СОТК, которая субъективна по определению. Это обусловливает, прежде всего, появление ошибок при качественной оценке атрофических изменений в СОТК. Морфолог и врач могут воспринимать понятия «легкое уплощение ворсинок» или «атрофия ворсинок» по-своему, а слово «атрофия» при морфологическом исследовании СОТК может подтолкнуть врача к постановке диагноза «целиакия», в том числе и в тех случаях, когда ее нет. Во-вторых, выделив всего 4 типа строения СОТК, M.N. Marsh не указал, где же проходит граница между понятиями «нормальная архитектура ворсинок» и «атрофия ворсинок», «нормальная глубина крипт» и «гипертрофия крипт». В этом случае необходимо проведение морфометрии, что затруднительно, так как подавляющее большинство гистологических препаратов должным образом не ориентированы. Это является гистологическим браком и третьей причиной возникновения ошибок при морфологической диагностике. В-четвертых, проведение морфометрии не гарантирует отсутствие ошибок, в случае если измеренные морфологические показатели высоты ворсинок, глубины крипт, числа МЭЛ не соотнесены с нормой.
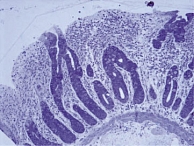
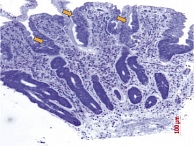
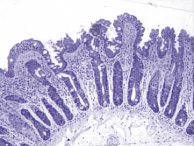
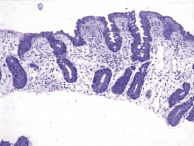
Еще одна причина появления морфологических ошибок связана с неверной интерпретацией классификации целиакии по Marsh. M.N. Marsh, рассматривая типы строения СОТК, только 3-й (деструктивный) тип относил к нелеченой целиакии. При этом тип 3с (тотальное уплощение ворсинок – плоская слизистая) соответствует высоте ворсинок 50–100 мкм (рис. 1), а тип 3b (выраженное уплощение ворсинок) – 100–200 мкм (рис. 2). Легкое уплощение ворсинок (200–250 мкм) при нелеченой целиакии встречается крайне редко (рис. 3). В классификации целиакии по Oberhuber 1-й и 2-й типы строения СОТК представлены как стадии целиакии. Формально это соответствует действительности, поскольку после появления в диете ребенка продуктов, содержащих глютен, происходит трансформация СОТК: уменьшается высота ворсинок, увеличивается глубина крипт, в составе эпителия растет число МЭЛ. Эти изменения в СОТК происходят очень быстро, и при развитии клинической картины заболевания в СОТК, как правило, уже сформирована полная атрофия или субатрофия ворсинок. Впервые полную атрофию ворсинок с высоким уровнем МЭЛ можно наблюдать у детей в возрасте 5–9 месяцев, то есть спустя 3–4 месяца после включения в диету глютена. Поэтому говорить о том, что 1-й или 2-й тип СОТК по Marsh являются 1-й и 2-й стадией целиакии, неправомерно, поскольку характерной для нелеченой целиакии атрофии ворсинок в этом случае не наблюдается. А если нет атрофии, то нет и нозологической формы – целиакии. Потенциальная целиакия может рассматриваться как гипотеза, которую необходимо доказывать в каждом конкретном случае, и ставить диагноз болезни, которая еще не наступила, в этом случае неверно.
Таким образом, при морфологической диагностике целиакии, во избежание ошибок, необходимо соблюдать три основных принципа [8, 9]:
- правильно ориентировать гистологические препараты;
- проводить морфометрию;
- сопоставлять полученные данные с нормой.
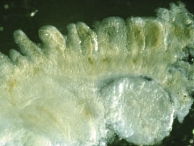
Для объективного выявления атрофии ворсинок рекомендовано просматривать биоптаты под стереомикроскопом [7], то есть проводить микроанатомическое исследование [10]. Нередко обнаружить полную атрофию ворсинок можно лишь при трехмерном микроанатомическом исследовании биоптата (рис. 4), тогда как при двухмерном гистологическом исследовании того же биоптата можно наблюдать наличие коротких ворсинок (рис. 5). Во избежание ошибок при использовании классификации целиакии по Marsh мы ввели в нее значения морфометрии, связав их с морфологическими показателями (табл. 1).
Атрофические изменения, которые мы наблюдаем у больных с нелеченой целиакией, характерны для этого заболевания, но не специфичны только для целиакии. Полную атрофию (50–75 мкм) или субатрофию кишечных ворсинок (125–140 мкм) и гипертрофию крипт (250–350 мкм) мы находили у некоторых детей с врожденной патологией органов пищеварения в возрасте 2–48 дней, а также у детей более старшего возраста (3–5 месяцев), которые еще не получали с питанием глютена. Отличительной морфологической чертой атрофической энтеропатии у таких больных является очень низкое число МЭЛ – 1–10%. Считают, что атрофические изменения в СОТК, сходные с таковыми при целиакии, могут развиваться у больных аутоиммунной энтеропатией (рис. 6).
Восстановление нормальной структуры СОТК у большинства пациентов после исключения из диеты глютена может свидетельствовать о том, что атрофия ворсинок при целиакии не только отражает патологический характер поражения слизистой оболочки, но и является адаптационной перестройкой СОТК, которая направлена на ограничение всасывания токсических для организма пептидов глютена. Целиакия представляет собой крайний вариант такой адаптации, когда кишечный эпителий практически полностью уходит в закрытую от внешних воздействий криптальную зону СОТК. При этом площадь люминальной (ориентированной в просвет кишки) поверхности эпителия сокращается до минимума. Вследствие этого на значительно уменьшенной внешней поверхности эпителия существенно возрастает плотность иммунного контроля, что позволяет более эффективно связывать пищевые антигены и ограничивать их проникновение во внутреннюю среду. Однако в результате происходит снижение всасывания необходимых организму пищевых веществ. Вполне закономерно, что после исключения из диеты глиадина происходит восстановление нормальной архитектуры СОТК, что выражается в увеличении высоты ворсинок и уменьшении глубины крипт, при этом восстанавливается функция всасывания. Одновременно уменьшается плотность инфильтрации эпителия и собственной пластинки лимфоцитами и плазматическими клетками.
Восстановление нормальной структуры СОТК происходит у большинства, но не у всех больных целиакией. У части больных могут наблюдаться те или иные отклонения структуры СОТК от нормальной, у многих пациентов в СОТК сохраняется повышенное содержание лимфоцитов и плазматических клеток, что может быть связано с реакцией не только на глютен, но и на другие пищевые антигены. Сохранение гипотрофии СОТК (толщина слизистой оболочки менее 500 мкм), небольшого увеличения глубины крипт (более 200 мкм) и повышенного числа МЭЛ (свыше 30%) у части больных целиакией в период клинической ремиссии может быть связано с нарушением строгой безглютеновой диеты. Для установления этого необходимо проведение серологических тестов, морфологического исследования СОТК с использованием морфометрии и тщательный контроль питания больного. Среди детей с целиакией в период клинической ремиссии строго соблюдают безглютеновую диету менее половины, к тому же в питании больных может присутствовать «скрытый» глютен.
Врачам, которые неоднократно сталкивались с целиакией, хорошо известно, что клиническая симптоматика целиакии варьирует в довольно широких пределах. В чем причина вариабельности клинической картины у разных больных целиакией? При целиакии у детей важную роль играет количество глютена, которое получает ребенок, а также продолжительность употребления продуктов, содержащих глютен. При поздней диагностике целиакии эти факторы большого значения не имеют, за исключением тех случаев, когда ребенок сам отказывается употреблять хлеб и другие злаки или когда его питание по своему характеру является низкоглиадиновым. В настоящее время, в связи с осведомленностью многих родителей о целиакии и все более широким использованием в питании детей раннего возраста безглютеновых продуктов, при ранней диагностике целиакии крайне важной является точная оценка качества, количества и продолжительности поступления глютена. Во избежание случаев постановки диагноза «целиакия» детям раннего возраста, которые могли или не получать глютен, или получать его в количестве крайне малом, чтобы спровоцировать развитие атрофии ворсинок или выраженный иммунный ответ, важно учитывать следующий принцип диагностики целиакии: нет глютена – нет атрофической энтеропатии.
Основополагающим моментом вариабельности клинических проявлений целиакии является протяженность участка тонкой кишки, который затронут атрофией. Двенадцатиперстная кишка (ДПК) и тощая кишка несут основную пищеварительную нагрузку, здесь практически полностью завершается переваривание и всасывание основной массы экзогенных пищевых субстратов. Поэтому атрофия именно этих отделов тонкой кишки при целиакии может приводить к существенному, хотя и не фатальному нарушению пищеварения и всасывания. В случае атрофии ворсинок начального отдела тонкой кишки повышенная пищеварительная нагрузка ложится на медиальный и дистальный отделы тонкой кишки, которые в меньшей степени подвергаются токсическому действию глютена и могут сохранять нормальную структуру ворсинок.
При «ступенчатой» биопсии участков тощей кишки и ДПК мы достаточно часто отмечаем уменьшение степени выраженности атрофии ворсинок в дистальном направлении, что может быть связано с проксимально-дистальным градиентом токсического действия глютена. И если в ДПК, как правило, имеется полная атрофия ворсинок, то в области связки Трейтца выявляется субатрофия. В ряде случаев при обследовании подвздошной кишки у больных целиакией в ней обнаруживаются нормальные ворсинки.
При морфологической диагностике целиакии важно, из какого участка тощей кишки и ДПК взят биоптат. Согласно рекомендации Л. Бине [4], биопсию следует брать из области перехода ДПК в тощую кишку (область связки Трейтца), где поражения слизистой оболочки выявляются как при умеренно выраженных, так и при выраженных вариантах атрофии ворсинок. В настоящее время рекомендуется брать до 4 биопсийных образцов и только из ДПК, один забор должен осуществляться из луковицы ДПК. С нашей точки зрения, брать биопсию из луковицы ДПК категорически нельзя, так как в луковице атрофические изменения часто развиваются при гиперсекреции соляной кислоты в желудке. Оптимальным при диагностике целиакии является исследование СОТК из двух участков: ДПК в области фатерова соска и тощей кишки в области связки Трейтца.
Степень выраженности синдрома мальабсорбции и увеличение клинической тяжести целиакии нарастают, если на фоне атрофии ворсинок возникают повреждения эпителиальных клеток или другие морфофункциональные изменения СОТК. В этом случае функция всасывания нарушается в еще большей степени, поскольку наряду с атрофией ворсинок может разрушаться поверхностный эпителий на всем протяжении тонкой кишки. У детей с целиакией может наблюдаться острая клиническая манифестация заболевания, например спровоцированная токсикоинфекцией или вирусным энтеритом. Это является дополнительным толчком, который выводит СОТК из состояния равновесия. Очевидно, что во многих случаях атрофия ворсинок, которая затрагивает только начальный отдел тонкой кишки, не влечет за собой заметного нарушения функции всасывания и не вызывает выраженных клинических проявлений целиакии. Именно у таких больных наблюдается скрытое или атипичное течение заболевания на фоне атрофии ворсинок в начальном отделе тонкой кишки. Если такие больные попадают в поле зрения гастроэнтеролога и у них берут биопсию из тонкой кишки, то неожиданно обнаруживается характерная для целиакии атрофическая энтеропатия.
В патогенезе целиакии участвуют и другие звенья системы пищеварения – желудок, поджелудочная железа, кишечные ферменты. У больных целиакией часто обнаруживают увеличение размеров поджелудочной железы или снижение активности кишечных ферментов, в первую очередь лактазы, что может приводить к лактазной недостаточности и непереносимости молока.
Необходимо ли при целиакии проводить морфологическое исследование слизистой оболочки желудка? По нашим данным, у половины детей с нелеченой целиакией имеется гипотрофия желез тела желудка, что вызывает снижение пищеварительной функции желудка, уменьшение расщепления желудком глютена и осложняет патогенез целиакии. У 80% детей с нелеченой целиакией мы отмечаем повышенную инфильтрацию собственной пластинки плазматическими клетками и увеличение числа МЭЛ, что может свидетельствовать о чувствительности слизистой оболочки желудка к действию глютена. Но более серьезные морфологические изменения можно наблюдать в слизистой оболочке тела желудка у больных целиакией в период ремиссии: гипертрофию желез, что увеличивает риск развития эрозивно-язвенного поражения, или гиперплазию слизистого эпителия с появлением атипичных клеток, что является фактором риска развития онкологии [11]. Причем все эти изменения не определяются при эндоскопическом обследовании желудка.
Согласно утверждению R. Logan [12], «целиакия подобна айсбергу – существует гораздо больше недиагностированных случаев целиакии, чем диагностированных». Однако в настоящее время «айсберг Логана» перевернулся – все чаще наблюдается гипердиагностика целиакии, когда у больных, которым был поставлен диагноз «целиакия», в действительности не имеется этого заболевания. Мы проанализировали статистику морфологической диагностики целиакии, проведенной в НИИ питания РАМН за 7 лет (табл. 2).
Из общего количества детей, у которых имеются клинические признаки непереносимости белка злаковых, только у 20% обнаружили целиакию, у 8% диагноз «целиакия» из-за поздней морфологической диагностики не мог быть достоверно подтвержден. Однако у большего числа детей (72%) он был снят, несмотря на то что многие из них уже начали получать безглютеновую диету. У большинства этих детей при проведении серологического теста на целиакию, как правило, были повышены титры антиглиадиновых антител (АГА) класса IgG. Таким образом, на одного больного целиакией приходится в 4 раза больше детей, у которых имеются похожие клинические симптомы целиакии, а у многих и повышенные титры антител к глиадину. Согласно статистике, связанной с пересмотром результатов морфологической диагностики целиакии, подтвержденных при морфологическом исследовании биоптатов, число диагностических ошибок достигало 67%, что объясняет ошеломляющие цифры «эпидемиологии целиакии».
Существует еще два механизма чувствительности к глютену, обусловленных пищевой аллергией и пищевой непереносимостью. В последнее время клинические реакции на глютен, связанные с гиперчувствительностью к глютену (gluten sensitivity – GS), все больше привлекают внимание врачей. Анализ статистики серологической диагностики у детей с подозрением на целиакию показал, что почти у 2/3 из них были обнаружены высокие титры антител к белкам пшеницы и другим пищевым белкам; у 65% – повышенные титры антител класса IgG и IgG4 к белку пшеницы; у 6,2% – повышенные титры общего IgE (у половины детей находили специфические IgE-антитела к белкам пшеницы) (табл. 3).
Непереносимость глютена у детей и взрослых пациентов не следует сводить только к целиакии. Гораздо большее значение имеет непереносимость белка злаков, связанная с гиперчувствительностью к глютену (GS). По нашим оценкам, общее количество таких больных может превышать число больных целиакией в несколько раз. Для диагностики целиакии достаточно, как правило, провести качественное гистологическое исследование СОТК с выявлением характерных для этого заболевания признаков атрофической энтеропатии.
В случае если у больного с клиническими признаками гиперчувствительности к глютену получены отрицательные результаты морфологического исследования СОТК, необходимо проведение серологической диагностики с определением, в первую очередь, АГА. Исключение АГА из стандартов диагностики целиакии является ошибкой. Более того, при диагностике целиакии с целью выявления сопутствующей или независимой от целиакии пищевой аллергии или пищевой гиперчувствительности к глютену необходимо определять комплекс антител к белкам злаков: IgG-АГА, специфические IgЕ- и IgG4-антитела к белкам пшеницы, ржи, ячменя и овса, а также антитела класса IgG к тканевой трансглутаминазе (IgG-тТГ). В случае клинических проявлений реакции на другие пищевые белки следует определять общий IgЕ, а также специфические IgЕ- и IgG-антитела к наиболее значимым пищевым антигенам, последовательно расширяя список антител к новым пищевым антигенам по мере необходимости. Ключевое значение для оценки клинической значимости реакций на пищу имеет не столько титр IgЕ- и IgG-антител к тем или иным пищевым белкам, сколько выраженность клинических проявлений (кожных, кишечных или респираторных) чувствительности к этим пищевым антигенам.
Индивидуальная диета
Все больные с диагностированной непереносимостью глютена нуждаются в строгой безглютеновой диете: больные целиакией – в пожизненной, у больных с пищевой аллергией или с гиперчувствительностью к глютену длительность безглютеновой диеты может быть ограничена. Однако назначение больным целиакией только безглютеновой диеты не решает проблемы адекватности питания и в большом количестве случаев не приводит к устойчивой клинической ремиссии, создавая видимость «рефрактерной» целиакии. Это обусловлено тем, что помимо глютена больные могут реагировать, например, на белки риса, гречи, коровьего молока и др. Еще более сложная ситуация возникает при назначении безглютеновой диеты больным с пищевой аллергией или гиперчувствительностью к глютену, у которых имеется поливалентная пищевая аллергия. Поэтому безглютеновая диета для больных с целиакией, пищевой аллергией или гиперчувствительностью к глютену является необходимым, но недостаточным условием адекватного питания.
У большинства больных с непереносимостью глютена разного генеза можно наблюдать непереносимость и других белков пищи, что связано с выработкой специфических IgE- и/или IgG-антител. По нашим данным, среди нелеченых больных целиакией высокие титры IgG-антител к глютену имели почти 100% больных, к белкам коровьего молока – 64,5%, к овальбумину – 16,7%, к рису – 81%, высокие титры антител к белкам сои, гречи, кукурузы, картофеля и других культур выявляли у 4–25% детей. У детей с аллергической энтеропатией высокие титры IgG-антител к глютену и белкам коровьего молока находили в 37% случаев, к овальбумину – в 48%, к рису – в 40,7% [13]. Поэтому всем этим больным требуются не только безглютеновые продукты, но и безлактозные, не содержащие молока, свободные от белка куриного яйца, сои и ряда других продуктов, содержащих пищевые аллергены.
Для питания детей раннего возраста многие производители детского питания предлагают широкий выбор продуктов, не содержащих глютена и имеющих соответствующую маркировку. Ассортимент безглютеновых продуктов, предлагаемых российскими и зарубежными производителями для детей старшего возраста и взрослых, недостаточен. В этой связи заслуживает внимания появление на российском рынке безглютеновых продуктов известного французского производителя – концерна Lactalis. Особенность линейки безглютеновых продуктов этой компании, выпускаемой под маркой Valpiform, заключается в том, что наряду с глютеном из них удалены и другие пищевые аллергены: белки коровьего молока, сои, орехов и ряд других, на которые часто возникает аллергическая реакция, а также лактоза, непереносимость которой часто встречается при целиакии и пищевой аллергии. Эти пищевые белки наряду с глютеном также могут представлять опасность для больных целиакией и с гиперчувствительностью к глютену. Дифференцированный подход к питанию, который возможен благодаря продукции компании Lactalis, позволяет формировать индивидуальную диету, более всего соответствующую потребности каждого конкретного больного. Врачи и больные должны точно знать не только перечень, но и количество потенциально опасных пищевых антигенов и других пищевых ингредиентов, которые входят в состав каждого лечебного продукта.
Yu.A. Lysikov
Institute of nutrition of Russian Academy of medical Sciences, Moscow
Contact person: Yury Alexandrovich Lysikov, yl20@mail.ru
The article addresses etiology, pathogenesis and diagnosis of the gluten intolerance disorders frequently associated with coeliac disease, or gluten-sensitive enteropathy. The mechanisms of gluten intolerance include atopic alimentary wheat allergy and food hyper-sensitivity.
Key words: small intestinal mucosa, intraepithelial lymphocytes, morphologic diagnosis of celiac disease, antigliadin antibody titers, gluten hypersensitivity
