Оценка эффективности повторного использования ингибиторов тирозинкиназ в лечении BRAF-мутированной диссеминированной меланомы кожи
- Аннотация
- Статья
- Ссылки
- English
Исследования последних лет показали, что для достижения положительных результатов лечения пациентов с мутацией в гене BRAF необходимо воздействовать на несколько точек с нарушенной регуляцией сигнального пути. Ингибиторы MEK (кобиметиниб, траметиниб) являются компаньонами ингибиторов BRAF и работают в комбинации с ними, обеспечивая синергический эффект и минимизируя развитие резистентности. Комбинация ИТК BRAF и MEK привела к высокой частоте объективного ответа (ЧОО), контролю симптомов и увеличению продолжительности жизни. Однако, несмотря на огромные достижения последних лет в терапии меланомы, которые несомненно привели к увеличению продолжительности жизни и контролю симптомов заболевания, рано или поздно возникает резистентность к проводимому лечению, а значит, перед врачом встает вопрос о выборе последующей линии лечения в случае использования всех терапевтических опций. В связи с этим высоко актуальным является изучение возможности возвращения к ранее проведенной противоопухолевой терапии. В представленном исследовании проведен промежуточный анализ эффективности повторного назначения ингибиторов BRAF и MEK больным с диссеминированной BRAF-мутированной меланомой кожи.
Анализ использования ИКТ основан на сборе данных о 120 пациентах с диссеминированной BRAF-мутированной меланомой кожи, которые получали лечение в клиниках Санкт-Петербургского городского клинического онкологического диспансера (n = 110) и в клинике «Скандинавия» (n = 10) в период с февраля 2020 г. по июнь 2024 г. Выполнено непрямое сравнение двух групп: группы пациентов c повторным использованием ИТК (n = 54; 45%) и группы пациентов с однократным использованием ИТК (n = 66; 55%). Повторное использование оценивалось как ретритмент – использование препаратов того же терапевтического класса при прогрессировании/рецидиве заболевания через шесть и более месяцев после завершения адъювантной терапии или речеллендж – повторное использование препаратов того же терапевтического класса у леченных больных по поводу метастатической стадии заболевания с регистрацией ранее клинического улучшения или объективного ответа.
Результаты. При оценке эффективности ИТК в группе однократного использования препаратов ЧОО составила 53% (31,8% – частичный регресс, 21,2% – полный ответ), стабилизация заболевания – 40,9%. В целом частота контроля над заболеванием (ЧКЗ) в этой группе составила 93,9%. В группе повторного проведения ИТК ЧОО составила 14,8% (частичный регресс – 9,3%, полный ответ – 5,6%), стабилизация процесса – 62,9%, ЧКЗ – 77,7%. Медиана выживаемости до прогрессирования (мВДП) в группе речелленджа составила семь месяцев (95%-ный доверительный интервал (ДИ) 5–35 мес.), в то время как мВДП в группе ретритмента достигнута не была. Медиана общей выживаемости (мОВ) в группе однократного проведения таргетной терапии (ТТ) составила 48 месяцев (95% ДИ 30,48–65,5 мес.), а в группе повторного проведения ТТ мОВ составила 55 месяцев (95% ДИ 39,9–70,07 мес.), р value = 0,449.
Исследования последних лет показали, что для достижения положительных результатов лечения пациентов с мутацией в гене BRAF необходимо воздействовать на несколько точек с нарушенной регуляцией сигнального пути. Ингибиторы MEK (кобиметиниб, траметиниб) являются компаньонами ингибиторов BRAF и работают в комбинации с ними, обеспечивая синергический эффект и минимизируя развитие резистентности. Комбинация ИТК BRAF и MEK привела к высокой частоте объективного ответа (ЧОО), контролю симптомов и увеличению продолжительности жизни. Однако, несмотря на огромные достижения последних лет в терапии меланомы, которые несомненно привели к увеличению продолжительности жизни и контролю симптомов заболевания, рано или поздно возникает резистентность к проводимому лечению, а значит, перед врачом встает вопрос о выборе последующей линии лечения в случае использования всех терапевтических опций. В связи с этим высоко актуальным является изучение возможности возвращения к ранее проведенной противоопухолевой терапии. В представленном исследовании проведен промежуточный анализ эффективности повторного назначения ингибиторов BRAF и MEK больным с диссеминированной BRAF-мутированной меланомой кожи.
Анализ использования ИКТ основан на сборе данных о 120 пациентах с диссеминированной BRAF-мутированной меланомой кожи, которые получали лечение в клиниках Санкт-Петербургского городского клинического онкологического диспансера (n = 110) и в клинике «Скандинавия» (n = 10) в период с февраля 2020 г. по июнь 2024 г. Выполнено непрямое сравнение двух групп: группы пациентов c повторным использованием ИТК (n = 54; 45%) и группы пациентов с однократным использованием ИТК (n = 66; 55%). Повторное использование оценивалось как ретритмент – использование препаратов того же терапевтического класса при прогрессировании/рецидиве заболевания через шесть и более месяцев после завершения адъювантной терапии или речеллендж – повторное использование препаратов того же терапевтического класса у леченных больных по поводу метастатической стадии заболевания с регистрацией ранее клинического улучшения или объективного ответа.
Результаты. При оценке эффективности ИТК в группе однократного использования препаратов ЧОО составила 53% (31,8% – частичный регресс, 21,2% – полный ответ), стабилизация заболевания – 40,9%. В целом частота контроля над заболеванием (ЧКЗ) в этой группе составила 93,9%. В группе повторного проведения ИТК ЧОО составила 14,8% (частичный регресс – 9,3%, полный ответ – 5,6%), стабилизация процесса – 62,9%, ЧКЗ – 77,7%. Медиана выживаемости до прогрессирования (мВДП) в группе речелленджа составила семь месяцев (95%-ный доверительный интервал (ДИ) 5–35 мес.), в то время как мВДП в группе ретритмента достигнута не была. Медиана общей выживаемости (мОВ) в группе однократного проведения таргетной терапии (ТТ) составила 48 месяцев (95% ДИ 30,48–65,5 мес.), а в группе повторного проведения ТТ мОВ составила 55 месяцев (95% ДИ 39,9–70,07 мес.), р value = 0,449.


Введение
В структуре заболеваемости злокачественных новообразований на 2023 г. в России меланома кожи составляет 2,2% и 1,7% среди женского и мужского населения соответственно. Прирост заболеваемости с 2013 г. по 2023 г. составил 34,11%. За последние десять лет наблюдается снижение показателя смертности на 12,43% [1]. Меланома с мутацией в гене BRAF характеризуется агрессивным течением заболевания, высокой склонностью к метастазированию и быстрому развитию резистентности к традиционным методам лечения. В 40–60% меланомы кожи выявляют мутации в активирующем домене серин/треонин киназы BRAF, которые вызывают стабильную каскадную гиперактивацию митоген-активированных протеинкиназ MEK1/2 и ERK1/2.
В последние годы значительные успехи были достигнуты в области таргетной терапии BRAF/MEK ингибиторами и иммунотерапии ингибиторами иммунных контрольных точек (ИКТИ), что значительно улучшило прогноз для пациентов с метастатической меланомой.
Лечение ИКТ направлено на блокирование специфических молекул, участвующих в росте и прогрессировании опухоли. У пациентов с BRAF-мутированной меланомой применение ингибиторов BRAF и MEK (BRAFi/MEKi) показало высокий процент ЧОО (до 70%) и значительное улучшение выживаемости. Однако, несмотря на достижения этой терапевтической опции, многие пациенты сталкиваются с рецидивами заболевания или прогрессированием после первичного лечения. В связи с этим возникает вопрос о целесообразности и возможном повторном проведении эффективных ранее методов терапии [2, 3].
Существуют два похожих термина, описывающих возврат к терапии: ретритмент и речеллендж [2].
Ретритмент – это лечение с использованием препаратов того же терапевтического класса при прогрессировании/рецидиве заболевания через шесть и более месяцев после завершения адъювантной терапии [2].
Речеллендж – повторное использование препаратов того же терапевтического класса у леченных больных по поводу метастатической стадии заболевания с регистрацией в прошлом клинического улучшения или объективного ответа на проведенную ранее терапевтическую опцию [2].
Использование комбинаций ингибиторов BRAF/МЕК (дабрафениб + траметиниб, вемурафениб + кобиметиниб) ассоциировано с высокой частотой объективного ответа ЧОО (до 70%) в сравнении с ИКТИ. Например, по данным трехлетнего наблюдения исследования CheckMate 067, ЧОО была следующей: в группе комбинации ниволумаб + ипилимумаб — 58%, ниволумаба — 44%, ипилимумаба — 19%. Однако главными преимуществами иммунотерапии по сравнению с ТТ стали более стойкий ответ и ингибирующее воздействие на рост меланомы, которые могут сохраняться даже после прекращения приема препаратов.
Несмотря на быстрый эффект терапии BRAF/MEK–ингибиторами, около 50% пациентов сталкиваются с прогрессированием заболевания примерно в течение первого года лечения. Опухоли с мутацией в гене BRAF представляют собой гетерогенную популяцию опухолевых клеток. Возникновение резистентных клонов опухолевых клеток к ингибиторам тирозинкиназ может происходить в ходе лечения. ТТ BRAF/MEK-ингибиторами приводит к регрессии чувствительных клонов клеток, в то время как резистентные к ней клоны остаются активными. Тем не менее популяция чувствительных клеток может быть не полностью уничтожена в процессе терапии. При прогрессировании опухоли после второй линии лечения (не ТТ), рост опухоли может быть обусловлен увеличением количества чувствительных клеток к терапии ингибиторами тирозинкиназ. В этом случае опухоль может снова реагировать на ТТ. Таким образом, ключевым механизмом, обеспечивающим эффективность возврата к ТТ, является восстановление со временем популяции чувствительных к ней клеток. Кроме того, существует и второй механизм – обратимая резистентность. Наиболее часто встречающимися механизмами резистентности являются реактивация сигнальных путей MAPK или PI3K-PTEN-AKT. Некоторые приобретенные механизмы резистентности (например, реактивация сигнального пути МАРК выше BRAF – активация RAS, или ниже BRAF – активация MEK1 или MEK2) могут быть обратимыми после прекращения ТТ, что позволяет опухоли восстановить свою чувствительность к этому виду лечения спустя некоторое время [2]. Стоит отметить, что в связи с внутриопухолевой гетерогенностью опухоли у одного и того же пациента могут наблюдаться несколько механизмов резистентности одновременно [4–6].
В исследованиях Bhave P. и соавт., Reschke R. и соавт. подтверждено, что повторное применение ТТ BRAFi/MEKi может быть эффективным для пациентов с меланомой кожи, которые ранее продемонстрировали клинический ответ на этот вид лечения [3, 7].
Bhave P. и соавт. на конференции ASCO 2020 представили результаты возврата к ТТ у 13 пациентов с рецидивом меланомы кожи после адъювантной ТТ: ЧОО составила 46,2%, ЧКЗ — 61,5% [7].
Длительность эффекта после повторного лечения ТТ обычно меньше, чем после первой линии терапии. Тем не менее эффективность возврата к ТТ остается достаточно высокой. Например, в исследовании Schreuer M. и соавт. медиана общей выживаемости (мОВ) у пациентов, получавших повторное лечение, составила 19,9 месяца, что сопоставимо с результатами первой линии терапии. Это подчеркивает важность возможности возврата к ТТ как дополнительной терапевтической стратегии для лечения рецидивирующей меланомы [8].
Эффективность повторного проведения ТТ у пациентов с метастатической или прогрессирующей меланомой, несмотря на то что она применяется в рамках третьей и последующих линий лечения при уже более тяжелом состоянии пациентов, можно считать весьма высокой. Исследования Schreuer M. и соавт. (мОВ — 19,9 мес.), Ayala de Miguel и соавт. (мОВ — 22,2 мес.) демонстрируют показатели эффективности, которые сходны с результатами, полученными при применении первой линии ТТ в более старых клинических испытаниях, таких как исследование COMBI–d/v, где мОВ — 25,9 месяца (95% ДИ 22,6–31,5), медиана выживаемости без прогрессирования (мВБП) – 11,1 месяца (ДИ 95% 9,5–12,8), ЧОО = 68% (полный ответ – 19%, частичный регресс – 49%), стабилизация заболевания – 23%, ЧКЗ – 91% [8–11].
В случае прогрессирования на фоне проведения ТТ в первой линии лечения чаще всего вариантом во второй линии является терапия ИКТИ. Наиболее неблагоприятным остается прогноз у больных, столкнувшихся с прогрессированием заболевания или завершением лечения по причине непереносимой токсичности на фоне проведения терапии ИТК в 1-й линии и неэффективностью ИКТИ во 2-й линии лечения, так как дальнейшие возможности терапии очень ограниченны [12].
На конференции ASCO 2023 Bhave P. и соавт. представили результаты повторного лечения BRAF/MEK ингибиторами у 26 пациентов с метастатической BRAF-мутированной меланомой. ЧОО составила 38,5%, ЧКЗ – 50%, мВБП составила 11,1 месяца, а мОВ — 22,2 месяца [13].
В исследованиях Reschke R. и Ayala de Miguel P. у пациентов с метастатической меланомой при ретритменте мОВ варьировала от 9,8 до 22,2 месяца, мВБП колебалась от 4,9 до 11,1 месяца, средняя ЧКЗ составила 65% [3, 13]. Во всех этих исследованиях не проведен сравнительный анализ использования BRAF/MEK-ингибиторов повторно и однократно.
В связи с этим целью нашего исследования был сравнительный анализ эффективности повторного и однократного назначения ингибиторов BRAF и MEK у больных с диссеминированной меланомой кожи с мутацией в гене BRAF. В нашем исследовании не оценивалась токсичность повторного использования ИТК.
Материал и методы
Исследование основано на анализе данных историй болезни 120 пациентов с диссеминированной BRAF-мутированной меланомой кожи, которые получали лечение в клиниках Санкт-Петербургского городского клинического онкологического диспансера (n = 110) и в клинике «Скандинавия» (n = 10) в период с февраля 2020 г. по июнь 2024 г. У всех пациентов был морфологически верифицирован диагноз меланомы кожи и определена положительная мутация в гене BRAF методом полимеразной цепной реакции (ПЦР).
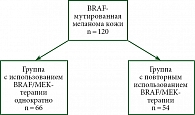
Согласно разработанному дизайну исследования (рис. 1), пациенты были разделены на две группы: из 120 человек, вошедших в исследование, у 54 пациентов (45%) имелось в анамнезе повторное использование ингибиторов тирозинкиназ и у 66 пациентов (55%) ТТ проводилась только один раз.
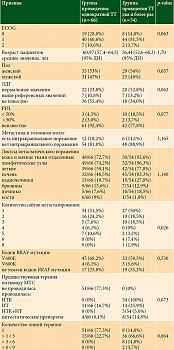
В таблице 1 представлена общая характеристика пациентов двух групп. Как видно из таблицы, по основным прогностическим факторам (значение ECOG, средний возраст, гендерное распределение, характер метастазирования, значение лактатдегидрогеназы (ЛДГ) и т.д.) сравниваемые группы были сопоставимы (р > 0,05). Наиболее часто в обеих группах встречались мутации BRAF в кодоне V600E 45 (68,2%) и 32 (59,3%) пациента соответственно. Кроме того, практически у четверти больных в обеих группах при молекулярно-генетических исследованиях (МГИ) не указан кодон мутации BRAF. У большей части пациентов в группах однократного и повторного проведения терапии ИТК не было выявлено метастатического поражения головного мозга (81,8% и 88,9% соответственно). У 24,2% больных в группе проведения однократной ТТ и 31,5% пациентов из группы повторного проведения терапии BRAF/MEK-ингибиторами определялось наличие более трех сайтов метастазирования. Наиболее часто встречающимся сайтами метастазирования у пациентов с метастатической меланомой с мутацией в гене BRAF в группе проведения однократной ТТ являлось поражение отдаленных лимфатических узлов, которое выявлено у 74,2% (n = 49), кожи и мягких тканей у 72,7% (n = 48), а наиболее редким сайтом вторичного поражения были кости (9%, n = 6). У больных с повторным проведением ИТК самыми частыми локусами метастатических очагов также были кожа и мягкие ткани – у 92,6% (n = 50), отдаленные лимфатические узлы – у 96,3% (n = 52) и самым редким сайтом вторичного поражения были кости (1,8%, n = 1). В данной группе пациентов повторному проведению ТТ предшествовала ИТ – у 25,9% (n = 14), ИТ + ИТК – у 5,6% (n = 3), цитостатическая терапия – у 14,8% (n = 8). В то время как у больных с использованием однократной ИТК проведена ИТ у 16,7% (n = 11), химиотерапия цитостатическими препаратами – у 6,1% (n = 4), а у 77,3% (n = 51) предшествующих терапевтических опций нет. В группе пациентов с использованием ТТ два и более раз у 66,6% (n = 36) пациентов имеется от одной до трех линий лечения диссеминированной BRAF-мутированной меланомы кожи, в то время как у больных с проведением однократной ТТ у 77,3% (n = 51) в анамнезе имеется только одна линия лечения.
В таблице 2 представлены данные о характере повторного использования ИТК. У 17 пациентов проведен ретритмент и у 37 пациентов речеллендж в различных комбинациях. Вернулись к ИТК повторно после проведения адъювантной терапии (ретритмент): восемь больных в первой линии (медиана безрецидивной выживаемости (мБРВ) в этой группе больных составила 18 мес.), восемь больных во второй линии (мБРВ 7,3 мес.) и лишь один больной получил повторно в качестве третьей линии ИТК, его безрецидивный промежуток после адъювантного лечения составил 3 месяца. В группе речелленджа практически все больные (37 пациентов) получили ИТК в первой линии и лишь четыре пациента начали лечение ТТ только со второй линии. После первой линии одинаково возвращались к опции ИТК во второй и третьей линиях 13 и 13 пациентов соответственно. Стратегия речелленджа во второй линии связана со сменой препарата дабрафениб на вемурафениб и наоборот (табл. 3).
Как видно из табл. 3, повторное использование ИТК без смены таргетных препаратов произошло у 25 больных, со сменой у 29 больных.
Оценка эффективности проводимого лечения проводилась с использованием критериев оценки ответа солидных опухолей RECIST 1.1 (Response Evaluation Criteria In Solid Tumors).
Статистическая обработка результатов исследования
Сравнение частотных переменных проводилось с помощью критерия Хи-квадрат Пирсона. Описание данных, имеющих нормальное распределение, проведено с помощью среднего и стандартного отклонения (M ± SD) с указанием 95%-ного доверительного интервала. Для оценки выживаемости использован метод Каплан – Майера, представляющий собой общепринятый способ оценки времени до наступления события, например, до времени общей выживаемости или времени выживаемости без прогрессирования заболевания. Этот подход позволяет визуализировать и анализировать функции выживания, создавая кривые выживаемости для различных групп пациентов. Он учитывает случаи цензурирования, когда пациент покидает исследование без наступления события. Для всех пациентов, у которых событие не произошло, данные «цензурируются» на момент последнего контакта, что повышает точность анализа. Сравнение кривых выживаемости проводилось с помощью лог-рангового теста.
Результаты и обсуждение
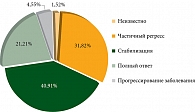
Согласно данным диаграммы оценки эффективности ИТК в группе однократного проведения ТТ (рис. 2), частота ответов при лечении ИТК, воздействующих на мутацию BRAF, соответствует: ЧОО – 53% (31,8% – частичный регресс, 21,2% – полный ответ), стабилизация заболевания – 40,9%. В целом частота контроля над заболеванием (ЧКЗ) в этой группе выявлена у 93,9% пациентов.
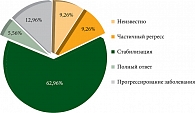
Как видно из диаграммы оценки эффективности терапии ИТК, представленной на рис. 3, в группе повторного проведения ИТК ЧОО составила 14,8% (частичный регресс – 9,3%, полный ответ – 5,6%), стабилизация процесса – 62,9%, ЧКЗ = 77,7%.
Стоит отметить, что в группе повторного проведения ИТК в первой и второй линиях терапии метастатической меланомы с мутацией в гене BRAF (n = 29; 53,7%) частота ответов представлена стабилизацией процесса – 72,4% (n = 21), частичный регресс у 17,2% (n = 5), полный ответ у 6,9% (n = 2); а прогрессирование заболевания выявлено у 3,4% (n = 1), ЧКЗ = 96,6%, ЧОО = 24,1%. Частота ответов в группе речелленджа BRAF/MEK-ингибиторов в третьей и последующих линиях (n = 25, 46,3%) составила: стабилизация заболевания – 60% (n = 15), частичный регресс – 20% (n = 5), полный ответ не был зарегистрирован у пациентов в данной группе 0% (n = 0) и прогрессирование заболевания у 20% (n = 5), ЧКЗ = 80%, ЧОО = 20%.
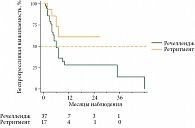
С целью оценки эффективности ретритмента и речелленджа выполнена оценка выживаемости до прогрессирования (ВДП), которая определялась как время от момента начала повторного проведения ТТ до прогрессирования болезни или смерти от любой причины (рис. 4).
Таким образом, медиана выживаемости до прогрессирования (мВДП) в группе речелленджа составила семь месяцев (95% ДИ 5–35 мес.), в то время как мВДП в группе ретритмента достигнута не была.
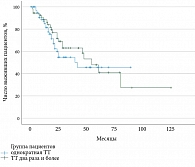
Кроме того, оценен показатель общей выживаемости повторного использования ТТ и использования ТТ однократно у больных обеих групп, которая рассчитывалась как время от начала лечения до момента смерти от любых причин (рис. 5).
В группе однократного проведения ТТ мОВ составила 48 месяцев (95% ДИ 30,48–65,5 мес.), а в группе повторного проведения ТТ мОВ составила 55 месяцев (95% ДИ 39,9–70,07 мес.) р = 0,449. Статистически значимых различий в группах не выявлено (рис. 5).
Исходя из полученных результатов, стоит отметить, что повторное использование ТТ при метастатической BRAF-мутированной меланоме не ухудшает показатели общей выживаемости в сравнении с показателями пациентов, получивших терапию только в одной линии. Таким образом, ТТ BRAF/MEK-ингибиторами, блокируя путь BRAF, влияет на чувствительный пул клеток, контролируя на некоторое время опухолевый рост. В результате применения ТТ происходит усиление сформировавшегося BRAF-резистентного пути. Повторное использование ТТ может контролировать заболевание в виде стабилизации опухолевого процесса, частичного регресса заболевания, но при этом не влияет на общую выживаемость пациентов.
Заключение
Промежуточный анализ повторного использования ИТК демонстрирует высокую эффективность у пациентов с диссеминированной меланомой кожи, которые ранее достигли клинического ответа на эту терапию. В группе ретритмента у восьми больных в первой линии мБРВ составила 18 месяцев, у восьми пациентов во второй линии мБРВ – 7,3 месяца, один больной получил повторно в качестве третьей линии ИТК и его БРП после адъювантного лечения составил три месяца. Медиана ВДП в группе речелленджа составила семь месяцев (95% ДИ 5–35 мес.), в то время как мВДП в группе ретритмента достигнута не была. В нашем исследовании имеются больные с использованием речелленджа ингибиторами BRAF/MEK после прогрессирования в предыдущей линии лечения ИТК в связи с проведением «химиотерапевтических каникул». Это подтверждает эффективность стратегии повторного применения ТТ ингибиторами тирозинкиназ после перерыва в лечении, которая основана на возможности восстановления популяции клеток, чувствительных к BRAFi/MEKi, в период паузы в лечении после первой линии ТТ, а также на обратимости механизмов приобретенной вторичной резистентности. Даже если ранее наблюдалось прогрессирование заболевания на фоне ТТ, пациенты обычно реагируют на повторное использование BRAFi/MEKi соответственно предполагаемым результатам. Следующим этапом исследований будет определение портрета пациента, который получит максимальный эффект от назначения повторного использования ИТК как с точки зрения характера метастазов, так и эффективности и токсичности предыдущего использования ТТ.
A.V. Pudina, I.M. Itkin, N.Yu. Antimonik, S.I. Kutukova, R.V. Orlova
Saint Petersburg State University
City Clinical Oncology Dispensary, Saint Petersburg
Saint Petersburg State Medical University named after acad. I.P. Pavlov
Contact person: Anastasia V. Pudina, Nastya.pudina@bk.ru
The progress in molecular biology has led to the identification of a mutation in the BRAF gene, which occurs in approximately 40–60% of malignant melanoma cases and serves as both a prognostic and predictive marker for the effectiveness of tyrosine kinase inhibitors (TKIs). The introduction of BRAF/MEK inhibitors into clinical practice has been a significant step in the treatment of metastatic melanoma. The primary target for TKIs in BRAF-positive melanoma is the mitogen-activated protein kinase (MAPK) signaling pathway, which is responsible for tumor cell proliferation and is activated by the BRAF gene mutation. The most widely used BRAF inhibitors in clinical practice are Vemurafenib and Dabrafenib. Recent studies have shown that achieving positive treatment outcomes for patients with BRAF mutations requires targeting multiple points within the dysregulated signaling pathway. MEK inhibitors (Cobimetinib, Trametinib) serve as companions to BRAF inhibitors and work in combination with them, providing a synergistic effect and minimizing the development of resistance.
The combination of BRAF and MEK TKIs has resulted in a high objective response rate (ORR), symptom control, and increased overall survival. However, despite the significant advancements in melanoma therapy in recent years, which have undoubtedly led to prolonged survival and improved symptom control, resistance to treatment eventually arises, prompting physicians to consider subsequent lines of therapy when all therapeutic options have been utilized. In this context, studying the possibility of reintroducing previously administered anticancer therapies becomes highly relevant. This study presents an interim analysis of the efficacy of re-administering BRAF and MEK inhibitors in patients with disseminated BRAF-mutated cutaneous melanoma. The analysis
of the use of targeted therapy (TKI) is based on data collection from 120 patients with disseminated BRAF-mutated cutaneous melanoma who received treatment at the clinics of Saint Petersburg City Clinical Oncology Dispensary (n = 110) and the Scandinavia clinic (n = 10) from February 2020 to June 2024. An indirect comparison was made between two groups: the group of patients with re-use of TKIs (n = 54; 45%) and the group of patients with single use of TKIs (n = 66; 55%). Re-use was assessed as retreatment – using drugs from the same therapeutic class upon disease progression/recurrence after 6 or more months following the completion of adjuvant therapy – or rechallenge – reusing drugs from the same therapeutic class in previously treated patients for metastatic disease, with documentation of prior clinical improvement or objective response.
Results. When evaluating the efficacy of TKIs in the single-use group, the overall response rate (ORR) was 53% (31.8% – partial regression, 21.2% – complete response), with disease stabilization at 40.9%. Overall, the disease control rate (DCR) in this group was 93.9%. In the re-treatment group, the ORR was 14.8% (partial regression – 9.3%, complete response – 5.6%), with stabilization of the process at 62.9%, and DCR at 77.7%. The median progression-free survival (mPFS) in the rechallenge group was 7 months (95% CI 5-35 months), while mPFS was not reached in the retreatment group. The median overall survival (mOS) in the single-use targeted therapy (TT) group was 48 months (95% CI 30.48–65.5 months), whereas in the re-treatment TT group, mOS was 55 months (95% CI 39. – 70.07 months), with a P value of 0.449.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.