Позднее отцовство: обзор повреждающих эякулят механизмов, рисков и стратегий их преодоления
- Аннотация
- Статья
- Ссылки
- English
Введение
Старение является очень сложным процессом, протекающим у каждого человека индивидуально, поэтому врачи испытывают трудности в обобщении информации о комплексных эффектах старения. Гораздо больше известно о возрастном материнстве и женской роли в репродуктивном успехе, нежели о влиянии мужского фактора в отношении зачатия, вынашивания и здоровья будущего потомства.
Под поздним материнством традиционно понимают первые роды у женщины старше 35 лет [1]. Статистически значимое ухудшение показателей спермограммы и снижение вероятности зачатия наблюдаются у мужчин после 34 лет и особенно выражены в возрастной группе старше 46 лет [2, 3]. Тем не менее в настоящее время медицинские генетики не рекомендуют указывать верхний предел возраста для мужчин, которые стремятся инициировать беременность у супруги, а Британское общество андрологии (British Andrology Society) и Американское общество репродуктивной медицины (American Society for Reproductive Medicine) предлагают ограничить только возраст донора спермы 40 годами [4].
Снижение женской фертильности с возрастом в первую очередь вызвано непреодолимыми факторами, которые невозможно контролировать или изменить: уменьшением числа овариальных фолликулов и ухудшением качества ооцитов [5, 6]. В то же время снижение мужской фертильности с возрастом обусловлено уменьшением уровня андрогенов и ухудшением качества спермы – факторами, которые поддаются частичной коррекции [7–9].
В отличие от менопаузы, которая знаменует прекращение функции яичников в связи с неизбежной потерей женских гамет, сперматогенез продолжается на протяжении всей жизни. Тем не менее старение мужчины действительно оказывает отрицательное воздействие на репродуктивные органы и ткани. У женщин, независимо от возраста, для формирования зрелой яйцеклетки из зиготы требуется в общей сложности 23 клеточных деления. У мужчин около 30 редукционных делений клеток происходит до полового созревания. После полового созревания сперматогенные клетки делятся каждые 16 дней (23 раза в год). Если средний возраст мужского полового созревания составляет 15 лет, то эякулят 70-летнего мужчины производится после 1300 митотических делений. В результате неисправленных ошибок при репликации ДНК, которая предшествует каждому делению клеток, часто возникают мутации. Можно предположить, что с возрастом из-за большого числа клеточных делений во время сперматогенеза увеличивается число de novo мутаций [10–12]. В этой связи зрелый и пожилой возраст мужчины на момент зачатия может стать причиной формирования у ребенка врожденных дефектов, обусловленных одиночными генными мутациями и хромосомными аномалиями. Позднее отцовство также связывают с психическими заболеваниями и некоторыми злокачественными образованиями [13].
Социально-демографические аспекты
Тенденции последних десятилетий неутешительны. Стремление получить образование и сделать карьеру, увеличение продолжительности жизни, доступность контрацептивов привели к тому, что, с одной стороны, снизилась частота незапланированных беременностей, а с другой – повысился возраст родителей при рождении первого ребенка. Информированность населения о методах вспомогательных репродуктивных технологий и «социальной заморозке» создала иллюзию «репродуктивной подушки безопасности» [14].
В 2008 г. средний возраст первородящих в странах Западной, Южной и Северной Европы, а также Японии составил около 28–29 лет, в Восточной Европе, странах бывшего СССР и в США – в среднем 24–26 лет [15]. По данным социологических исследований, как мужчины, так и женщины планируют рождение ребенка в возрасте, сопряженном с высоким риском бесплодия, невынашивания и другими неблагоприятными репродуктивными исходами. Так, в 2008 г. в Австрии только планировали иметь ребенка 28% женщин и 46% мужчин в возрасте 35–39 лет и 12 и 24% – в возрасте 40–45 лет [16].
Данные о возрасте мужчин на момент зачатия и рождения ребенка немногочисленны и доступны для некоторых развитых стран. В основном возраст отцов превышает средний возраст матерей на три года. Так, в Англии и Уэльсе в 2007 г. средний возраст отцов составлял 32,4 года (у матерей – 29,3 года). После 40 лет становились отцами около 10% мужчин, после 50 – не больше 1,3% [17]. Показатель живорождений в США на 1000 мужчин 45–49 лет увеличился с 6,1 в 1980 г. до 8,2 в 2007 г. [18].
По итогам выборочного наблюдения репродуктивных планов населения, проведенного в 2012 г. Федеральной службой государственной статистики в 30 субъектах Российской Федерации, почти половина респондентов-мужчин (47,8%) при наличии всех необходимых условий хотели бы иметь двоих детей, около четверти (24,3%) – троих. Что касается ожидаемого числа детей, то 18% респондентов намеревались иметь троих и более детей, 47,9% планировали иметь двоих детей, 21,8% мужчин собирались ограничиться одним ребенком (при этом желали иметь единственного ребенка лишь 12,8%). Представленные результаты дают основания говорить о наличии обратной зависимости между оценкой уровня жизни и желаемым числом детей. Среди помех к рождению желаемого числа детей респонденты чаще всего отмечали материальные трудности (39,4%), неуверенность в завтрашнем дне (31,7%) и жилищные проблемы (29,1%). Увеличился интервал между началом супружеской жизни и рождением первого ребенка. У тех, кто рожал первенца в 1990-е гг., он составлял в среднем почти год, в 1995–2009 гг. – 15 месяцев, а в 2011–2015 гг. – 20,3 месяца. Это происходит во многом из-за откладывания регистрации брака [19].
Необходимо отметить, что отсрочка регистрации брака и планирования беременности также увеличивает риск развития или прогрессирования сопутствующих заболеваний, угрожающих репродуктивному здоровью. Не следует забывать о характерных для молодого возраста онкологических заболеваниях с высоким уровнем летальности и потери репродуктивной функции, например раке яичка, пик выявляемости которого приходится на 30–35 лет [20]. Частота колоректального рака увеличивается на 5,2% ежегодно для белых мужчин 20–29 лет [21]. Кроме того, такие факторы образа жизни, как курение и ожирение, оказывают негативное воздействие с кумулятивным эффектом в течение многих лет [22].
Позднее рождение ребенка влияет на отношения, эмоциональную дистанцию и общение между детьми и родителями, детьми и бабушками и дедушками, однако не оказывает сильных и негативных последствий для психологического и эмоционального благополучия детей [23, 24].
Как и возрастное материнство, возрастное отцовство может иметь серьезные последствия для системы здравоохранения: повышаются затраты на достижение беременности, а также на терапию потенциальных последствий для здоровья ребенка [25].
Механизм снижения фертильности и связанных рисков
Старение – многофакторный и сложный процесс – сопровождается прогрессирующим снижением клеточных функций и, следовательно, повышенной восприимчивостью к заболеваниям. Сразу несколько процессов, включая повреждения ДНК и укорочение теломер, приводят к возникновению клеточного старения, или апоптозу [26, 27]. Именно поэтому чем дальше мужчина откладывает отцовство, тем выше риск накопления de novo мутации, бесплодия и генетических рисков для потомства [12].
Гормональный фон. Сообщается, что угасание мужской фертильности связано с изменением гормонального фона. Повышенный уровень фолликулостимулирующего гормона сыворотки крови и сниженный уровень тестостерона являются наиболее распространенными клинически значимыми возрастными изменениями. Растущая с возрастом концентрация сывороточного фолликулостимулирующего гормона у мужчин связана с сокращением функционирующих клеток Сертоли, что сопровождается уменьшением объема яичек и утолщением базальной мембраны семенных канальцев [28]. A.M. Mahmoud и соавт. установили, что у мужчин в возрасте > 75 лет средний объем яичек был на 31% меньше, чем у мужчин 18–40 лет [29]. Число клеток Лейдига, отвечающих за продукцию тестостерона, у мужчин 50–76 лет в среднем вдвое меньше, чем у мужчин 20–48 лет, что играет ключевую роль в возникновении андропаузы [30, 31]. Возрастной андрогенный дефицит приводит к снижению либидо и качества жизни. Несмотря на то что эти симптомы напрямую не связаны с фертильностью, недостаточная сексуальная активность может быть одной из причин бесплодия [32].
Фрагментация ДНК. Одна из основных теорий старения – свободнорадикальная – рассматривает этот процесс как результат накопления неустраненных повреждений ДНК, вызванных окислительным стрессом. Такие повреждения связывают со старением многих соматических тканей, и яички не являются исключением [33, 34]. При повреждении ДНК наблюдаются блок транскрипции и клеточного цикла, мутагенез и гибель клеток [35]. Любое из этих последствий фрагментации ДНК может привести к нарушению сперматогенеза, мутациям в зародышевой линии и в конечном счете стать причиной переходящих потомству генетических дефектов.
Доказано, что по мере старения, с одной стороны, копятся активные формы кислорода (АФК), с другой – снижается уровень естественных антиоксидантов, вследствие чего нарушается баланс в системе антиоксидантной защиты [36, 37]. Дисбаланс ведет к накоплению повреждений ДНК в герминогенных клетках, что вызывает изменения экспрессии генов с возрастом. Кроме того, старение, по всей видимости, снижает способность герминогенных клеток к восстановлению такого повреждения, что становится причиной образования сперматозоидов с повышенным уровнем фрагментации ДНК [38].
S.I. Moskovtsev и соавт. сообщили, что фрагментация ДНК гораздо чаще встречалась у мужчин старше 45 лет, причем индекс фрагментации ДНК в этой возрастной группе в два раза превышал таковой у мужчин 30–44 лет [39]. M. Spano и соавт. также наблюдали количественное удвоение повреждений ДНК сперматозоидов у мужчин от 25 до 55 лет (n = 215), планирующих инициировать беременность у партнерши [40]. В подтверждение этих выводов N.P. Singh и соавт. сообщили, что у мужчин 36–57 лет процент сперматозоидов с высоким уровнем повреждений ДНК был значительно выше, чем у мужчин 20–35 лет. Они также отметили связанное с возрастом снижение интенсивности апоптоза и предположили, что это результат менее эффективных вследствие старения процессов отбора клеток сперматозоидов [41]. Апоптоз герминогенных клеток в ходе сперматогенеза является нормой, однако этот процесс может быть менее эффективным у пожилых мужчин, что приводит к высвобождению большего количества сперматозоидов с поврежденной ДНК [42]. В недавнем метаанализе в 2015 г. S.L. Johnson и соавт. сравнили результаты 26 исследований с участием 10 220 мужчин и также сделали вывод о значительной корреляции возраста мужчины и выраженности фрагментации ДНК [25].
Длина теломер. Укорочение концевых участков хромосом (теломер) с возрастом можно считать предполагаемой причиной нарушенного сперматогенеза и мужского бесплодия, однако подтверждение причинно-следственной связи требует дополнительных исследований. С каждым клеточным делением концевые участки укорачиваются, при достижении критической длины клетки прекращают делиться или погибают. Несколько исследований сообщают о выраженной достоверной положительной корреляции между возрастом отца и укорочением лейкоцитарных теломер у ребенка, что может сказаться на продолжительности жизни и фертильности потомства [43–46]. Выявлена положительная связь между длиной теломер и количеством сперматозоидов, а также длиной теломер и возрастом отца [47, 48].
Мутации de novo. У мужчин старшей возрастной группы вероятность зачатия ребенка с редкими тяжелыми заболеваниями высока. A. Kong и соавт. сообщили о положительной корреляции между возрастом и частотой мутаций de novo. По их оценкам, наследуемость мутаций в потомстве связана с возрастом отца и прирастает двумя парами оснований в год (4%) [12]. У мужчин 20 лет сперма подвергается 150 хромосомным репликациям, 50 лет – 840 репликациям [49–51]. Вследствие этого повышается вероятность ошибок репликации в зародышевой линии, ведущей к накоплению мутаций, и, следовательно, увеличивается потенциальная частота мутаций в сперматозоидах [12]. Проблема, связанная с процессами репликации и репарации ДНК, усугубляется по мере старения мужчины [52].
Хромосомные анеуплоидии. Большинство анеуплоидных эмбрионов с аномальным набором хромосом умирают в утробе матери, и, следовательно, хромосомные анеуплоидии являются частой причиной неудачного исхода беременности. Тем не менее 1% анеуплоидных беременностей заканчиваются живорождением, на долю которого приходится большое количество случаев умственной отсталости и/или врожденных дефектов [53, 54]. В среднем 10% клеток спермы здорового мужчины имеют хромосомные анеуплоидии, число которых увеличивается с возрастом [55, 56]. G.C. McIntosh и соавт. сообщили о повышении риска анеуплоидии вдвое среди мужчин 50 лет и старше по сравнению с мужчинами 25–29 лет [57].
Параметры эякулята
Зрелый и пожилой возраст мужчин связывают со снижением рождаемости и низким качеством эякулята, в частности с уменьшением объема спермы, нарушением подвижности и морфологии сперматозоидов. Большинство исследований показали, что старение ведет к негативным изменениям в параметрах семенной жидкости. Так, свой негативный вклад вносят возрастная сосудистая недостаточность, сопутствующие заболевания (например, сахарный диабет и гипертензия), хронические инфекции (например, простатит), ожирение, гормональная недостаточность и дисфункция добавочных желез [58–61]. По данным W.J. Hellstrom и соавт., у мужчин в возрасте 45–47,8 года средний объем спермы составляет 2,8 мл, а в возрасте от 56,6 до 80,1 года – уже 1,95 мл [62]. E. Levitas и соавт. в 2007 г., проведя ретроспективный обзор, установили, что пик объема спермы приходится на 30–35 лет (3,5 ± 1,8 мл), значительно снижаясь после 55 лет (2,2 ± 1,2 мл) [63].
В некоторых исследованиях наблюдалось уменьшение концентрации сперматозоидов с возрастом [64–66]. J. Auger и соавт. продемонстрировали снижение концентрации сперматозоидов на 3,3% в год или 66%-ное снижение в период с 30 до 50 лет [66]. W. Cardona Maya и соавт. обследовали 1364 мужчин и определили, что общее количество сперматозоидов обратно пропорционально возрасту [67]. J.R. Kovac и соавт. резюмировали, что в то время как связь концентрации спермы и возраста неубедительна, общее количество сперматозоидов, по всей видимости, снижается с возрастом [14].
По данным большинства исследований, с возрастом мужчины также коррелирует моторика сперматозоидов [60, 62, 63, 66]. В частности, J. Auger и соавт. показали снижение подвижности сперматозоидов на 0,6% в каждый год жизни [66]. E. Levitas и соавт. обнаружили, что пик подвижности приходится на возраст моложе 25 лет (44,4 ± 21%), низкая подвижность наблюдалась в исследовании у мужчин старше 55 лет (24,8 ± 18%) [63].
Данные о взаимосвязи возраста мужчины и морфологии сперматозоидов трудно интерпретировать, учитывая, что критерии морфологии менялись с течением времени и единых референсных величин лабораторных показателей не существует. Большинство исследований указывают на снижение с возрастом доли нормальных форм сперматозоидов [60, 66, 68]. J. Auger и соавт. определили потерю доли нормальных форм на 0,9% в год и снижение до 4% нормальных форм у мужчин от 50 лет и старше и 22% для мужчин моложе 30 лет [66].
Тем не менее наличие нормозооспермии не всегда является предиктором репродуктивного успеха у мужчин в возрасте. В исследовании M. Das и соавт. больше половины мужчин (53%) с нормозооспермией страдали идиопатическим бесплодием. Авторы обнаружили, что индекс фрагментации ДНК был значительно выше у мужчин с нормозооспермией в группе старшего возраста (≥ 40 лет) по сравнению с более молодыми мужчинами (< 40 лет). Кроме того, высокие уровни повреждений ДНК спермы (> 30%) встречались значительно чаще у мужчин 40 лет и старше (17 против 3% у мужчин моложе 40 лет) [69]. Последнее крупное исследование было выполнено S. Belloc и соавт. В общей сложности из когорты 4345 мужчин, обратившихся по поводу бесплодия, были отобраны 1974 с нормозооспермией. Индекс фрагментации ДНК положительно коррелировал с возрастом (r = 0,17) и отрицательно – с прогрессивной подвижностью сперматозоидов (r = -0,26). У 5% мужчин с нормозооспермией выявлен высокий индекс фрагментации ДНК (> 30%) [70].
Время достижения естественной беременности
По данным W.C. Ford и соавт., мужчины в парах, которым удалось зачать в течение 12 месяцев, были значительно моложе мужчин в парах, которым потребовалось больше времени. Среднее время достижения беременности в парах, где мужчины были моложе 25 лет, составило чуть более 4,5 месяца, после 40 лет – 24 месяца. Был сделан вывод о том, что отношение шансов для зачатия в течение 12 месяцев снижается на 3% на каждый год жизни мужчины [71].
В другом исследовании вероятность клинической беременности для здоровой пары, где оба партнера были в возрасте 35 лет, в наиболее благоприятный день цикла достигала 0,29, а для 35-летней женщины с 40-летним партнером снижалась до 0,18 [72].
В обзорном исследовании M.A. Hassan и соавт. установили пятикратное увеличение времени, которое требовалось для достижения беременности в паре, если мужчина был старше 45 лет. Более того, в сравнении с женщинами, партнеры которых были моложе 25 лет, женщины в парах, где мужчина был старше 45 лет, в 4,6 раза чаще не достигали беременности после одного года регулярной половой жизни без контрацепции, и в 12,5 раза чаще им требовалось для достижения беременности свыше двух лет [73].
Вспомогательные репродуктивные технологии
Как было показано выше, положительные корреляции с возрастом мужчины (особенно > 50 лет) были зарегистрированы для увеличения фрагментации ДНК сперматозоидов и ухудшения подвижности сперматозоидов. Это ведет к снижению вероятности наступления беременности в паре и повышению частоты невынашивания, поддерживая общее негативное влияние старения на успешные исходы вспомогательных репродуктивных технологий [39, 41, 74–76].
Повреждение ДНК сперматозоидов неблагоприятно влияет на исход внутриматочной инсеминации и в меньшей степени на показатели достижения беременности при ЭКО, но не ЭКО/ИКСИ [77–79]. Женщины, чьи партнеры были моложе 30 лет, на 50% чаще достигали беременности при использовании внутриматочной инсеминации по сравнению с женщинами, партнеры которых был старше 35 лет [80]. H.S. Klonoff-Cohen и L. Natarajan отметили, что частота наступления беременности у женщины зависела от возраста партнера. Каждый последующий год возраста мужчины повышал шансы недостижения беременности в паре на 11% и увеличивал шансы мертворождения на 12% [81].
Повреждение ДНК сперматозоидов также было связано с низким качеством и темпами развития эмбриона [79]. M.A. Baker и соавт. выявили отрицательную корреляцию между повышенным уровнем АФК в сперме и уровнем оплодотворений, качеством эмбрионов и наступлением клинической беременности [82]. В другом исследовании наблюдалось замедление темпов деления бластоцисты в присутствии АФК с высоким индексом фрагментации ДНК эмбриона, что приводило к низкой частоте достижения клинической беременности [83].
По данным систематического обзора и метаанализа исследований результатов ЭКО и ИКСИ, повреждение ДНК спермы значительно увеличивало риск невынашивания беременности после ЭКО и ИКСИ [79]. Повышенный уровень эмбрионов низкого качества и невынашиваний при мужском факторе бесплодия и повреждениях ДНК сперматозоидов в программах ЭКО и ИКСИ некоторые авторы объясняют хромосомной анеуплоидией сперматозоидов [84, 85].
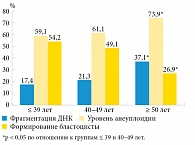
J. García-Ferreyra и соавт. в 2015 г. показали, что группа мужчин 50 лет и старше имела значительно большее количество сперматозоидов с поврежденной ДНК, более низкий уровень развития бластоцисты и более высокие показатели анеуплоидии эмбрионов по сравнению с двумя другими оцениваемыми группами (р < 0,05) (рисунок) [86].
Многие авторы высказывали предположение о том, что процесс отбора сперматозоида во время ИКСИ позволит уменьшить возможные нежелательные эффекты повреждения ДНК и улучшить исходы методов вспомогательных репродуктивных технологий [78]. Тем не менее отбор морфологически нормальных сперматозоидов из образца с высоким уровнем фрагментации ДНК не гарантирует более низкий уровень повреждений ДНК в этом морфологически нормальном сперматозоиде, по крайней мере данные литературы по этому вопросу противоречивы [58, 87].
Последствия для беременности и перинатальные исходы
В ряде крупных исследований было обнаружено, что возраст мужчины связан с повышенным риском потери плода после достижения естественной беременности [88–91]. Так, исследование «случай – контроль» с участием 13 865 женщин показало, что возраст отца 40 лет и старше на момент зачатия в значительной степени связан с невынашиванием беременности, независимо от возраста матери и некоторых других факторов [89]. R. Slama и соавт. сообщили, что у партнерш мужчин старше 45 лет риск самопроизвольного аборта был почти в два раза выше, чем у женщин, забеременевших от мужчин моложе 25 лет. Возраст мужчины > 40 лет становится негативным фактором в отношении невынашивания при условии, что женщина старше 30 лет [88, 91].
Риск преэклампсии возрастает у женщин, забеременевших от мужчин моложе 25 и старше 35 лет, по сравнению с женщинами, партнеры которых были в возрасте 25–34 лет. Это было показано в Иерусалимском перинатальном исследовании (n = 81 213) с уровнем преэклампсии 1,6%. Коэффициент отношения шансов для мужчин в возрасте 35–44 лет равнялся 1,24 (95% ДИ 1,05–1,46), для мужчин 45 лет и старше – 1,80 (95% ДИ 1,40–2,31), тогда как для мужчин до 25 лет – 1,25 (95% ДИ 1,04–1,51) [92].
Достаточно много известно о влиянии генов отца на нормальное развитие и функционирование плаценты, однако вопрос о том, как сказывается возраст мужчины при зачатии на патологии и частоте отслойки плаценты, освещен крайне скудно [93–95]. По данным A.P. Alio и соавт., у женщин, забеременевших от мужчин старше 45 лет, чаще имеют место гипертония, отслойка плаценты и неправильное предлежание плаценты в ходе беременности. Авторы также выявили наивысшие показатели мертворождений и рождений детей с низким весом для этой возрастной группы мужчин [93].
В некоторых исследованиях обнаружена взаимосвязь возраста мужчин при зачатии и частоты преждевременных родов [93, 94–98]. J.L. Zhu и соавт. проанализировали данные 70 347 одноплодных рождений в Дании. Отношение шансов для преждевременных родов (34–37 недель) у женщин 20–24 лет при беременностях от мужчин старше 50 лет было в 2,1 раза выше (95% ДИ 1,3–3,5), чем от мужчин 20–24 лет. Отношение шансов для очень ранних родов (22–27 недель) для женщин, партнеры которых на момент зачатия были старше 50 лет, составило 3,4 (95% ДИ 1,0–11,0). В то же время при исключении детей с врожденными пороками развития корреляция между возрастом отца и преждевременными родами уменьшилась [96].
Проанализировав 1 510 823 истории рождения в Италии, P. Astolfi и соавт. показали сходные эффекты с более высоким увеличением отношения шансов для преждевременных родов. Самый высокий показатель отношения шансов – 1,91 (95% ДИ 1,08–3,38) – был выявлен в группе пар, где возраст женщин составлял 20–24 года, а мужчин – 45–49 лет, по сравнению с контрольной группой пар, где женщины были того же возраста, а мужчины были в возрасте 25–29 лет [97, 98]. У детей, родившихся от мужчин старше 50 лет, риск ранней неонатальной гибели (≤ 20 недель беременности) и поздней неонатальной смерти увеличивался с коэффициентом 1,38 и 3,94 соответственно [99]. Сообщается, что вероятность кесарева сечения была вдвое выше в парах, где женщина была старше 35 лет и мужчина старше 40 лет, по сравнению с парами, где обоим родителям было по 20–29 лет [100].
Последствия для потомства
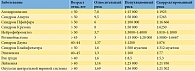
Чем старше мужчина на момент зачатия, тем выше риск возникновения у его детей врожденных дефектов, обусловленных генными и геномными мутациями и хромосомными аномалиями. Возраст мужчин коррелирует с повышенным риском развития аутосомно-доминантных заболеваний, нейрокогнитивных расстройств и злокачественных новообразований у их детей. Некоторые из наиболее распространенных заболеваний потомства, которые могут быть связаны со зрелым и пожилым возрастом мужчины на момент зачатия, приведены в таблице [10, 99].
Q. Yang и соавт. выполнили популяционное ретроспективное когортное исследование 5 213 248 случаев рождений в США за 1999–2000 гг. Риск врожденных дефектов повышался на 15% в группе детей, где возраст отцов при зачатии превышал 50 лет. Скорректированные отношения шансов для любого врожденного дефекта составили 1,04, 1,08, 1,08 и 1,15 соответственно для детей, рожденных от отцов в возрасте 30–35, 40–44, 45–49 и старше 50 лет (тест для тренда, p = 0,0155), по сравнению с детьми, рожденными от отцов в возрасте 25–29 лет. Позднее отцовство ассоциировалось с повышенным риском развития у ребенка пороков сердца, трахеопищеводного свища, атрезии пищевода, других аномалий соединительной ткани и опорно-двигательного аппарата [101].
Наиболее подробно изучены в связи с поздним отцовством точечные мутации, вызванные заменой одиночных пар оснований ДНК. Так, наблюдался повышенный риск мутаций рецептора фактора роста фибробластов FGFR2 и FGFR3, связанных с повышенным риском возникновения ахондроплазии и синдрома Аперта соответственно [102, 103]. Мутация гена RET, которая вызывает синдром множественной эндокринной неоплазии, – еще один пример генетического нарушения почти исключительно отцовского происхождения, которое существенно зависит от возраста мужчины при зачатии [104].
Была предположена связь между ростом заболеваемости раком у детей и возрастом их отцов на момент зачатия. Так, например, детская лейкемия имеет общепопуляционный риск 1:25 000, а для детей отцов старшей группы он возрастает до 1:17 000 с относительным риском 1,5 [105]. Увеличение заболеваемости неходжкинской лимфомой было зарегистрировано в случаях позднего отцовства, независимо от возраста матери [106, 107]. Аналогичные данные в отношении педиатрических опухолей центральной нервной системы были зарегистрированы B.H. Yip и соавт., риск развития составил 1:21 302 по сравнению с общим риском для населения 1:36 000 [108]. В Северной Корее изучили риск развития рака молочной железы женщин, чьи отцы на момент зачатия были старше 40 лет. Выявлено 1,6-кратное увеличение частоты рака молочной железы по сравнению с теми, чьи отцы на момент зачатия были моложе 30 лет. Авторы объясняют этот результат укорочением длины теломер у потомства возрастных отцов [109].
Шизофрения и другие психические расстройства как следствия позднего отцовства, возможно, являются результатом de novo мутаций, которые обусловливаются ошибками копирования ДНК [110]. Расстройство аутистического спектра у ребенка имеет значительную связь с возрастом отца на момент зачатия [111]. У детей, родившихся от мужчин в возрасте 40 лет и старше, в 5,75 раза (р < 0,001) чаще выявляются расстройства аутистического спектра по сравнению с потомством мужчин моложе 30 лет. J.E. Buizer-Voskamp и соавт. на основании исследования голландского реестра 14 231 пациента и 56 924 контрольных случаев сообщают, что у мужчин старше 40 лет шансы иметь ребенка с расстройством аутистического спектра в 3,3 раза выше, чем у мужчин моложе 20 лет. Авторы также выявили достоверную связь возраста отца на момент зачатия > 35 лет (отношение шансов = 1,27) с риском развития шизофрении у детей [112]. К тем же выводам относительно заболеваемости шизофренией пришли B. Miller и соавт. Относительный риск для самой возрастной группы отцов (≥ 50 лет) в исследовании составил 1,66 по сравнению с более молодыми отцами. Процент относительного риска составил 10% для мужчин старше 30 лет и 5% для мужчин моложе 25 лет [113].
Кроме того, изучалось влияние позднего отцовства на развитие других психоневрологических заболеваний, таких как биполярное расстройство и эпилепсия. Дети, рожденные от мужчин 55 лет и старше, страдали биполярным расстройством в 1,37 раза чаще, чем дети, рожденные от мужчин 20–24 лет [114]. M. Vestergaard и соавт. в популяционном исследовании когорты 96 654 детей показали, что у отцов в возрасте от 35 лет и старше вероятность иметь ребенка с эпилепсией несколько больше, чем у отцов в возрасте 25–29 лет [115].
Стратегии преодоления
Среди факторов, которые могут негативно влиять на качество спермы, отмечают агрессивную внешнюю среду, варикоцеле, системные и эндокринные причины, такие как сахарный диабет, ожирение и метаболический синдром. Необходимо помнить о коррелирующей соответственно возрасту мужчины более длительной экспозиции негативных факторов: табакокурения, употребления алкоголя, неполноценного питания, хронических заболеваний, способных нарушить целостность ДНК сперматозоидов.
Цикл развития сперматозоида составляет 72–76 дней, то есть при выявлении и смягчении поддающихся коррекции факторов можно ожидать улучшения некоторых параметров эякулята уже через три месяца адекватной прегравидарной подготовки. Улучшение мужского здоровья до зачатия может повысить частоту благоприятных исходов беременностей путем повышения мужского биологического и генетического вклада в зачатие и вынашивание потомства [116, 117].
Образ жизни и хронические заболевания
Посещение бань и саун, ношение тесного белья и малоподвижный образ жизни ведут к гипертермии органов мошонки. При гипертермии наблюдается снижение количества сперматозоидов и их прогрессивной подвижности, растет выраженность окислительного стресса [118].
Ксенобиотики, полихлорированные бифенилы, длительная экспозиция выхлопными газами снижают качество эякулята и повышают индекс фрагментации ДНК [119]. Такие повреждения, как правило, приводят к бесплодию и привычному невынашиванию беременности [120]. Кадмий и свинец являются основными токсичными тяжелыми металлами внешней среды, которые вызывают неблагоприятные последствия для здоровья человека и животных [121]. Вклад негативного воздействия электромагнитного излучения растет с увеличением спроса на устройства связи. У животных, подвергшихся воздействию электромагнитного излучения, были зарегистрированы повышенный уровень продуктов перекисного окисления липидов, недостаток антиоксидантов, таких как мелатонин, витамин Е и глутатионпероксидаза [122].
Социальные привычки изучены довольно подробно. Установлена сильная связь между курением и ухудшением качества спермы [123–125]. Табакокурение ассоциировано с более низким количеством сперматозоидов с нормальной морфологией и уровнем тестостерона. Никотин и смолы, существенно повышая окислительное повреждение ДНК, угнетают систему антиоксидантной защиты [123].
Психологический стресс прежде всего снижает сывороточный уровень общего тестостерона с вторичным повышением в сыворотке крови уровней лютеинизирующего и фолликулостимулирующего гормонов, тем самым изменяя качество спермы. В этой связи психотерапия стресса является оправданным шагом для мужчин с бесплодием. Стресс также приводит к нарушению гомеостаза и несбалансированности антиоксидантного статуса, нарушая целостность ДНК [126, 127].
Хронические заболевания являются стрессом для организма и так или иначе влияют на фертильность, поэтому крайне важно при планировании беременности добиться их компенсации или ремиссии у обоих партнеров. Следует помнить, что некоторые лекарственные препараты также могут вызывать изменения параметров эякулята [128].
Исследования фертильности мужчин при метаболическом синдроме и ожирении показали, что увеличение индекса массы тела ассоциировалось со снижением объема яичек, низким количеством сперматозоидов, нарушением их подвижности, повышенной фрагментацией ДНК сперматозоидов, низким уровнем тестостерона в сыворотке крови, снижением либидо и эректильной дисфункцией [129–131].
Плохо контролируемый сахарный диабет также связан с угнетением сперматогенеза. Выявлена положительная корреляция между уровнем глюкозы в сыворотке крови и индексом фрагментации ДНК сперматозоидов и отрицательная – с общей антиоксидантной способностью эякулята [132, 133].
В сравнительном исследовании выявлено повышение индекса фрагментации ДНК, а также снижение подвижности сперматозоидов и низкая их жизнеспособность в группе мужчин с артериальной гипертонией по сравнению с мужчинами, имеющими нормальное артериальное давление [134].
Антиоксидантная терапия
Ожидаемое нарастание окислительных процессов с возрастом обусловливает тот факт, что пожилые люди более склонны к АФК-индуцированной дисфункции эякулята [37, 135]. В зрелом возрасте отсутствие естественных антиоксидантных защитных механизмов (вследствие распространенной витаминно-минеральной недостаточности) может усугублять последствия окислительного стресса, сопутствующего старению [136]. Дефицит семенных антиоксидантов, которые защищают клетки от повреждения, индуцированного свободными радикалами (в общей когорте бесплодных мужчин), обосновывает назначение бесплодным мужчинам комплексов антиоксидантов [70]. Следует отметить, что в пользу назначения оральных антиоксидантов свидетельствует отсутствие серьезных побочных эффектов [137].
В идеале пероральный антиоксидант должен достигать высоких концентраций в репродуктивном тракте и восполнять дефицит элементов, жизненно важных для сперматогенеза. Антиоксидантная добавка должна усиливать способность семенной плазмы к поглощению и снижению уровня АФК [138]. Тем не менее производство АФК не должно быть полностью подавлено, поскольку это может привести к нарушению нормальной функции сперматозоида (например, низкие уровни АФК необходимы для процессов капацитации и гиперактивации) [149–151].
Добиться равномерного замедленного высвобождения и создания оптимальной концентрации, не подавляющей естественные процессы функционирования клеток, совместить жиро- и водорастворимые антиоксидантные компоненты – первоочередные задачи при разработке комбинированных оральных добавок. Это оказалось возможным благодаря использованию нанотехнологии Actielease – микрокапсулирование, или разделение активных ингредиентов на микроскопические наночастицы. Данная технология используется при производстве препарата АндроДоз.
Исследования показали, что пероральная терапия антиоксидантами, как правило, значительно улучшает параметры эякулята. Предполагается, что витаминные добавки могут быть особенно эффективны у мужчин зрелого возраста [152]. Некоторые из разработок показали положительный эффект приема пероральных витаминов и антиоксидантов мужчинами с бесплодием. Эти исследования продемонстрировали благоприятное влияние на параметры эякулята. Во многих работах наблюдалось повышение частоты достижения беременностей у женщин, чьи партнеры получали витамины А и Е, селен, цинк, L-карнитин и коэнзим Q10 [128, 143–169].
Следует отметить удачное сочетание компонентов в препарате АндроДоз. При приеме препарата достигается восстановление концентрации требуемых для сперматогенеза метаболических кофакторов, аминокислот, витаминов, микронутриентов: L-аргинина, L-карнитина, L-карнозина, коэнзима Q10, глицирризиновой кислоты, цинка, витамина Е, витамина А, селена. Некоторые компоненты АндроДоза проявляют синергизм, то есть при использовании в комбинации действуют намного сильнее и обусловливают выраженный эффект в гораздо более низких дозах, чем при применении по отдельности.
L-карнитин. Антиоксидант. Играет роль в подвижности сперматозоидов [143]. Повышает клеточную энергию в митохондриях, защищает мембраны сперматозоидов и ДНК от апоптоза, индуцированного АФК [144]. L-карнитин естественным образом присутствует в придатке яичка и семенной плазме, поддерживая подвижность сперматозоидов и их созревание [145].
L-аргинин. Биологически активный изомер условно незаменимой аминокислоты аргинина. Белки семенной жидкости почти на 80% состоят из L-аргинина, и его дефицит может приводить к нарушению сперматогенеза и бесплодию. L-аргинин благотворно влияет на здоровье предстательной железы, усиливает сперматогенез, участвует в упаковке ДНК сперматозоидов [146, 147]. Кроме того, L-аргинин активно участвует в регуляции эректильной функции. Будучи предшественником оксида азота, поддерживает хороший ток крови в мужских половых органах, способствует нормализации эрекции [148].
Коэнзим Q10 (убихинон). Мощный антиоксидант, способный восстанавливать активность других антиоксидантов, в частности альфа-токоферола (витамина Е), обладает доказанным клиническими исследованиями синергизмом с L-карнитином. Убихинон показал себя как достаточно эффективное средство при идиопатической олигоастенотератозооспермии (ОАТ-синдроме), улучшая подвижность, концентрацию и морфологию сперматозоидов. Кроме того, установлено, что Q10 влияет на экспрессию генов, участвующих в передаче сигналов клеток человека, процессах метаболизма и внутриклеточного транспорта. Убихинон ингибирует перекисное окисление липидов клеточных мембран, обеспечивая сохранность ДНК [149–151].
L-карнозин. Природный компонент тканей человека, мощный водорастворимый антиоксидант. Усиливает эффект жирорастворимых антиоксидантов, таких как альфа-токоферол [152]. В эксперименте нейтрализовал тяжелые металлы, предотвращал отравление организма различными токсинами [153]. Защищает репродуктивную систему от вредных воздействий, стимулирует сперматогенез и улучшает подвижность сперматозоидов [154].
Селен (Se). Важен для метаболизма тестостерона, составная часть митохондриальной капсулы сперматозоида. Применение селена субфертильными пациентами статистически значимо повышало подвижность сперматозоидов [155]. Селен также может защищать от окислительного повреждения ДНК в клетках спермы человека. Имеет выраженный синергетический эффект с витаминами А и Е, уменьшает их распад, снижая при этом потребность организма в данных витаминах. В опытах на мышах комбинация селена и витамина Е продемонстрировала защитный эффект в отношении сперматозоидов в условиях окислительного стресса и апоптоза после гипертермии [156].
Солодка голая (Glycyrrhiza glabra). Корни и корневища солодки содержат глицирризиновую кислоту, а также флавоноиды, в совокупности оказывающие противовирусное, противогрибковое, противовоспалительное, противоаллергическое, иммуномодулирующее, тонизирующее действие [157]. Глицирризиновая кислота подавляет активность компонента свертывающей системы – тромбина, в том числе присутствующего в сперме и участвующего в процессе ее сгущения, обладает муколитическим действием, уменьшая вязкость и увеличивая объем эякулята [158]. Благодаря мощному антиоксидантному эффекту способствует снижению фрагментации ДНК клеток [159].
Пюрамекс (Puramex) ZN (лактат цинка). Молочнокислая форма цинка, наиболее легко усваиваемая в пищеварительном тракте. Цинк активирует глутатионпероксидазу, необходимую для нормального созревания и подвижности сперматозоидов, а также участвует в регуляции активности других ферментов спермоплазмы, способствует регуляции процессов коагуляции и разжижения эякулята [160]. Дефицит цинка может приводить к серьезному повреждению яичек: атрофии канальцев и торможению дифференцировки сперматид [161]. Использование цинка как мощнейшего антиоксиданта и стимулятора клеточного деления считается перспективным методом лечения мужчин, страдающих бесплодием, вызванным токсичными компонентами сигаретного дыма [124]. Витамины A и Е – синергисты цинка, взаимно биохимически усиливают метаболизм и терапевтический эффект [162, 163].
Витамин Е (токоферол). Предотвращает повреждение клеточных стенок, нейтрализуя пероксид водорода и другие АФК. Необходим для роста новых клеток, нормального функционирования иммунной системы. Доказано, что прием витамина Е снижает значение коэффициента окислительного стресса в ткани яичек, повышает подвижность сперматозоидов и положительно влияет на их способность проникать в яйцеклетку [164]. Витамин E проявляет синергизм с ретинолом и селеном [165, 166].
Витамин А (ретинол). Защищает клеточные мембраны от окисления, влияет на синтез белков и поддерживает репродуктивную функцию, участвует в дифференцировке половых клеток. Витамин А в семенной жидкости необходим для нормального сперматогенеза и поддержания подвижности сперматозоидов. Кроме того, витамин А улучшает усвоение цинка и усиливает его антиоксидантное действие [167].
В российском многоцентровом открытом исследовании через три месяца от начала приема АндроДоза было отмечено статистически значимое повышение общего количества активно подвижных сперматозоидов (А + В). По окончании терапии количество патологических форм сперматозоидов снизилось на 26,32% (р = 0,0001). Данный показатель нормализовался у 100% пациентов с исходным критическим увеличением (> 96% патологических форм). Кроме того, на фоне приема АндроДоза достоверно повысился уровень ингибина B. К моменту завершения курса 87,6% пациентов отметили хороший и выраженный эффект от проведенной терапии [168].
По данным другого российского открытого сравнительного исследования, прием АндроДоза пациентами с идиопатической патоспермией в течение трех месяцев приводил к увеличению объема эякулята на 45,7%, концентрации сперматозоидов – на 18,5%, общей их подвижности – на 33,7%, активной подвижности – на 38,4% и количества морфологически нормальных форм – на 50% [169]. Таким образом, применение добавки АндроДоз способствует улучшению подвижности сперматозоидов и количества жизнеспособных форм, обусловливает нормализацию вязкости эякулята, увеличивает уровень тестостерона.
В исследованиях было продемонстрировано снижение выраженности окислительного стресса и индекса фрагментации ДНК на фоне приема компонентов препарата. С учетом механизмов повреждения сперматогенной функции с возрастом, это может служить обоснованием для прегравидарной подготовки мужчин старше 35 лет даже при отсутствии патологии эякулята.
Варикоцелэктомия
Варикоцеле отводят роль одной из основных причин бесплодия у мужчин, но вопрос о механизмах повреждающего действия остается открытым. У пациентов с варикоцеле изменения сперматогенеза объясняют несколькими факторами: рефлюксом из почечной вены токсических метаболитов, гипоксией яичек из-за венозного застоя, гормональной дисфункцией, венозной гипертензией и гипертермией [170]. Для этой категории пациентов характерны повышенное содержание в эякуляте АФК и сниженная общая антиоксидантная активность [171]. Кроме того, у мужчин с нормоспермией и варикоцеле выявляется повышенный индекс фрагментации ДНК [172].
В некоторых исследованиях было показано, что варикоцелэктомия может быть полезна для пожилых мужчин с нарушением репродуктивной функции [173–175]. A. Zini и соавт. провели исследование с участием 115 мужчин в возрасте от 40 лет и старше и 466 мужчин моложе 40 лет с клиническим варикоцеле и бесплодием. Не было выявлено существенных различий в исходных параметрах спермы и частоты спонтанных беременностей у партнерш пациентов, перенесших варикоцелэктомию, в группах моложе 40 лет и 40 лет и старше (39 против 49% соответственно). Тем не менее скорость достижения спонтанной беременности у женщин, партнеры которых были в возрасте 40 лет и старше и подверглись варикоцелэктомии, была значительно выше, чем у женщин, чьи партнеры от 40 лет и старше входили в контрольную группу и не получили хирургическое лечение (49 против 21% соответственно, р < 0,05) [176].
Многоцентровое исследование Всемирной организации здравоохранения показало, что мужчины с длительно установленным диагнозом варикоцеле (более 30 лет) имели значительно более низкие уровни тестостерона по сравнению с молодыми мужчинами. Было выдвинуто предположение о дисфункции клеток Лейдига как о механизме бесплодия [177]. Однако связь варикоцелэктомии и выраженности окислительного стресса оценивается не так однозначно. Некоторые исследования показали, что процент достижения беременностей был сопоставим в парах, где мужчинам была выполнена операция, и в парах, где мужчины не получали хирургическое лечение [178]. P.D. Kantarzi и соавт. рекомендуют избегать хирургического вмешательства в случае хронического варикоцеле у мужчин пожилого возраста [179].
Варикоцелэктомия и применение витамина Е и коэнзима Q10 привели к более эффективному восстановлению параметров эякулята, нежели оперативное вмешательство без приема микронутриентов [180–182].
Было проведено российское исследование, где в качестве послеоперационной медикаментозной поддержки больных, перенесших рентгенэндоваскулярную склеротерапию тестикулярных вен, использовалась комплексная антиоксидантная добавка АндроДоз. У мужчин, перенесших варикоцелэктомию и принимавших АндроДоз, наблюдались восстановление параметров эякулята, улучшение морфологии, увеличение концентрации и прогрессивной подвижности сперматозоидов в отличие от пациентов группы контроля (p < 0,001) [183].
Криоконсервация, или «социальная заморозка»
Тенденция отсрочки родительства в связи с немедицинскими и социально-культурными причинами влияет на репродуктивный успех из-за возрастного снижения рождаемости. В то время как вопрос о процедуре и сроках криоконсервации ооцитов интенсивно обсуждается, эффектам старения мужских половых клеток практически не уделяется внимания. Криоконсервация сперматозоидов здоровых мужчин по социальным показаниям – «социальная заморозка» предложена как вариант сохранения фертильности и эпигенетической целостности сперматозоидов для пар, которые откладывают планирование детей. Генетическая консультация рекомендуется для пар, в которых мужчина старше 40 лет [184].
Заключение
В исследованиях были продемонстрированы различные молекулярные механизмы и их эффекты, ассоциированные с возрастом мужчины: мутации ДНК, хромосомные аберрации и эпигенетические модификации. Разнообразные этиологические факторы были связаны с повышением уровня повреждения ДНК сперматозоидов. Эти молекулярные процессы ведут к изменениям в гормональном профиле половых гормонов, снижают качество эякулята и способствуют развитию мужского бесплодия. Эти изменения также несут ответственность за различные виды врожденных заболеваний и имеют отрицательную корреляцию с благоприятными репродуктивными исходами естественного зачатия или методов вспомогательных репродуктивных технологий [185].
Мужчинам зрелого и пожилого возраста, которые планируют иметь детей, следует рассказать о рисках для потенциального здоровья будущего потомства. В настоящее время нет скрининга или диагностических алгоритмов и панелей, направленных на диагностику у детей заболеваний, связанных с возрастом отца при зачатии. Несмотря на то что большое количество тестов доступны для оценки различных аспектов целостности ДНК, выполнение данных тестов не рекомендуется комитетом Американского сообщества репродуктивной медицины. Результат исследования фрагментации ДНК не может повлиять на терапию, поскольку в арсенале урологов и андрологов из доказанно эффективных методик имеются только варикоцелэктомия и антиоксидантная терапия. Дискретной точки отсчета, с которой начинается возрастное отцовство, нет, однако пары должны быть информированы о том, что риск развития заболеваний у потомства будет возрастать, поскольку напрямую зависит от возраста отца. Несмотря на повышенный риск, беременность с участием возрастного отца следует наблюдать, как и любую другую, в соответствии с рекомендованными принципами пренатальной диагностики и ведения беременности [4, 186].
Ye.A. Yefremov, Ye.V. Kasatonova, Ya.I. Melnik, V.V. Simakov
N.A. Lopatkin Scientific Research Institute of Urology and Interventional Radiology – Branch of National Medical Research Radiological Center of the Ministry of Healthcare of the Russian Federation
Contact person: Yelena Vladimirovna Kasatonova, kasatonova@yandex.ru
Here, we review the data from modern studies on medical aspects of advanced paternal age. Increasing amount of couples of older age plan to have children, perhaps being unaware of elevated infertility risk and unfavorable reproductive outcomes. Advanced paternal age is associated with altered hormone profile, decreased sexual function and disturbed spermatogenesis. Advanced paternal age at conception was found to be related to increased risk of sperm DNA damage, de novo mutations, miscarriage, congenital defects and diseases in progeny. Despite the fact that treatment strategies for optimizing impaired fertility in men of mature and senile age have been poorly investigated, there is a number of efficient methods such as adjusted life style and use of antioxidant supplements.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.