Применение нитрофуранов при инфекции мочевых путей
- Аннотация
- Статья
- Ссылки





В последнее время к ним увеличивается интерес из-за низкого уровня резистентных штаммов возбудителей мочевой инфекции, в то время как отмечается рост устойчивости E.coli к триметоприм/сульфаметоксазолу (ТМП/СМХ), ампициллину, амоксициллину, защищенным бета-лактамам, хинолонам.
Практикующие врачи должны быть знакомы с данными о резистентности возбудителей в том или ином регионе и учитывать их при принятии решений о назначении эмпирической терапии по поводу ИМП, т. к. резистентность возбудителя к применяемому препарату повышает риск неэффективности проводимого лечения.
В течение последних 9 лет НИИ антимикробной химиотерапии (Смоленск) и кафедра клинической фармакологии Смоленской государственной медицинской академии в сотрудничестве с ведущими урологическими клиниками Российской Федерации проводят серию исследований по единым шифрам UTIAP, которые направлены на изучение спектра возбудителей и мониторинг антибиотикорезистентности основных уропатогенов.
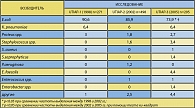
Всего проведено три исследования: UTIAP-1 (1998 г.), UTIAP-2 (2002 г.) и UTIAP-3 (2005 г.). (1) (таблица 1 и 2).
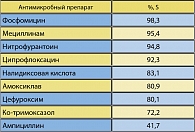
Антибиотики и антимикробные препараты, уровень резистентности к которым превышает 20% – ампициллин и ко-тримоксазол по критериям, принятым международными сообществами (IDSA,EAU, AUA), не могут рассматриваться как средства эмпирического выбора для терапии амбулаторных ИМП. Антибиотики, обладающие высокой микробиологической активностью в отношении основных возбудителей амбулаторных неосложненных ИМП (в первую очередь E.coli), – фторхинолоны (ципрофлоксацин, норфлоксацин), цефалоспорины II-III (цефуроксим, цефтибутен), нитрофурантоин. Не все из перечисленных антимикробных препаратов, несмотря на высокую микробиологическую активность, имеют одинаковое клиническое значение для терапии неосложненных ИМП. Кроме уровня резистентности в регионе, необходимо учитывать такие характеристики, как безопасность и переносимость, фармакокинетический профиль, доказанную в клинических испытаниях эффективность препарата. Высокой активностью против E.coli, выделенной у пациентов с неосложненными ИМП, обладают цефалоспорины II-III поколения (цефуроксим и цефтибутен). В то же время b-лактамы в целом менее эффективны при терапии ИМП по сравнению с фторхинолонами, т. к. при их введении достигаются более низкие концентрации в моче. Именно поэтому b-лактамные антибиотики нельзя использовать для терапии ИМП короткими курсами (3-5 дней). К третьей группе можно отнести препараты, уровень резистентности к которым является промежуточным, – примитивные хинолоны и амоксициллин/клавуланат. Резистентность уропатогенных E.coli к ранним («примитивным») хинолонам, налидиксовой и пипемидиновой кислотам в России относительно низкая (8,9%), однако в 2 раза превышает уровень резистентности к фторированным хинолонам – норфлоксацину, ципрофлоксацину, левофлоксацину. Ранние хинолоны необходимо принимать не реже 4 раз в сутки для создания достаточных концентраций в моче, что резко снижает комплаентность пациентов к этим уросептикам. Сравнительные клинические испытания, проведенные у пациентов с неосложненными ИМП, выявили достоверно более высокий микробиологический эффект и лучшую переносимость фторхинолонов (норфлоксацин) по сравнению с ранними хинолонами (налидиксовая кислота). Учитывая угрозу роста антибиотикорезистентности в целом и к возбудителям ИМП в частности, необходимо принимать во внимание свойство ранних хинолонов индуцировать развитие резистентности не только к самим ранним хинолонам, но и к фторхинолонам (1).
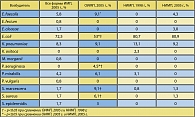
По данным исследований антибиотикорезистентности у возбудителей мочевой инфекции у амбулаторных больных в Москве (исследования UTIAP с 1998 по 2005 гг.), основными возбудителями амбулаторных ИМП являются представители семейства Enterobacteriaceae, которые были выделены в 86% случаев. При этом наиболее частым уропатогеном является E.coli, которая встречалась у 90% пациентов. Другие возбудители встречались значительно реже. В 16% случаев были выделены другие представители семейства Enterobacteriaceae: Klebsiella spp., P.mirabilis и Enterobacter spp., в то время как грамположительные микроорганизмы – Staphylococcus spp., Enterocccus spp. и S.agalactiae – в 10,% случаев.
В таблице 3 представлены возбудители неосложненной (НИМП) и осложненной (ОИМП) инфекции мочевых путей у амбулаторных пациентов в разные временные интервалы в Москве (2).
При осложненных инфекциях нижних мочевых путей достоверно реже встречается E.coli (53% и 80,9%) и достоверно возрастает доля таких возбудителей как P.aeruginosa (4,5% и 0%) и E.faecalis (9,1% и 4,2%).
При исследованиях UTIAP доля неосложненных ИМП составляла 37,6%, а осложненных – 38,8%. (2)
Одним из самых частых осложняющих факторов является мочекаменная болезнь и, как следствие, наличие конкрементов в почках или мочевыводящих путях – 48,5%. Другими частыми осложняющими факторами были: сахарный диабет – 24,2%, значительно реже встречались состояния после операций – 3,%, инфравезикальная обструкция – 6,1% и др.
Данные по резистентности E.coli , как самого частого возбудителя мочевой инфекции, представляют наибольший интерес и являются основой для дальнейшего использования в практических руководствах по рекомендациям выбора препаратов для эмпирической терапии неосложненной инфекции мочевых путей.
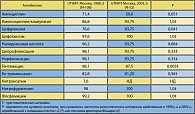
Данные по исследованию чувствительности основного возбудителя НИМП кишечной палочки представлены в таблице 4.
Полученные данные демонстрируют различный уровень резистентности E.сoli к бета-лактамным антибиотикам. Обращает на себя внимание высокая частота выделения резистентных штаммов E.сoli к ампициллину (28,6-43,75%)1. Факт высокой устойчивости E.сoli к ампициллину не изменился с течением времени, более того отмечается тенденция к росту. Высокий уровень резистентных штаммов к ко-тримоксазолу не позволяет рекомендовать его для эмпирической терапии НИМП в Москве, а данные по резистентности E.coli к нитроксалину (93,4% – резистентных штаммов) позволили даже исключить его из исследований UTIAP в 2004-2005 гг.
Сидоренко С.В. с соавторами (3) при исследовании 375 штаммов – возбудителей мочевой инфекции в Москве, также подтверждает приоритет кишечной палочки среди всех возбудителей НИМП. Далее, значительно отставая по значимости, следуют Klebsiella spp, Proteus spp, Enterobacter, из грамположительных – Enterococcus faecalis. Штаммы кишечной палочки были высокочувствительны к нитрофуранам – 88%, в частности к нитрофурантоину. Критерии эффективности к фуразидину и калиевой соли фуразидина в настоящее время не разработаны. Однако, среднегеометрические значения МПК этих соединений значительно ниже, чем у нитрофурантоина, что свидетельствует об их большей антибактериальной активности.
Полученные в ходе исследования данные значительно не отличаются от данных других исследований по изучению резистентности возбудителей мочевой инфекции. Среди грамотрицательных возбудителей число чувствительных штаммов к ко-тримоксазолу отмечено в 47-75%.
В то же время обращает на себя внимание рост резистентных штаммов к хинолонам. Так, чувствительность к налидиксовой кислоте среди энтеробактерий отмечена в 70,8-79%, а к ципрофлоксацину – в 82,3-85,7% соответственно (3). Это, конечно, связано с тем, что в исследовании принимали участие не только больные с неосложненной, но и с осложненной инфекцией мочевых путей, и мужчины с бактериальным простатитом.
Интересны данные североамериканского объединенного исследования инфекций мочевых путей (North American Urinary Tract Infection Collaborative Alliance-NAUTICA) по выяснению чувствительности к широко применяемым антибактериальным препаратам возбудителей амбулаторных ИМП (неосложненных и осложненных), выделенных в разных областях США и Канады. Исследование проводилось в 41 медицинском центре (30 – в США и 11 – в Канаде). В период с апреля 2003 по июнь 2004 года включительно каждый Центр представил до 50 возбудителей. Интерес представляет исследование влияния возраста и пола на резистентность возбудителей. В случае ампициллина резистентность была более высокой у людей в возрасте до 14 лет включительно, а резистентность к ТМП/СМХ была наименьшей у женщин в возрасте от 15 до 50 лет, в то же время статистически достоверных различий в обоих случаях не было выявлено. Резистентность к фторхинолонам (ципрофлоксацину и левофлоксацину) увеличивалась с возрастом и была более высокой у мужчин, чем у женщин, являясь наиболее высокой у мужчин в возрасте от 65 лет и старше (p<0,05). Резистентность к нитрофурантоину не была связана с возрастными и половыми особенностями.
Наиболее высокой резистентность E. coli (n=1142) была к ампициллину (37,7%), за ней следовал ТМП/СМХ (21,3%), ципрофлоксацин (5,5%), левофлоксацин (5,1%) и нитрофурантоин (1,1%). Резистентность ко всем антибиотикам была выше в США по сравнению с Канадой. Так для ампициллина эти показатели составили 39,3% и 33%, ТМП/СМХ – 22,6% и 17,7%, ципрофлоксацина – 6,8% и 1,1%, левофлоксацина – 6,4% и 0,7% и нитрофурантоина – 1,4% и 0% соответственно (p<0,05).
Результаты настоящего исследования показывают, что частота резистентности к ампициллину среди всех изолятов составила 45,9%, а к ТМП/CМХ – 20,4%. Эти данные согласуются с результатами ранее проведенных исследований, показавшими, что резистентность к ампициллину и ТМП/СМХ в Северной Америке продолжает расти. Общая резистентность к нитрофурантоину имела место у 14,3% изолятов. Этот показатель достаточно велик и, по-видимому, отражает тот факт, что лишь 57,5% изолятов были E.coli и значительную часть выделенных микроорганизмов составляли такие энтеробактерии, как Klebsiella spp. и Proteus spp., относительно резистентные к действию нитрофурантоина. Очевидно, что сбор мочи осуществляли не только у женщин с неосложненным циститом и уретритом, но и у женщин в постменопаузе, и у пациентов обоего пола с асимптоматической бактериурией (осложненная ИМП). В то же время эти данные имеют большую практическую ценность, т. к. отражают реальную клиническую практику. Среди E.coli частота резистентности к нитрофурантоину составила 1,1%. Данные о резистентности к ципрофлоксацину (9,7%) и левофлоксацину (8,1%) согласуются с полученными ранее. Эти результаты указывают на то, что подобные препараты следует назначать обоснованно, для того, чтобы предотвратить рост резистентности к ним (4).
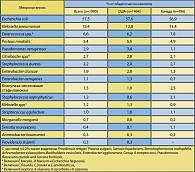
Последнее международное эпидемиологическое исследование по изучению антибиотикорезистентности возбудителей неосложненной инфекции мочевых путей (ARESC) завершено в 2006 году. В исследовании приняли участие 10 стран, в том числе и Россия. Исследованы возбудители цистита из 61 медицинского центра, 10 центров – из России. Среди возбудителей неосложненной инфекции мочевых путей E.coli выделена в 76,3%, S.saprophyticus – 3,6%, Klebsiella pneumonia – 3,5%, Proteus mirabilis – 3,1%, Enterococcus faecalis – 3%, на долю других видов семейства Enterobacteriaceae приходится 6,4%, другие представители грамположительной флоры – 3,7% (таблица 6).
Таким образом очевидно, что процент резистентных штаммов к нитрофурантоину кишечной палочки во всех исследованиях составляет менее 5%. Чувствительность грамположительной флоры, в частности Enterococcus faecalis и S.saprophyticus, этиологическое значение которых в последнее время увеличивается, приближается к 100%. Это обстоятельство не могло остаться без внимания, что подогрело наш интерес к нитрофурановым препаратам вообще, и к фурамагу, в частности.
История нитрофуранов
История клинического применения нитрофуранов или производных 5-нитрофурана начинается с 1943-1947 гг. после открытия M. Dodd и W. Stilman лечебного эффекта фурациллина (5).
Препараты нитрофуранов являются классическими синтетическими химиотерапевтическими средствами с широким антимикробным спектром действия. Крайне важно то, что нитрофурановые препараты не являются общими ферментативными ядами, а проявляют строго селективное воздействие на определенные ферментативные системы. Столь длительное присутствие нитрофурановых препаратов в списке первой линии для лечения мочевой инфекции обусловлено тем, что они обладают уникальным антимикробным механизмом действия на патогенную микрофлору – влияние на клеточное дыхание (6).
На сегодняшний день наиболее популярными нитрофуранами, используемыми в урологии для химиотерапии инфекционных заболеваний являются:
- Нитрофурантоин (Фурадонин) – впервые был синтезирован в США в 1952 году.
- Фуразидин (Фурагин) – оригинальный препарат, созданный в институте органического синтеза АН Латвии в 1954 году.
- Фурамага капсулы 50 мг – оригинальная лекарственная композиция фурагина растворимого с магния карбонатом основным была разработана сотрудниками ИОС АН Латвии О.Н. Акифьевым, Г.М. Гринбергом, М.Я. Паберзой, А.П. Гилевым и главным урологом СССР А.Я. Пытелем в 1986-87 г.г. Антимикробная активность нитрофуранов
Антимикробный спектр действия нитрофуранов включает микроорганизмы – возбудителей как урологической, так и кишечной инфекций. К ним относятся грамотрицательные микроорганизмы: E.coli, Shigella spp, Salmonella spp, Proteus spp, Klebsiella spp, Aerobacter aerogenes и грамположительные аэробные бактерии: Staphylococcus spp, S.pyogenes, E.faecalis, Corynebacterium spp, патогенные грибы – candida albicans, Microsporum spp, некоторые простейшие: Trichomonas vaginalis, Lamblia intestinalis, Entamaeba hystolytica. (7).
Говоря об общей характеристике нитрофурановых препаратов по степени активности «in vitro» по МПК и бактерицидным концентрациям следует отметить, что они, конечно, уступают фторхинолонам и антибиотикам широкого спектра действия. Имеется различие в степени активности отдельных нитрофуранов.
Механизм действия нитрофуранов складывается из нескольких факторов (6, 7, 8).
Выступая в качестве акцепторов водорода, они вступают в конкурентные отношения с естественными акцепторами водорода в цепи окислительных процессов. Нитрофураны, восстанавливаясь в культуральной среде, отвлекают электроны (водород) с их нормального метаболического пути, тем самым тормозят клеточное дыхание и препятствуют образованию энергии, необходимой для роста и размножения микробной клетки. Препараты подвергаются внутриклеточной трансформации, происходит процесс восстановления нитрогруппы под действием бактериальных флавопротеинов. В результате образуются метаболиты нитрофуранов, которые оказывают цитотоксическое действие. Препараты ингибируют биосинтез ДНК микроорганизмов и в меньшей степени – РНК. Механизм действия нитрофуранов до конца не изучен, однако он специфичен только для препаратов этой группы. Именно поэтому нитрофураны активны в отношении большинства бактерий, устойчивых к антимикробным препаратам других классов химических веществ (7). Биологические жидкости (кровь, сыворотка крови, моча, ликвор), также как новокаин не снижают антибактериальную активность нитрофуранов. Антагонистами нитрофуранов являются витамины группы В и хинолоны.
Резистентность к нитрофуранам носит перекрестный характер только в пределах данного класса веществ. Штаммы бактерий, устойчивые к бета-лактамам, аминогликозидам, злорамфениколу, фторхинолонам, тетрациклинам, сульфаниламидам остаются чувствительными к нитрофуранам. Необходимо изучать биохимические механизмы резистентности развития лекарственной устойчивости бактерий к нитрофуранам. Однако, проблема лекарственной резистентности к нитрофуранам клинического значения не имеет, т. к. несмотря на длительное применение в медицинской (с1950-х) и ветеринарной практике (с 1994 г) и выделение в настоящее время чувствительных к нитрофуранам штаммов возбудителей можно прогнозировать дальнейшее успешное применение некоторых препаратов этой группы.
Переносимость, побочные реакции, противопоказания к применению
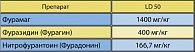
Нитрофураны обладают узкой терапевтической широтой и применяются в низких терапевтических дозах. Рекомендуемые дозы необходимо строго соблюдать. Превышение дозировок связано с существенным риском нежелательных реакций. Нитрофурантоин более токсичен, чем фуразидин (фурагин) и фурамаг (таблица 7). Нитрофураны вызывают теже нежелательные побочные реакции, что и другие лекарственные препараты. Со стороны желудочно-кишечного тракта могут быть боль и тошнота, неприятные ощущения, редко – потеря аппетита, еще реже – диарея и рвота. Со стороны печени возможно транзиторное повышение трансаминаз. Аллергические реакции на нитрофураны могут проявляться в виде кожной сыпи и зуда, артралгий и миалгий, эозинофилии, лихорадки. К числу редких нежелательных побочных реакций, специфичных для нитрофуранов и требующих особого внимания врача, относятся:
- реакции со стороны дыхательной системы (острый пневмонит – боль в области грудной клетки, кашель, затрудненное дыхание, повышение температуры тела) чаще встречаются у больных пожилого возраста обычно обратимы после прекращения лечения (7). В урологической практике пневмонит описан только у пожилых больных, чаще мужчин, находящихся в домах престарелых, получавших нитрофурантоин в течение длительного времени – 12 месяцев (9);
- реакции со стороны нервной системы в виде головокружения, сонливости и состояния усталости, головной боли, полинейропатий, мышечная слабость;
- гематологические реакции: гранулоцитопения, лейкопения, анемия, снижение агрегации тромбоцитов, очень редко – гемолитическая анемия (7).
Риск нежелательных побочных реакций повышается при почечной и печеночной недостаточности, при совместном применении с препаратами, угнетающими кровотворение, у больных с дефицитом глюкозо-6-фосфатдегидрогеназы. Нитрофураны нельзя назначать детям первого месяца жизни из-за высокого риска развития гемолитической анемии в связи с недостаточным возрастным развитием ферментных систем.
Нитрофурантоин
Активность нитрофурантоина является энзимозависимой и уникальной среди антимикробных препаратов, вследствие множественных механизмов действия. Препарат вмешивается в бактериальные энзимные системы, включая синтез ДНК и РНК, метаболизм карбогидрата и других метаболических энзимных протеинов (10).
Нитрофурантоин – слабая кислота, экскретируется в почках путем гломерулярной фильтрации и тубулярной секреции, достигая высоких концентраций в моче, которые отчасти зависят от рН мочи. Так как это слабая кислота, наличие кислой реакции мочи увеличивает количество препарата, реабсорбируемого из почечных канальцев; наоборот, при щелочной реакции мочи уменьшается реабсорбция препарата и огромное количество лекарственного препарата затем экскретируется, приводя к большой концентрации в моче (10). После приема соды, за счет образования водорастворимой натриевой соли, увеличивается выделение препарата с мочой. Он быстро метаболизируется в тканях организма. В результате в сыворотке крови остаются низкие концентрации препарата относительно мочи, возможно окрашивание мочи в коричневый цвет. Терапевтические концентрации достигаются только в моче. Прием препарата с едой увеличивает биоактивность на 40%, и увеличивает длительность терапевтической концентрации в моче. Связь с белками крови – средняя – 60%. Биотрансформация: 2/3 препарата быстро метаболизируются и инактивируются в большинстве тканей организма, включая печень. Период полувыведения у пациентов с нормальной функцией почек составляет от 20 минут до 1 часа и примерно половина препарата экскретируется в активной неизмененной форме. Пациенты с почечной недостаточностью (клиренс креатинина менее 50 мл/мин) должны избегать приема нитрофурантоина для предотвращения кристаллурии и возможных нежелательных побочных реакций лекарственной аккумуляции. При гемодиализе препарат выводится (11).
Имеется две разных формы нитрофурантоина: макрокристаллы дозируются 4 раза в день и модифицированная моногидрат-макрокристальная форма, которая позволяет дозировать 2 раза в день (12). Форма макрокристаллов обеспечивает задержку выделения и небольшое уменьшение биоактивности из желудочно-кишечного тракта, в то время как модифицированная форма моногидрата задерживает усвоение желудком, благодаря уникальному гелевому матриксу, и позволяет увеличить интервал дозирования (10).
Фуразидин
Фурагин является слабой кислотой и, благодаря наличию в молекуле активного водорода, способен образовывать соли (6). Замещение атома водорода на атом калия приводит к получению калиевой соли фурагина – солафур. Однако в присутствие углекислого газа и паров воды, или в присутствии соляной кислоты в желудке, происходит обратная реакция, в результате которой из солафура образуется фурагин.
В эксперименте на мышках показано, что интенсивное всасывание препарата происходит в дистальном отделе тонкого кишечника, транспорт фурагина осуществляется путем пассивной диффузии (13).
Исследования по экскреции препарата (таблетки по 50 мг) показали, что при приеме препарата до еды максимальная концентрация фурагина достигалась через 6 часов и составляла 20,06+5,33 мкг/мл. Аналогичные показатели при приеме препарата после еды составили соответственно 2 часа и 22,6+2,27 мкг/мл. При этом при приеме препарата на голодный желудок в первые 4 часа после применения препарата его концентрация в моче была в среднем в 2 раза ниже, чем в случае приема таблеток фурагина после еды (14).
Фурамаг
Было установлено, что совместное выделение солафура с магния карбонатом основным позволяет снизить пирофорность солафура и существенно повысить биодоступность препарата при его оральном введении. В институте органического синтеза АН Латвии на основе калиевой соли фурагина в сочетании с магния карбонатом основным в соотношении 1:1 удалось разработать оптимизированную лекарственную форму фуразидина для перорального применения под торговым названием «Фурамаг». Магния карбонат основной препятствует превращению калиевой соли фуразидина в кислой среде желудка в фурагин и обеспечивает в тонкой кишке более полное всасывание препарата в виде хорошо растворимой калиевой соли. Биодоступность фуразидина, содержащегося в фурамаге в 2,5-3 раза выше, чем биодоступность фурагина. Более высокая степень биодоступности фуразидина в виде фурамага позволяет получить терапевтический эффект в меньших дозах. При применении фурамага перорально калиевая соль фуразидина быстро всасывается, выводится почками путем канальцевой секреции и клубочковой фильтрации. В моче достигаются высокие концентрации калиевой соли фуразидина, превышающие бактериостатические более, чем в 50 раз (таблица 8).
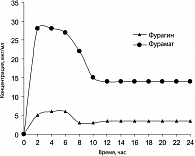
Максимальная концентрация в моче калиевой соли фуразидина определяется через 3-4 часа после перорального приема. При применении фурамага в крови достигаются более высокие концентрации препарата, чем других нитрофуранов. Это является основанием для более подробных исследований возможного системного действия препарата (7). При исследовании фармакокинетики фурамага и фурагина биодоступность фурамага выше в среднем в 2,5 раза (15) (таблица 9).
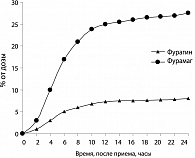
Данные сравнительных исследований таблеток фурагина 50 мг и капсул Фурамага 50 мг, выполненные на 19 добровольцах, приведены на рисунках 1 и 2. Как видно из представленных результатов, Фурамаг создает концентрацию препарата в моче почти в 6 раз превышающую аналогичный показатель для таблеток фурагина. При этом биологическая доступность Фурамага примерно в 2,5-3 раза выше, чем у таблеток фурагина 50 мг при одинаковых дозах введения (16).
Клиническое применение
Клиническое применение фурамага при урологических заболеваниях показало их высокую клинико-бактериологическую эффективность. Еще в 1982 году при лечении цистита, пиелита, уретрита, простатита, эпидидимита у 63 пациентов в дозе по 50 мг 3 раза в день в течение 7-10 дней отмечена хорошая эффективность и переносимость препаратов (17). При исследовании 355 штаммов возбудителей мочевой инфекции в 70-94% случаев выявлены чувствительные штаммы E.coli, Staphylococcus spp., E. Faecalis. Устойчивыми были Proteus spp., K. Pneumonia, P.aeruginosa (18) в Харьковской медицинской академии постдипломного образования при изучении клинической эффективности фурамага при ИМП у женщин и у мужчин (96 пациентов) в монотерапии по 50 мг 3 раза в день в течение 7-10 дней. Препарат был высокоэффективен при лечении уретрита у мужчин, а у женщин – хронического цистита или эндоцервицита. Препарат был слабо эффективен при лечении хронического эпидидимита, что обьяснимо, т.к. тканевые концентрации нитрофуранов крайне низкие. Из побочных реакций авторы отметили неприятные ощущения, тошноту у 4,87% больных, которые не потребовали отмены препарата (19).
По данным многоцентрового проспективного открытого контролируемого сравнительного исследования клинической и бактериологической эффективности препарата Фурамаг при лечении 105 больных острым неосложненным циститом в Москве (20) выздоровление достигнуто в 92,6% и 96%, 5 и 7-дневные курсы лечения соответственно. Побочные действия в виде тошноты зарегистрированы в 4,8% случаев. Только 2 больных прекратили лечение из-за нежелательных побочных реакций.
Бактериологическая эффективность (Е.coli, Staphylococcus saprophyticus, Enterococcus faecalis) отмечена в 94% и в 97% соответственно.
В НИИ урологии Росмедтехнологий в 2007 г проведено открытое клиническое постмаркетинговое исследование препарата фурамаг для лечения инфекционно-воспалительных урологических заболеваний. В исследование были включены взрослые больные, обоих полов, с бактериологически доказанной неспецифической инфекцией мочевых путей (ИМП) при наличии чувствительности к фуразидину. На основании указанных критериев в исследование было включено 40 пациентов. Препарат назначали внутрь, после еды, запивая большим количеством жидкости, по 50–100 мг 3 раза в сутки. Курс лечения – 5-7-10 дней; при необходимости курс повторяли. Разные режимы дозирования обусловлены тем, что мы отбирали больных строго по чувствительности микроорганизмов к фурагину, не только с острым циститом, но и с персистирующей, рецидивирующей инфекцией мочевых путей.
Возраст пациентов был от 18 до 79 лет, средний возраст – 37,58 года, из них: 5 мужчин и 35 женщин. Средняя длительность заболевания до обращения составила 1,12 года.
Распределение пациентов по диагнозам представлено в таблице 10.
У всех пациентов, включенных в исследование, в посевах мочи до лечения определялся рост микроорганизмов, чувствительных к фуразидину (таблица 11).
После лечения у 35 пациентов достигнута полная эрадикация возбудителей, т. е. отличный результат. У четырех пациентов отмечено снижение микробного числа микроорганизмов, в частности: у пациента с хроническим бактериальным простатитом и со смешанной мочевой инфекцией: E.coli +Enterococcus faecalis 106 до лечения после 10‑дневного курса лечения фурамагом отмечено снижение микробного титра энтерококка до 104 и эрадикация кишечной палочки, что конечно можно расценить как положительный результат лечения. У женщин с персистирующей инфекцией, рецидивирующим циститом после 5 дней лечения отмечено клиническое улучшение состояния и снижение микробного числа Enterococcus faecalis на 2 Lg с 104 до 102. Эрадикация одного из возбудителей у пациентки при смешанной инфекции и снижение микробного титра у второго возбудителя (E.coli + Enterococcus faecalis c 108 до E.coli в 102; E.coli+ Staph.spp. 104 до Staph.spp 102 после лечения). Результаты лечения этих 4-х пациентов расценены как хорошие, т.к. микробный титр 102 КОЕ/мл является клинически незначимым титром.
Только у одной пациентки результаты лечения расценены как неудовлетворительные: у женщины с хронической инфекцией мочевых путей на фоне мочекаменной болезни (микролит в правой почке) и циститом на фоне 5-ти дневного лечения фурамагом произошла смена возбудителя: до лечения выделяли Staphylococcus epidermidis 10 в 4 степени, после лечения – Streptococcus adalactae 10 в 4 степени, хотя Streptococcus adalactae является нормальной микрофлорой влагалища (контрольные посевы мочи производились через 2-3 недели т. н. «периода очищения», т. е. пациенты не принимали никакой противовоспалительной терапии).
Хорошая и отличная бактериологическая эффективность фурамага при лечении ИМП продемонстрирована у 39 пациентов, что составило 97,5%, у 1 пациентки (2,5%) бактериологический эффект отсутствовал. Хорошая клиническая эффективность отмечена у 35 пациентов (87%).
Только одна пациентка отметила головокружение на фоне приема фурамага, после лечения головокружение прекратилось. Остальные больные нежелательных побочных реакций во время терапии фурамагом не отметили. Аллергических реакций, связанных с приемом препарата, у пациентов не отмечено. Таким образом, переносимость препарата была отличной у 39 пациентов (97,5%).
Такие хорошие результаты лечения объясняются тщательным отбором больных для лечения фурамагом. Как видно из таблиц мы в основном отбирали больных с колибациллярной и энтерококковой инфекцией, которые наиболее чувствительны к фурамагу. Учитывая рост и значимость энтерококковой инфекции мочевых путей в последнее время, а также возрастающую резистентность возбудителей мочевой инфекции ко многим антибиотикам наблюдается ренессанс нитрофуранов, эффективность и безопасность которых проверена временем.
Нитрофураны еще долгое время будут в арсенале врачей для лечения неосложненной и осложненной инфекции мочевых путей, при лечении асимптоматической бактериурии у беременных, а также в качестве профилактики рецидивирующей мочевой инфекции и санации мочевых путей перед урологическими операциями, дистанционным дроблением камней, эндоскопическими операциями и другими урологическими операциями.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.