Роль питания в профилактике сердечно-сосудистых заболеваний. Пищевые продукты
- Аннотация
- Статья
- Ссылки
- English
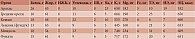
![Таблица 1. Диетические рекомендации для каждой группы пищевых продуктов, предложенные Научным комитетом AESAN по безопасности пищевых продуктов и питания [5]](/upload/resize_cache/iblock/c3b/195_350_1/Pogozheva1.jpg)
Потребление пищевых продуктов из разных групп в сбалансированных пропорциях обеспечивает адекватное поступление пищевых веществ и биологически активных веществ (БАВ) с потенциальной пользой для здоровья человека [1–4].
Продемонстрировано, что разнообразная и сбалансированная диета на основе пищевых продуктов растительного происхождения (фрукты, овощи, бобовые, злаки, орехи и т.д.) по сравнению с рационом, включающим продукты животного происхождения, способствует укреплению здоровья, а также снижает отрицательное воздействие на окружающую среду [5].
По данным комиссии Eat-Lancet, постоянное предпочтение здорового питания могло бы ежегодно уменьшать на 19,0–23,6% общую смертность в мире (10,8–11,6 млн человек) [6]. Неадекватный режим питания отрицательно влияет на окружающую среду и ставит под угрозу благополучие, качество жизни и выживание нынешнего и будущих поколений [7, 8].
Разработаны рекомендации по потреблению различных групп пищевых продуктов (табл. 1).
Фрукты и овощи
Употребление достаточного количества фруктов и овощей жизненно важно для рациона здорового питания, связанного с более низким риском ССЗ. Европейское общество кардиологов (ESC) и Комитет по питанию Американской кардиологической ассоциации настоятельно рекомендуют ежедневное употребление нескольких порций фруктов и овощей для снижения риска ССЗ. Эти рекомендации основаны на данных эпидемиологических исследований и метаанализов [9, 10].
Недавний метаанализ 83 исследований (71 клиническое испытание и 12 обсервационных исследований) показал, что более высокое потребление фруктов или овощей в значительной степени обратно связано с уровнями С-реактивного белка (СРБ) и фактора некроза опухоли (ФНО) альфа (р < 0,05) и напрямую – с повышенной пролиферацией популяций гамма-дельта-Т-клеток [9].
Результаты поперечного исследования HELENA свидетельствуют, что потребление фруктов и орехов было отрицательно связано с уровнем интерлейкина (ИЛ) 4 и ФНО-альфа у 464 подростков (13–17 лет) из европейской когорты [10].
В поперечном анализе у 1005 китайских женщин в возрасте от 40 до 70 лет была изучена связь между потреблением овощей и маркерами воспалительного и окислительного стресса. Результаты показали, что более высокое потребление овощей семейства крестоцветных связано с более низкими концентрациями ФНО-альфа, ИЛ-1-бета и ИЛ-6 в сыворотке крови. Во всех случаях наблюдалась связь между потреблением крестоцветных овощей и маркеров окислительного стресса (F2-изопростаны и 2,3-динор-5,6-дигидро-15-F2t-IsoP) [11].
Общеизвестно, что население большинства стран употребляет недостаточно овощей и фруктов. Только 12,2 и 9,3% взрослых американцев соответствуют рекомендациям по питанию на 2015–2020 гг. для американцев в части ежедневного потребления овощей и фруктов соответственно. Американцы из группы с низким уровнем дохода едят меньше овощей и фруктов, чем из группы с более высоким уровнем дохода. Это является ключевым социально-экономическим неравенством в общем качестве рациона питания. Разработаны программы стимулирования потребления овощей и фруктов, которые используют мотивации для поощрения покупок этой группы пищевых продуктов. Преобладающее количество исследований по тестированию таких программ свидетельствует об их положительном влиянии на покупку и/или потребление участниками овощей и фруктов [12].
Вино и другие ферментированные алкогольные напитки
В настоящее время имеется достаточно доказательств, что регулярное умеренное потребление ферментированных алкогольных напитков, в основном красного вина и пива, оказывает кардиозащитное действие и может положительно влиять на факторы риска ССЗ [13].
Вино. Четко идентифицированы фенольные соединения, которые оказывают положительное влияние на развитие атеросклероза. Потребление вина и его фенольных соединений уменьшает окисление холестерина липопротеинов низкой плотности (ХС ЛПНП) и окислительный стресс, а также увеличивает содержание NO, улучшая функцию эндотелия. Кроме того, этанол увеличивает уровень холестерина липопротеинов высокой плотности (ХС ЛПВП) и ингибирует агрегацию тромбоцитов, способствует фибринолизу и уменьшает системное воспаление [13, 14].
Исследования в течение семи лет многоэтнической выборки из 2900 здоровых женщин среднего возраста показали, что умеренное употребление вина может защитить от ССЗ. Это связано с более низкими концентрациями в крови пациенток маркеров воспаления (СРБ, фибриногена, фактора VII и PAI-1) по сравнению с трезвенниками или женщинами, пьющими мало вина [15].
В другом рандомизированном перекрестном исследовании у 67 мужчин с высоким риском ССЗ изучали влияние этанола и фенольных соединений из порции красного вина (30 г алкоголя в день), эквивалентной количеству деалкоголизированного красного вина, и джина (30 г алкоголя в день), в течение четырех недель на экспрессию воспалительных биомаркеров атеросклероза. Потребление 30 г алкоголя в составе красного вина в день способствовало увеличению плазменных концентраций ИЛ-10 и снижению хемокинов, полученных из макрофагов (MDC).
Фенольные соединения красного вина восстанавливали sICAM-1, E-селектин и ИЛ-6 и подавляли экспрессию LFA-1 в Т-лимфоцитах и экспрессию MAC-1 и CCR2 в моноцитах. Концентрации антигена CD40, лиганда CD40, ИЛ-16, MCP-1 и sVCAM-1 были понижены в обеих группах: этанол и фенольные соединения красного вина [16].
У 38 добровольцев-мужчин из группы высокого риска ССЗ (55–80 лет), которые получали 30 г этанола в день в виде выдержанного белого вина или джина в течение трех недель, в конце исследования экспрессия CD31 и CD40 в Т-лимфоцитах и экспрессия CCR2 и CD36 в моноцитах была ниже после употребления выдержанного белого вина. При употреблении белого вина у мужчин наблюдалось значительное снижение концентраций в плазме крови ИЛ-8 и ИЛ-18, sICAM-1 и sVCAM-1. Оба напитка показали значительное снижение экспрессии LFA-1, MAC-1, VLA4, CD40 и CD31, а также более низкие концентрации гамма-интерферона (IFN-гамма) [17].
Пиво. По сравнению с другими ферментированными напитками пиво имеет умеренное содержание полифенолов, но оказывает более сильное кардиозащитное действие, чем спиртные и безалкогольные напитки. Эпидемиологические исследования показали, что потребление пива в низких и умеренных дозах снижает риск ССЗ, аналогично умеренному потреблению красного вина [18].
Результаты обследования 7735 британских мужчин в течение 17 лет показали, что регулярное употребление пива было связано с более низкой общей смертностью.
Проведенное позже рандомизированное контролируемое исследование (РКИ) с участием 33 человек продемонстрировало лучшую динамику в сыворотке крови уровней ХС ЛПВП (на 5%) и адипонектина (на 7%) под влиянием пива и джина по сравнению с безалкогольным пивом: уровни ИЛ-1-альфа увеличились на 24%, а ИЛ-5 – снизились на 14%. Однако безалкогольное пиво снижало концентрацию в крови гомоцистеина (на 6%) и повышало уровень фолиевой кислоты (на 9%) [19].
Орехи
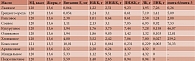
Важными источниками линоленовой кислоты (ЛНК), а также микроэлементов, полифенольных соединений, ФС и ПВ являются орехи и семена, которые снижают риск ССЗ [20, 21]. Орехи и семена помимо ЛНК содержат значительное количество кальция, магния и калия (табл. 2), которые считаются основными минералами, необходимыми для здоровья сердечно-сосудистой системы, главным образом для коррекции артериальной гипертензии (АГ) [22–24].
Кроме того, орехи и семена – источник белка. Несмотря на более низкие его уровни по сравнению с белком животного происхождения, потребление орехов и семян обратно коррелирует с заболеваемостью и смертностью от ССЗ [25, 26]. Количество ЛНК, которое содержится в одной унции (28 г) льняного семени, семян чиа, семян конопли, грецких орехов, превышает ее адекватный уровень потребления (1,1 г в день для женщин и 1,6 г в день для мужчин) [27].
В число орехов включают такие плоды деревьев и кустарников, как миндаль, бразильский орех, кешью, фундук, макадамия, пекан, фисташка, грецкий орех, каштан, буковый орешек, кедровый орех. Арахис, известный всем как орех, относится к бобовым культурам, однако поскольку по микронутриентному составу он близок к лесным орехам, то предположительно может обладать и сходными с ними полезными свойствами. Химический состав орехов представлен в табл. 2.
Из-за высокого содержания жира и, следовательно, высокой калорийности потребление орехов долгое время расценивалось как признак нездорового рациона. В то же время в большинстве случаев орехи, растущие на кустах и деревьях, богаты мононенасыщенными жирными кислотами (МНЖК) и полинасыщенными жирными кислотами (ПНЖК), в том числе омега-3, обладающими кардиопротекторными свойствами.
Наряду с этим орехи являются хорошим источником холина. Витаминоподобное вещество холин (который еще называют витамином В4) – липотропный фактор, активизирующий скорость расщепления жиров. Он синтезируется в организме с помощью аминокислоты метионина.
Другие биологически активные соединения, входящие в состав орехов: макро- и микроэлементы (селен, магний, медь, калий), ПВ, витамин Е, ФС (бета-ситостерин), аминокислоты, флавоноиды-антиоксиданты (их больше всего содержат пекан, фисташки, миндаль и фундук), – также могут способствовать улучшению кардиометаболического профиля у лиц с ССЗ (см. табл. 2) [28–30].
В многочисленных крупных РКИ показано, что орехи, особенно грецкие и арахис, снижают риск заболеваемости и смертности от ССЗ [31]. Употребление орехов связано с более значительной потерей массы тела, снижением уровня артериального давления (АД), ХС ЛПНП, гипергликемии и инсулинорезистентности, воспалительных и окислительных медиаторов, улучшением эндотелиальной функции [32].
В недавнем метаанализе было оценено 23 РКИ для изучения влияния употребления орехов на некоторые воспалительные биомаркеры (СРБ, sICAM-1, sVCAM-1, ИЛ-6, E-селектин, ФНО-альфа). Авторы обнаружили значительное снижение содержания sICAM-1 (на 0,17 нг/мл) после приема орехов [33].
Метаанализ 13 РКИ выявил снижение риска ишемической болезни сердца (ИБС) среди всех участников на 34% при максимальном уровне потребления орехов. Анализ показателя «доза – ответ» продемонстрировал, что увеличение потребления орехов на одну порцию в неделю было связано с 5%-ным снижением риска ИБС. Порция орехов во всех приведенных исследованиях составляет 1 унцию (28 г). Протекторный эффект в отношении ИБС был подтвержден в РКИ при потреблении участниками более двух порций орехов в неделю [34].
Метаанализ РКИ с участием 200 000 человек показал, что у лиц, в еженедельный рацион которых входило пять порций орехов, риск ИБС был на 20% ниже, чем у тех, кто не получал их в составе рациона. При этом не было выявлено связи между потреблением орехов и риском развития инсульта [31].
Метаанализ других РКИ, напротив, выявил более низкий риск инсульта на 12% (14 исследований) и 19%-ное снижение риска смерти от инсульта (7 исследований) у лиц с наивысшим потреблением орехов против групп с минимальным их потреблением [35].
Многоцентровое РКИ PREDIMED (2003–2011 гг.) проводилось с целью изучения эффективности средиземноморской диеты (MeDiet) с добавлением оливкового масла (ОМ) или орехов в качестве первичной профилактики сердечно-сосудистых катастроф у 7447 лиц старше 55 лет с высоким риском ССЗ. Участники получали следующие диеты: 1) MeDiet + ОМ; 2) MeDiet + орехи; 3) контрольная (гипохолестериновая) диета. После года наблюдения в группе MeDiet + орехи отмечалось статистически более выраженное снижение (на 13,7%) распространенности метаболического синдрома (МС) по сравнению с группой лиц, придерживавшихся диеты MeDiet + ОМ, и группой сравнения (на 6,7 и 2,0% соответственно).
Продемонстрировано положительное влияние диет MeDiet + ОМ и MeDiet + орехи на уровень АД, липидный спектр сыворотки крови, факторы воспаления, окислительный стресс и атеросклероз сонных артерий, а также на экспрессию генов проатерогенных соединений (ЦОГ-2, ИЛ-6, апо-A2, белок – переносчик холестеринового эфира и фактор транскрипции 7-like 2). Приверженность MeDiet с добавлением ОМ или различных орехов в течение 5 лет привела к снижению диастолического АД (ДАД) и риска ССЗ на 30% [36].
На основе данных РКИ PREDIMED было проведено моделирование потенциального снижения риска ССЗ при потреблении шведами в возрасте 55–79 лет 30 г орехов в день вместо фактически потребляемых 5 г в день. Результаты моделирования показали, что увеличение ежедневного потребления орехов с 5 до 30 г могло бы предотвратить 7680 случаев ССЗ и сохранить около 65 000 лет жизни [37].
Согласно данным Национального обследования здоровья и питания (NHANES, США; 2005–2010 гг.), лица, потребляющие различные виды орехов (≥ 7 г в день), имеют более высокий уровень ХС ЛПВП в крови и более низкий ИМТ, меньшую окружность талии и более низкий уровень систолического АД (САД), чем лица, которые потребляют орехов < 7 г в день [38].
Метаанализ 42 РКИ, среди участников которых 45% имели повышенный риск ССЗ, продемонстрировал влияние потребления различных орехов на липидный спектр крови. Более низкие концентрации в сыворотке крови общего холестерина (ОХС), ХС ЛПНП, апо-B, триглицеридов (ТГ) отмечались у пациентов, потреблявших не менее одной порции любых орехов в день [39].
Показано, что у 46 пациентов, принимавших статины, ежедневное потребление 100 г миндаля в течение четырех недель приводило к дополнительному снижению концентрации ОХС и ХС ЛПНП на 4,9% [40].
На основании метаанализа РКИ с участием 534 пациентов показано, что потребление миндаля способствовало значительному снижению в сыворотке крови уровня ОХС (-10,69 мг/дл), ХС ЛПНП (-5,83 мг/дл), ХС ЛПВП (-1,26 мг/дл) и апо-В (-6,67 мг/дл); а также снижению массы тела (-1,39 кг). Уровни ТГ, апо-А1, ЛП(а) не изменялись [29].
Достаточно часто высказываются опасения по поводу того, что повышенное потребление орехов с высоким содержанием жирных кислот и высокой калорийностью может привести к ожирению. В то же время европейское РКИ EPIC-PANACEA с участием 373 293 пациентов в возрасте 25–70 лет продемонстрировало, что увеличение массы тела за пять лет было значительно ниже среди лиц, получавших диету с самым высоким квартилем содержания орехов (медиана – 12,4 г в день). Более того, риск избыточной массы тела или ожирения был на 5% ниже у лиц с самым высоким квартилем потребления орехов по сравнению с теми, кто их не потреблял [41].
Данные эпидемиологических исследований подтверждают, что более высокое содержание орехов в изокалорийном рационе не приводит к увеличению массы тела. Включение орехов в диету может быть полезным для ее контроля, благодаря наличию белка и ПВ.
Показано, что диета с содержанием грецких орехов может способствовать снижению массы тела, сопоставимому с эффектом гипокалорийной диеты. Так, 100 мужчин и женщин с ожирением без СД получали диету с энергетической ценностью ≥ 1500 ккал/сут с включением в среднем 40 г грецких орехов в день или диету с калорийностью < 1500 ккал/сут, содержащую 28 г орехов. Таким образом, грецкие орехи обеспечивали приблизительно 15% от общего потребления энергии.
Применение обеих диет на протяжении шести месяцев способствовало снижению риска ССЗ. Уровень САД снизился в обеих группах через три месяца, сохраняясь в течение последующих шести месяцев. При этом диета с включением грецких орехов способствовала снижению уровня ОХС и ХС ЛПНП через шесть месяцев соответственно с 203 до 194 мг/дл и со 121 до 112 мг/дл (р < 0,05) [42].
Механизм влияния орехов на биомаркеры риска ССЗ (ожирение, АД и дислипидемия (ДЛП)) связан с наличием в них бета-ситостерина, который является структурным аналогом ХС и конкурирует с ним за абсорбцию в кишечнике, что приводит к более низкой концентрации циркулирующего ХС ЛПНП и потенциально может предотвратить образование жировых полос и пенистых клеток в субэндотелиальном пространстве артерий, и тем самым уменьшить риск развития ССЗ [30, 43].
Управление по санитарному надзору за качеством пищевых продуктов и медикаментов США (FDA) подтвердило фактические данные о связи между потреблением орехов и ССЗ, одобрив следующий постулат по влиянию орехов на здоровье: «Научные данные предполагают, но не подтверждают, что употребление 42,5 г различных орехов в составе диеты с низким содержанием насыщенных жиров и холестерина может снизить риск сердечно-сосудистых заболеваний». Видимо, поэтому с 1980 по 2018 г. американцы стали потреблять орехов больше в 5 раз [29].
Метаанализ 15 РКИ (n = 819 448) выявил более низкую смертность (на 20%) при самом высоком уровне потребления орехов по сравнению с самым низким потреблением. Максимальное снижение риска наблюдалось при увеличении потребления орехов до 15–20 г в день, или 5–6 порций в неделю. Установлено, что относительный риск смерти от инфекционных заболеваний снизился на 75% при увеличении потребления орехов (в сумме с арахисом) на одну порцию в день [44].
Биологически активные вещества, содержащиеся в орехах, могут оказывать влияние на окислительный стресс и воспаление, которые являются важными факторами укорочения теломер – признанных маркеров биологического старения. Предположили, что потребление орехов может увеличить продолжительность жизни путем влияния на длину теломер [45].
Регулярное потребление одной порции (28–30 г) орехов пять раз в неделю ассоциируется со значительным снижением риска ИБС в эпидемиологических исследованиях. В ряде РКИ показано, что ежедневное потребление орехов в составе диеты с низким содержанием незаменимых жирных кислот (НЖК) приводит к снижению в сыворотке крови уровня ХС ЛПНП [46].
Моделирующее исследование, в котором использовались данные NHANES за 2009–2012 гг. с участием 17 444 человек (в течение ≥ 1 года), показало, что замена стандартных перекусов между приемами пищи на изокалорийный «ореховый перекус» без добавления соли улучшает состав рациона за счет поступления эссенциальных микронутриентов, в том числе МНЖК, ПНЖК и ПВ, и не приводит к увеличению массы тела [47].
Результаты крупных проспективных когортных исследований показывают связь между регулярным потреблением орехов (≥ 140 г/нед) и снижением риска ИБС, риска смерти от всех причин и от хронических заболеваний. Поступление с рационом орехов снижает концентрацию ОХС в сыворотке крови и улучшает гликемический контроль у людей с СД 2-го типа. Высокое потребление орехов не приводит к увеличению массы тела; скорее, включение орехов в рацион может способствовать контролю массы тела и ее снижению, уменьшению окружности талии в условиях гипокалорийной диеты [48].
Грецкие орехи являются важным источником линоленовой кислоты [49, 50]. В двухлетнем исследовании 236 пожилых лиц, разделенных на две группы: контрольную – с рационом без орехов, и основную группу, в рацион которой входило около 30–60 г грецких орехов в день (15% энергии), в основной группе было обнаружено снижение уровня САД на 8,5 мм рт. ст. (при исходном выше 125 мм рт. ст.) и соответственно уменьшились дозы антигипертензивных препаратов по сравнению с контрольной группой [51].
Отмечено, что у женщин с избыточной массой тела и ожирением после шести месяцев рациона с добавлением грецких орехов (диета с содержанием 35% жира и 45% углеводов от общей калорийности) уровень ХС ЛПВП значительно повысился, в то время как на рационе с низким содержанием жира и углеводов – несколько снизился [52].
В другом исследовании 99 женщин с избыточной массой тела и ожирением были рандомизированы на три группы, получавшие низкокалорийные диеты: первая группа потребляла 300 г в неделю жирной рыбы (лосось) без растительных источников омега-3 ПНЖК; вторая группа – рацион, включающий 18 грецких орехов в неделю без других растительных источников омега-3 ПНЖК и рыбы; третья группа получала 150 г жирной рыбы и 9 грецких орехов в неделю, избегая потребления других источников омега-3 ПНЖК.
По сравнению с другими группами через 12 недель группа, получавшая рацион «рыба + грецкие орехи», показала большее увеличение уровня ХС ЛПВП (+3,6 мг/дл), снижение уровня САД (-5 мм рт. ст.), уровня глюкозы в крови натощак (-12 мг/дл), ХС ЛПНП (-6 мг/дл), высокочувствительного СРБ (-0,51 мг/л), D-димера (-0,45 мг/дл), фибриногена (-22 мг/дл), аланинаминотрансферазы (АЛТ) (-6 Ед/л), аспартатаминотрансферазы (АСТ) (-6 Ед/л), ФНО-альфа (-0,08 нг/мл) и ИЛ-6 (-1,6 нг/мл) [53].
В исследовании с участием 42 взрослых добавление 42 г орехов кешью в день было связано со значительным снижением уровня пропротеиновой конвертазы субтилизин-кексинового типа 9 (PCSK9) в плазме крови (270,8 против 252,6 нг/мл). Этот эффект, однако, не был связан с каким-либо значительным изменением уровня ХС ЛПНП в сыворотке крови и активного компонента, ответственного за ингибирование PCSK9 [54].
Семена
Льняное семя является важным источником линоленовой кислоты и оказывает благотворное влияние на показатели липидов и кардиометаболические биомаркеры. Так, в исследовании с участием 21 пациента с ИБС ежедневное потребление 30 г льняного семени в течение 12 недель способствовало снижению уровня СРБ (-1,18 мг/л), ИЛ-6 (-7,65 пг/мл) и ФНО-альфа (-34,73 пг/мл) по сравнению с контролем.
Ни в одной из групп не наблюдалось существенного изменения массы тела, что, по-видимому, является очень важным, поскольку предполагает, что льняное семя может улучшать сердечно-сосудистые показатели независимо от потери массы тела [55].
В метаанализе РКИ у пациентов добавленное в рацион льняное семя или его производные (целые или молотые семена льна, льняное масло, биологически активные добавки (БАД) с включением лигнанов) способствовали уменьшению концентрации в плазме крови СРБ и ФНО-альфа, но не изменили уровня ИЛ-6. Льняное семя было протестировано в виде цельного льняного семени, золотого льняного семени, льняного масла и добавок лигнана в дозировках от 360 мг до 60 г в течение 2–12 недель (в среднем 10 недель) [56].
По данным РКИ, 41 женщина в составе двух групп получали рекомендации по изменению образа жизни. Пациенткам первой группы добавляли 30 г в день коричневой муки из льняного семени в салат, йогурт или холодные напитки в течение 12 недель. Группа, получавшая льняное семя, продемонстрировала по сравнению с контролем значительные улучшения показателей инсулинорезистентности (HOMA-IR), уровня в плазме крови ТГ, высокочувствительного СРБ (вчСРБ), ИЛ-6, лептина, ХС ЛПВП и адипонектина, более значительное снижение в сыворотке крови концентрации ОХС (-31,71 мг/дл), ТГ (-1,33 мг/дл), ХС ЛПНП (-22,64 мг/дл), АЛТ (-11,12 Ед/Л), АСТ (-5,37 Ед/Л) и гамма-глутамилтрансферазы (-11,54 Ед/л), выраженности симптомов стеатоза печени [57].
В обеих группах наблюдалось снижение ИМТ (30,37 ± 4,42 до 28,05 ± 3,89 кг/м2 в группе, получавшей льняное семя плюс улучшение образа жизни, и от 33,37 ± 5,56 до 32,42 ± 5,98 в контрольной группе). Эти результаты подтверждают гипотезу о благотворном влиянии льняного семени независимо от изменений в потреблении энергии и составе тела [58].
В зеркальном РКИ с участием 98 пациентов те же исследователи наблюдали снижение частоты проявления МС на 76% у участников группы, потреблявших 30 г в день льняной муки (против 36,4% в контроле). Аналогичным образом обе группы в одинаковой степени снизили потребление калорий [59].
Масла
Масла, богатые ЛНК, являются важным средством для исследования ее эффектов. Несмотря на присутствие в масле других жирных кислот и жирорастворимых соединений, отсутствие клетчатки, витаминов, особенно водорастворимых, сводит к минимуму влияние этих факторов. Содержание омега-6 ПНЖК в маслах необходимо обязательно учитывать при рассмотрении в них количества омега-3, поскольку подсолнечное, кукурузное, ореховое, хлопковое, соевое и арахисовое масла являются важными источниками омега-6-ПНЖК (табл. 3).
Льняное, грецкое и рапсовое масла являются основными источниками ЛНК. Соевое масло содержит умеренное количество ЛНК, в диапазоне 2,7–7,8% [60]. Обычные масла, используемые для приготовления пищи, содержат как самые высокие, так и самые низкие концентрации ЛНК. Кроме того, основными источниками линолевой кислоты (ЛК) можно назвать масла подсолнечника, кукурузы, грецкого ореха, хлопкового семени, сои и арахиса. (Адаптировано из базы данных Министерства сельского хозяйства США (USDA).)
Льняное масло. Было исследовано воздействие 25 мл в день льняного масла или 25 мл в день подсолнечного масла, включаемых в течение семи недель в рацион 60 пациентов, страдающих МС. Уровни ИЛ-6 в сыворотке крови более значительно снизились в группе, получавшей льняное масло (от 9,37 до 7,90 пг/мл), по сравнению с подсолнечным маслом (от 9,22 до 8,48 пг/мл). Хотя эта дозировка считалась высокой, ни в одной из групп не сообщалось о побочных эффектах [61].
В исследовании с участием 60 женщин с гестационным СД ежедневное потребление в течение шести недель 2 г в день капсул льняного масла (800 мг ЛНК) способствовало большему снижению в крови концентрации ТГ (-40,5 мг/дл), инсулина (-2,2 мкЕд/мл) и вчСРБ (-1,3 мг/л) по сравнению с аналогичной группой, получавшей капсулы с подсолнечным маслом. В группе, получавшей льняное масло, также наблюдалось улучшение эффектов рецептора ЛПНП, пониженная экспрессия генов ИЛ-1 и ФНО-альфа, снижение уровня MDA и повышение нитритов и глутатиона [62].
В другом исследовании 59 взрослых с избыточным весом или ожирением и АГ I стадии получали по 10 г в день рафинированного льняного масла холодного отжима (4,7 г ЛНК) в течение 12 недель, что способствовало уменьшению содержания свободных жирных кислот (-58 мкмоль/л) и ФНО-альфа (-0,14 пг/мл) в плазме крови. Хотя потребление ЛНК в этом исследовании было примерно в 3–5 раз выше рекомендуемой суточной нормы, оно не улучшило показатели сердечно-сосудистых событий [63].
Известно, что индекс омега-3 (O3I) отражает относительное процентное содержание эйкозапентаеновой кислоты (ЭПК) и докозагексаеновой кислоты (ДГК) в мембранах эритроцитов и считается суррогатным биомаркером ССЗ. При исследовании у лиц с низким исходным уровнем омега-3 ПНЖК влияния БАД с рыбьим жиром или льняным маслом на O3I было обнаружено, что добавление 2,1 г в день длинноцепочечных омега-3 ПНЖК (1296 мг ЭПК + 864 мг ДГК) в течение восьми недель увеличивало O3I с 4,3 до 7,8%, с последующим постепенным снижением до 5,7% и до 3,8% через 4 и 16 недель после окончания периода приема БАД соответственно [64].
С другой стороны, добавление льняного масла (3510 мг ЛНК + 900 мг ЛК в день) за тот же период существенно не изменило O3I, но увеличило содержание не только ЭПК, но и омега-3-ДПК, которая находится между ЭПК и глюкокортикоидами (ГК) на пути десатурации. Было высказано предположение, что O3I выше 8% благоприятен для предотвращения ССЗ, в то время как ≤ 4% интерпретируется как низкий. Преимущества ЛНК в качестве кардиопротектора могут быть подкреплены ее ролью в качестве субстрата для ЭПК, обладающей провоспалительным действием [64, 65].
Соевое масло содержит умеренное количество ЛНК, и в нескольких исследованиях был продемонстрирован его умеренный положительный эффект. Так, у 52 пациентов, получавших 6 г в день льняного или соевого масла в течение 12 недель, отмечалось значительное снижение уровня инсулина в сыворотке крови (от 17,1 до 10,9 мкМЕ/мл и от 12,6 до 10,6 мкМЕ/мл соответственно) и значения HOMA (3,8–2,4 и 3,1–3,0 соответственно) при сравнении исходного уровня с окончанием вмешательства. Группа лиц, получавших льняное масло, имела более выраженную динамику показателей [66].
В другом исследовании 16 женщин с гиперхолестеринемией (ГХС) в течение десяти недель получали соевое масло в количестве 20% по калорийности в составе диеты (< 300 мг в день) для поддержания массы тела. Лица контрольной группы в течение восьми недель потребляли ту же диету, но без соевого масла. По сравнению с контролем уровни ОХС, ХС ЛПВП, ХС ЛПНП и малой плотности ХС ЛПНС (мпХС ЛПНС) были снижены в конце десятинедельного периода употребления соевого масла [77].
Рапсовое масло. В метаанализе 27 РКИ потребление рапсового масла было связано со снижением уровня ОХС на 7,24 мг/дл и ХС ЛПНП – на 6,4 мг/дл в сыворотке крови по сравнению с подсолнечным маслом и НЖК. В целом суточная доза рапсового масла варьировалась от 12 до 50 г в течение 21–180 дней. В большинстве исследований в этом метаанализе участвовали лица с нарушениями липидного обмена и пациенты с ССЗ, СД 2-го типа, ожирением, МС или неалкогольной жировой болезнью печени (НАЖБП) [68].
У 10 здоровых мужчин старше 25 лет через 24 часа отмечалось усиление окисления липидов под влиянием обогащения рациона питания рапсовым маслом по сравнению с обогащением пальмовым маслом, источником незаменимых жирных кислот (НЖК) [69].
Снижение уровня ХС под влиянием рапсового масла можно объяснить не только содержанием в нем МНЖК, причем наиболее распространенной является олеиновая кислота, составляющая примерно 54,5% от общего количества жирных кислот [70]. Значительное количество олеиновой кислоты в рапсовом масле может объяснить положительную динамику липидов и липопротеидов и снижение риска ССЗ [71]. Содержание ЛНК в рапсовом масле составляет 6–10% от общего количества жирных кислот [72].
Другие растительные источники МНЖК и ПНЖК могут иметь большую эффективность по сравнению с рапсовым маслом. Например, потребление кунжутного масла лучше контролировало гликемию по сравнению с рапсовым маслом у лиц с СД 2-го типа. В этом исследовании потребление рапсового масла способствовало повышению уровня глюкозы в сыворотке крови натощак (на 7,72 ± 3,15 мг/дл, р < 0,05). В то же время кунжутное масло снижало уровень инсулина в сыворотке крови (-6,00 ± 1,72 мМЕ/мл, р < 0,05) в течение 9-недельного периода вмешательства [72].
Оливковое масло. Несколько исследований и метаанализов продемонстрировали противовоспалительное действие диет, богатых ОМ [73, 74]. Биоактивные компоненты ОМ, основного ключевого продукта питания MeDiet, продемонстрировали снижение воспаления, окислительного стресса и эндотелиальной дисфункции [73].
В нескольких исследованиях PREDIMED сообщалось, что MeDiet с добавлением ОМ приводит к снижению уровней N-концевого промозгового натрийуретического пептида (NT-proBNP), увеличению толщины интима-медиа (ТИМ) у пациентов с повышенным исходным уровнем ТИМ, улучшению САД и ДАД как у пациентов с АГ, так и без АГ [75, 76].
MeDiet оказывала ингибирующий эффект на экспрессию генов, связанных с прогрессированием бляшек, таких как MMP-9, NF-kB или MCP-1, за счет увеличения IκB. Экспрессия гена киназы (IκBα) после приема MeDiet + ОМ стабилизирует молекулу NF-kB в цитоплазме, поддерживая ее в «неактивированном» состоянии [77].
Ежедневное потребление 30 мл ОМ или 30 мл ОМ с добавлением эпигаллокатехин-3-галлата (EGCG) у 82 субъектов (≥ 18 лет) с ранним атеросклерозом показало улучшение эндотелиальной функции, независимо от приема EGCG, через четыре месяца вмешательства. Однако группа OМ + EGCG продемонстрировала значительное снижение воспалительных параметров (sICAM-1, лейкоциты, моноциты и лимфоциты) [78].
Кроме того, было показано увеличение антиоксидантной (АО) способности плазмы, уровня АО-ферментов (каталазы и глутатионпероксидазы), а также улучшение экспрессии супероксиддисмутазы (СОД) у 45 здоровых взрослых (21–45 лет, ИМТ 21,4 ± 0,5 кг/м2), которые принимали 50 мл ОМ в течение 30 дней [79].
Прием ОМ, по-видимому, положительно влияет на функцию эндотелия. Наконец, в исследовании VOLOS (с потреблением ОМ первого отжима) участники с легкой ДЛП были рандомизированы в две группы (ежедневное потребление 40 мл ОМ с 166 мг/л гидрокситирозола по сравнению с очищенным ОМ вместе с 2 мг/л гидрокситирозола) в течение семи недель. Результаты показали значительное снижение уровня тромбоксана B2 (TXB2) на 20% в группах, получавших ОМ [80].
Морские водоросли
Использование морских водорослей для приготовления пищи и в качестве БАД набирает все большую популярность во всем мире [81]. Как функциональная пища, морские водоросли являются вегетарианским источником омега-3 ПНЖК, белка и микроэлементов [82]. Спирулина и хлорелла – коммерчески доступные экстракты биомассы цианобактерий и зеленых водорослей [83].
Спирулина и хлорелла часто считаются ценными источниками омега-3 ПНЖК. Однако надо учитывать, что для поступления 2–3 г общего количества липидов необходимо потребить примерно 28 г их в порошкообразной форме. Спирулина и хлорелла содержат не только макро- и микроэлементы, но также и соединения с антиоксидантными свойствами [84].
Показано, что ежедневное потребление от 1 до 10 г спирулины приводит к значительному улучшению липидного профиля за счет снижения ОХС на 47 мг/дл, ХС ЛПНП – на 41 мг/дл, ТГ – на 44 мг/дл, одновременно с увеличением ХС ЛПВП на 6 мг/дл. В этот метаанализ были включены семь плацебо-контролируемых РКИ продолжительностью 2–4 месяца с участием пациентов с СД, ССЗ и ДЛП. Эффективная и практичная доза спирулины составляла около 4 г в день в капсулах или порошке [85, 86].
Содержание омега-3 ПНЖК в спирулине не было единственным фактором, приведшим к положительным результатам. Добавление 300 мг в день хлореллы в течение восьми недель снижало уровни ФНО-альфа по сравнению с группой плацебо в РКИ с участием 70 пациентов с НАЖБП [87].
В восьминедельном РКИ были обследованы 44 женщины, страдающие первичной дисменореей, и получавшие хлореллу в дозе 1500 мг в день, под влиянием которой обнаружено снижение уровня вчСРБ (с 2590,00 ± 1801,66 до 974,21 ± 292,85 нг/мл) по сравнению с контролем [88].
Наряду с этим в японской выборке 40 таблеток хлореллы ежедневно потребляли 17 лиц с погранично высокими уровнями в крови глюкозы, ОХС и TГ, а также 17 здоровых лиц. После 16 недель приема БАД было обнаружено снижение содержания жира в организме, ОХС в сыворотке крови и уровня глюкозы в крови натощак в обеих группах [89].
A.V. Pogozheva, O.Sh. Oynotkinova
Federal Research Centre for Nutrition, Biotechnology and Food Safety
Scientific Research Institute of Healthcare Organization and Medical Management of the Department of Healthcare of the City of Moscow
Russian State Social University
Contact person: Alla V. Pogozheva, allapogozheva@yandex.ru
Currently, dietary recommendations for the prevention of CVD concern the optimization of the diet, which consists in reducing foods containing animal fats and increasing sources of dietary fiber, fish, whole grains, nuts, seeds, fruits and vegetables. It has been demonstrated that a varied and balanced diet based on plant-based foods (fruits, vegetables, legumes, cereals, nuts, seeds, etc.), compared with animal products, promote health and reduce negative environmental impacts. Data from epidemiological studies and meta-analyses indicate that eating enough fruits and vegetables is vital for a healthy diet associated with a lower risk of CVD. The European Society of Cardiology (ESC) and the Nutrition Committee of the American Heart Association strongly recommend the daily consumption of several servings of fruits and vegetables, nuts, and seeds to reduce the risk of CVD. Of all alcoholic beverages, it is preferable to take small amounts of red and white wine, as well as beer containing dietary antioxidants – polyphenols.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.