Роль селективной лазерной трабекулопластики в лечении заболевания первичного закрытия угла передней камеры
- Аннотация
- Статья
- Ссылки
- English
Материал и методы. Проспективное исследование включало 60 пациентов в возрасте от 47 до 80 лет с ПЗУ, из которых 30 с ПЗУ и 30 с начальной стадией первичной закрытоугольной глаукомы (ПЗУГ). Всем пациентам выполнена СЛТ при условии визуализации трабекулярной сети не менее чем 90°. Оценка эффективности проводилась на первые сутки, через неделю, один и шесть месяцев, ежегодно в течение трех лет на основании уровня ВГД, количества используемых местных гипотензивных препаратов, значений толщины слоя нервных волокон сетчатки, ганглиозного комплекса и средней световой чувствительности (MD). В качестве предикторов эффективности СЛТ изучены корнеальный гистерезис (КГ),
фактор резистентности роговицы (ФРР), центральная толщина роговицы (ЦТР), роговично-компенсированное ВГД (ВГДрк), глубина и угол передней камеры (УПК), толщина хрусталика (ТХ).
Результаты. В обеих группах во все периоды отмечалось достоверное снижение ВГД (все p < 0,05). К первому году выявлена достоверная разница в снижении ВГДрк при ПЗУ по сравнению с ПЗУГ (p = 0,048), которая сохранялась в течение всего последующего периода наблюдения (p = 0,008). Спустя три года среди пациентов с ПЗУ не отмечено признаков развития глаукомной оптической нейропатии (ГОН), а необходимость в гипотензивной терапии была достоверно ниже по отношению к ПЗУГ ко второму и третьему году наблюдения (p = 0,041 и p = 0,037 соответственно). Скорость прогрессирования ГОН при ПЗУГ составила 0,06 ± 0,68 дБ/год. Определены предикторы неудачи СЛТ в обеих группах: низкий КГ, высокое предоперационное ВГД и ФРР, меньшая ЦТР, узкий УПК, мелкая передняя камера и увеличенная ТХ (все p < 0,05).
Заключение. Эффективность СЛТ в отдаленном периоде при ПЗУ выше, чем при ПЗУГ, что обусловлено меньшим количеством гониосинехий, более глубокой ПК, менее увеличенной ТХ, а следовательно, большей протяженностью лазерного воздействия. СЛТ является альтернативным методом лечения ПЗУ по отношению к экстракции прозрачного хрусталика, предупреждая развитие ГОН.
Материал и методы. Проспективное исследование включало 60 пациентов в возрасте от 47 до 80 лет с ПЗУ, из которых 30 с ПЗУ и 30 с начальной стадией первичной закрытоугольной глаукомы (ПЗУГ). Всем пациентам выполнена СЛТ при условии визуализации трабекулярной сети не менее чем 90°. Оценка эффективности проводилась на первые сутки, через неделю, один и шесть месяцев, ежегодно в течение трех лет на основании уровня ВГД, количества используемых местных гипотензивных препаратов, значений толщины слоя нервных волокон сетчатки, ганглиозного комплекса и средней световой чувствительности (MD). В качестве предикторов эффективности СЛТ изучены корнеальный гистерезис (КГ),
фактор резистентности роговицы (ФРР), центральная толщина роговицы (ЦТР), роговично-компенсированное ВГД (ВГДрк), глубина и угол передней камеры (УПК), толщина хрусталика (ТХ).
Результаты. В обеих группах во все периоды отмечалось достоверное снижение ВГД (все p < 0,05). К первому году выявлена достоверная разница в снижении ВГДрк при ПЗУ по сравнению с ПЗУГ (p = 0,048), которая сохранялась в течение всего последующего периода наблюдения (p = 0,008). Спустя три года среди пациентов с ПЗУ не отмечено признаков развития глаукомной оптической нейропатии (ГОН), а необходимость в гипотензивной терапии была достоверно ниже по отношению к ПЗУГ ко второму и третьему году наблюдения (p = 0,041 и p = 0,037 соответственно). Скорость прогрессирования ГОН при ПЗУГ составила 0,06 ± 0,68 дБ/год. Определены предикторы неудачи СЛТ в обеих группах: низкий КГ, высокое предоперационное ВГД и ФРР, меньшая ЦТР, узкий УПК, мелкая передняя камера и увеличенная ТХ (все p < 0,05).
Заключение. Эффективность СЛТ в отдаленном периоде при ПЗУ выше, чем при ПЗУГ, что обусловлено меньшим количеством гониосинехий, более глубокой ПК, менее увеличенной ТХ, а следовательно, большей протяженностью лазерного воздействия. СЛТ является альтернативным методом лечения ПЗУ по отношению к экстракции прозрачного хрусталика, предупреждая развитие ГОН.






Первичная закрытоугольная глаукома (ПЗУГ) является одной из основных причин необратимой слепоты. По мере увеличения продолжительности жизни населения можно ожидать роста заболеваемости ПЗУГ. Согласно данным Y.C. Tham и соавт., количество людей во всем мире в возрасте 40–80 лет с закрытоугольной глаукомой в 2013 г. составило 20,17 млн, в 2020 г. прогнозировалось увеличение до 23,36 млн, а к 2040 г. – до 32,04 млн [1]. Риск двусторонней слепоты в случае ПЗУГ превосходит таковой при открытоугольной глаукоме в три раза [2].
ПЗУГ является результатом прогрессирования заболевания первичного закрытия угла (ЗПЗУ) [3] – от подозрения на первичное закрытие угла (ППЗУ) до первичного закрытия угла (ПЗУ) и далее развития ПЗУГ. ППЗУ характеризуется наличием иридотрабекулярного контакта (ИТК) протяженностью более двух квадрантов, нормальным внутриглазным давлением (ВГД), отсутствием периферических передних синехий и глаукомной оптической нейропатии (ГОН). ПЗУ диагностируют при наличии ИТК, приводящего к образованию периферических передних гониосинехий и/или повышению ВГД, но без ГОН. Если закрытие угла привело к глаукомному повреждению диска зрительного нерва (ДЗН), резюмируют ПЗУГ. При этом на момент осмотра могут отсутствовать гониосинехии и повышенное ВГД. Основным методом лечения ПЗУ и начальной стадии ПЗУГ является периферическая лазерная иридотомия (ПЛИТ) [4]. Тем не менее ряд авторов не отмечают улучшения гидродинамики после ПЛИТ [5]. Кроме того, риск развития ПЗУ не исключен как в ближайший [6], так и в отдаленный срок (6–18 месяцев) после лазерного вмешательства [7]. По данным оптической когерентной томографии переднего отрезка (AS-OCT), в 23,9–47,5% случаев могут отсутствовать постоперационные признаки увеличения размеров угла передней камеры (УПК) [8]. Авторы исследования EAGLE рекомендуют альтернативу ПЛИТ – экстракцию прозрачного хрусталика при ПЗУГ [9]. Вместе с тем четких рекомендаций относительно ПЗУ пока не существует [10]. Известен также способ комбинированного лечения ЗПЗУ с применением селективной лазерной трабекулопластики (СЛТ) в глазах с ранее выполненной ПЛИТ при условии достаточной визуализации трабекулярного аппарата глаза [11–13]. Выбор такого подхода обусловлен в том числе вынужденным использованием местной гипотензивной терапии после ПЛИТ с риском низкого комплаенса в долгосрочной перспективе, в том числе в силу экономической составляющей [14]. Долгосрочных исследований, посвященных сравнительной эффективности СЛТ при ПЗУ и начальной стадии ПЗУГ после раннее перенесенной ПЛИТ, недостаточно [15, 16].
Цель – оценить эффективность СЛТ после ранее выполненной ПЛИТ у пациентов с ПЗУ и сравнить ее с таковой при начальной стадии ПЗУГ.
Материал и методы
Исследование выполнено в соответствии с этическими принципами, заложенными в Хельсинкской декларации и отраженными в правилах качественной клинической практики (Good Clinical Practice, GCP) и нормативных требованиях. Согласно принятым критериям включения/исключения, отобрано 60 пациентов в возрасте 47–80 лет (30 с ПЗУ и 30 с начальной стадией ПЗУГ).
Критерии включения: пациенты с ПЗУ и начальной стадией ПЗУГ после раннее перенесенной ПЛИТ с декомпенсацией ВГД на местной гипотензивной терапии и/или с прогрессированием ЗПЗУ. Ключевое условие – визуализация трабекулярной сети не менее чем 90° и отсутствие гониосинехий в зоне предполагаемого воздействия.
Критерии исключения: недостаточно прозрачные оптические среды глаза, отсутствие устойчивой фиксации, медикаментозный миоз, хирургические операции на органе зрения в анамнезе, кроме ПЛИТ, дистрофические заболевания роговицы, исходно низкая плотность роговичных эндотелиальных клеток. В целях стандартизации оценки прогрессирования ГОН исключали пациентов с площадью ДЗН менее 1,5 и более 2,5 мм² (по данным оптической когерентной томографии, OКT).
Всем пациентам выполнены: авторефрактометрия (авторефрактометр HRK-7000A Huvitz, Южная Корея), визометрия (проектор знаков SZP 350 Carl Zeiss, Германия), тонометрия, (Ocular Response Analyzer, Reichert Technologies, США), гониоскопия (гониолинза VG4LNF VOLK, США), ОКТ заднего и переднего отрезка (RTVue-100, Optovue, США), пахиметрия (пахиметр SP-100 Tomey, Германия), конфокальная томография (Confoscan 4, Nidek, Япония), оптическая биометрия (Lenstar LS 900, Haag-Streit, Швейцария), статическая автоматическая периметрия (САП) (Humphrey Field Analyzer HFA-II 750i, CarlZeiss, Германия, программа SITA Standard 24-2), биомикроскопия (щелевая лампа SL 120 Carl Zeiss, Германия), офтальмоскопия (бесконтактная линза 78 D Volk Optical, США). Исследования выполнены в сроки: до СЛТ, на первые сутки, через неделю, месяц, шесть месяцев и ежегодно в течение трех лет.
За три недели до СЛТ аналоги простагландинов были заменены на ингибиторы карбоангидразы (ИК). СЛТ выполняли с использованием линзы SLT (Volk, США) на ND:YAG-лазере Laserex Solo (Ellex Medical Lasers Limited, Австралия) по методике, описанной ранее [11]. Степень послеоперационной воспалительной реакции оценивали в баллах: 0 – нет воспаления, 1 – снижена реакция зрачка на свет, 2 – смешанная инъекция, 3 – феномен Тиндаль во влаге передней камеры и преципитаты. С целью профилактики возможного реактивного воспаления всем пациентам сразу после СЛТ, а также в течение первых трех суток после операции назначали бромфенак один раз в день, для профилактики реактивной гипертензии – ИК Дорзопт однократно в день операции. Снижение ВГДрк ≤ 21 мм рт. ст. без применения дополнительной гипотензивной терапии либо с уменьшением количества местных гипотензивных препаратов по сравнению с предоперационными показателями расценивали как успех СЛТ.
Динамику функциональных и структурных изменений сетчатки и зрительного нерва оценивали методом САП, используя Glaucoma Progression Analysis [17] и данные толщины слоя нервных волокон сетчатки и ганглиозного комплекса сетчатки в результате ОКТ [18], выполняемых каждые три месяца на протяжении всего периода наблюдения.
Статистическая обработка полученных результатов проводилась с использованием стандартного пакета программ статистического анализа SPSS 16.0 for Windows. U-критерий Манна – Уитни использовали для выявления различий между группами пациентов, а также различий в ВГД, количестве местных гипотензивных препаратов, прогрессирования глаукомы в год между группами пациентов. Т-критерий Вилкоксона применяли для связных выборок. Сравнения двух групп из совокупностей с нормальным распределением проводили с помощью t-критерия Стьюдента для двух зависимых или двух независимых выборок. Взаимозависимость признаков определена методом Пирсона и Спирмена. Корректировку множественных измерений осуществляли методом Бонферрони. Для определения прогностических факторов, влияющих на неудачу СЛТ, был использован метод логистической обобщенной линейной смешанной модели, которая характеризуются включением фиксированных и случайных эффектов в линейный предиктор. Таким образом, учитывалась корреляция между наблюдениями правого и левого глаза. Мультиколлинеарность проверяли во всех моделях. Числовые данные представлены как среднее ± SD. Критический уровень статистической значимости p ≤ 0,05.
Результаты
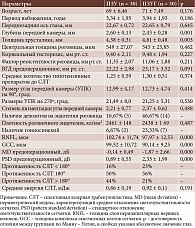
Клиническая характеристика пациентов, включенных в исследование, представлена в табл. 1.
Группы были сопоставимы по частоте применения местной гипотензивной терапии. ИК при ПЗУ использовались в 9 (30,0%) глазах, при ПЗУГ – в 10 (33,33%), альфа-агонисты – в 8 (26,67%) и 9 (30,0%) соответственно, а бета-блокаторы – в 11 (36,66%) и 9 (30,0%) соответственно. Только в 2 (6,67%) случаях в обеих группах пациенты не нуждались в местной гипотензивной терапии.
Результаты показали достоверное снижение ВГДрк по сравнению с предоперационным во все сроки наблюдения после СЛТ, причем при ПЗУ к первому году наблюдения снижение офтальмотонуса было более существенным, чем при ПЗУГ (табл. 2).
Выявлены статистически значимые отличия в использовании местной гипотензивной терапии внутри групп по сравнению с исходными значениями, а также между группами к окончанию периода наблюдения (табл. 3).
Послеоперационных осложнений в обеих группах не отмечалось. Степень выраженности воспалительной реакции в первые сутки после СЛТ приведена в табл. 4.
Выявлено увеличение центральной толщины роговицы (ЦТР) после СЛТ в обеих группах, но при ПЗУ восстановление ЦТР до исходных значений происходило быстрее, чем при ПЗУГ (табл. 5).
Чем выше была энергия лазерного воздействия, тем более заметным было увеличение ЦТР в обеих группах. Подобная зависимость сохранялась до трех месяцев после операции (табл. 6).
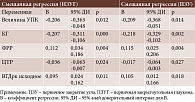
По данным обобщенного регрессионного анализа, выявлены предикторы, снижающие эффективность СЛТ при ЗПЗУ: низкие значения величины УПК и корнеального гистерезиса (КГ), высокое предоперационное ВГД и фактор резистентности роговицы (ФРР), а также тонкая ЦТР (табл. 7).
Определены предикторы, снижающие успех СЛТ: глубина передней камеры (ПК) менее 2,5 мм, толщина хрусталика (ТХ) более 4,5 мм и особенно более 5,0 мм, большее количество местных гипотензивных препаратов до операции (табл. 8).
В ходе динамического наблюдения после СЛТ скорость прогрессирования ГОН при ПЗУГ за три года составила: ROP = -0,06 ± 0,68 дБ/год, RNFL = -0,55 ± 1,86 мкм/год, GCC = -0,61 ± 2,37 мкм/год. При ПЗУ признаков ГОН через три года не выявлено: ROP = -0,07 ± 0,48 дБ/год, RNFL = -0,60 ± 1,57 мкм/год, GCC = -0,72 ± 1,99 мкм/год. Достоверности различий между группами не установлено (ROP: p = 0,462, RNFL: p = 0,375, GCC: p = 0,291).
Обсуждение
Проведено исследование эффективности СЛТ при ЗПЗУ в глазах, ранее перенесших ПЛИТ. Результаты показали достоверное снижение ВГДрк по сравнению с предоперационным ВГДрк, а также количества местных гипотензивных капель во все сроки наблюдения после СЛТ как при ПЗУ, так и при ПЗУГ (табл. 2 и 3).
В предыдущих исследованиях показано, что СЛТ – безопасный и эффективный метод снижения ВГД при ПЗУГ после ПЛИТ в анамнезе [11, 15]. Кроме того, результат сопоставим с таковым при использовании аналогов простагландинов (АП) [13]. Снижение ВГД относительно исходного отмечалось в 60% после СЛТ и 84% при лечении АП. Через шесть месяцев ВГД уменьшилось в среднем на 4,0 мм рт. ст. в группе СЛТ против 4,2 мм рт. ст. в группе АП (р = 0,78), что составило 16,9 и 18,5% соответственно (р = 0,52).
Учитывая риск прогрессирования заболевания первичного закрытия угла [19, 20], мы решили исследовать эффективность СЛТ у пациентов уже на ранней стадии ЗПЗУ, а именно у пациентов с ПЗУ после ПЛИТ, и сравнить ее с таковой при начальной стадии ПЗУГ в отдаленном периоде. Эффективность СЛТ при ПЗУ изучалась только в одной работе и лишь в совместной группе с ПЗУГ, где показатель успеха достижения клинически значимого снижения ВГД (на 20% и более от исходного уровня) составил 84,7% в группе ПЗУ/ПЗУГ и 79,6% в группе ПОУГ (р = 0,47) [16]. В нашем исследовании к первому году выявлена достоверная разница в снижении ВГДрк при ПЗУ по отношению к ПЗУГ, которая сохранялась в течение всего периода наблюдения. Кроме того, при ПЗУ ко второму году наблюдения необходимость применения местной гипотензивной терапии была меньше по сравнению с ПЗУГ (табл. 2 и 3).
Целесообразность проведения СЛТ при ЗПЗУ продиктована результатами исследований, показавшими, что после СЛТ при ПЗУГ и ПОУГ имеют место схожие гистологические изменения трабекулярной сети [21, 22]. Теоретически при ПЗУ и ПЗУГ ответ на СЛТ должен быть сопоставим, так как при обоих состояниях топографические параметры достоверно не отличались (табл. 1), хотя патологические процессы в трабекуле при ПЗУГ выражены, несомненно, значительнее, чем при ПЗУ [22, 23]. Главным условием выполнения СЛТ является доступность трабекулярной сети для лазерного воздействия в условиях узкого УПК, что продиктовано риском повреждения эндотелия роговицы [24, 25]. В настоящем исследовании мы не наблюдали реактивной гипертензии, кровотечений, осложнений со стороны роговицы, так как СЛТ выполнялась с условием визуализации трабекулы более чем на 90° и применения нестероидных противовоспалительных препаратов. Отмечалась лишь слабая и умеренно выраженная воспалительная реакция (табл. 4).
В литературе дискутируется вопрос о применении стероидных противовоспалительных препаратов. Известно, что в результате лазерного воздействия цитокины провоцируют активность макрофагов в трабекулярной сети с последующим ремоделированием внеклеточного матрикса, улучшением оттока внутриглазной жидкости и снижением ВГД [26, 27]. Стероиды могут снижать эффективность СЛТ [28], тем не менее они используются в клинической практике [13]. В настоящей работе достоверный гипотензивный эффект во всех группах достигнут без использования стероидов (табл. 2), что согласуется с другими работами [15].
В отличие от описанных выше работ в нашем исследовании впервые проанализирована эффективность СЛТ при ПЗУ после ПЛИТ в отдаленном периоде. Установлено, что гипотензивный эффект операции превосходит таковой при ПЗУГ (табл. 2). Необходимость меньшего использования местной гипотензивной терапии при ПЗУ к окончанию периода наблюдения обусловлена, по всей вероятности, меньшим количеством гониосинехий, более глубокой ПК, менее увеличенной толщиной хрусталика, а следовательно, большей протяженностью воздействия при СЛТ (табл. 1).
Прямые корреляции ЦТР с энергией лазерного воздействия при ЗПЗУ (табл. 6) объясняют достоверное увеличение ЦТР после СЛТ, причем при ПЗУГ оно сохраняется до месяца в отличие от ПЗУ (табл. 5) в силу более выраженного воспалительного ответа на лазерное воздействие в условиях более узкого профиля ПК в отличие от ПЗУ (табл. 1).
Статистический анализ полученных нами результатов показал, что предикторами неудачи СЛТ при ЗПЗУ являются низкий КГ, высокий ФРР, высокое исходное ВГД, меньшая ЦТР, мелкая передняя камера, узкий УПК, увеличенный в размерах хрусталик (табл. 7 и 8). Можно предположить, что в этих условиях играет роль и увеличенное количество пигментных депозитов на эндотелии роговицы, которое было выше в группе ПЗУГ (табл. 1). Как известно, КГ и ФРР достовернее отражают биомеханические свойства роговицы, чем ЦТР [29], а КГ служит диагностическим критерием препериметрической глаукомы [30]. Возможно, при низком КГ недостаточно активируются матриксные металлопротеиназы, предотвращающие аккумуляцию белков в трабекулярной сети [31], что определяет недостаточную эффективность СЛТ. Отложение пигмента на эндотелии роговицы после ранее выполненной ПЛИТ способствует большей абсорбции лазерной энергии клетками роговичного эндотелия при СЛТ [32]. Мы полагаем, что в нашем исследовании в группе ПЗУГ на фоне более выраженного отложения пигментных депозитов на эндотелии роговицы и абсорбции энергии лазерного воздействия имели место более выраженная воспалительная реакция и более длительное увеличение толщины роговицы в условиях мелкой передней камеры по сравнению с ПЗУ.
В литературе дискутируется вопрос о предикторах успеха СЛТ в отношении предоперационного ВГД. По мнению K.E. Leahy и соавт. [33] и S. Raj [15], высокое исходное ВГД положительно коррелирует со степенью снижения офтальмотонуса. В нашем же случае оно ассоциировалось с худшим результатом, что совпадает с данными других авторов [11, 34].
Динамика структурно-функциональных показателей, по данным САП и ОКТ, свидетельствует о стабилизации процесса в обеих группах: снижении прогрессирования ГОН при ПЗУГ (ROP = -0,06 ± 0,68 дБ/год) и отсутствии перехода ПЗУ в ПЗУГ (ROP = -0,07 ± 0,48), что позволяет сделать вывод об эффективности СЛТ при ЗПЗУ в аспекте сохранения зрительных функций.
Поскольку патогенез ЗПЗУ обусловлен относительными топографическими особенностями переднего сегмента глаза, стратегия лечения направлена на реконструкцию УПК и снижение ВГД. Соответственно изолированная СЛТ неприемлема и используется только после ПЛИТ. СЛТ оправданна в тех случаях, когда факоэмульсификация с имплантацией интраокулярной линзы (ФЭ + ИОЛ) невозможна, в том числе из-за противопоказаний, длительного времени ожидания операции, отказа от вмешательства, а в ряде случаев отказа от ФЭ + ИОЛ со стороны пациентов, которые при наличии высоких зрительных функций не всегда готовы к замене прозрачного хрусталика. СЛТ после ПЛИТ как альтернатива ФЭ + ИОЛ может быть рассмотрена в качестве замены постоянной местной гипотензивной терапии в условиях динамического наблюдения.
Согласно полученным нами данным, СЛТ после ранее перенесенной ПЛИТ демонстрирует надежность и эффективность в отношении предупреждения перехода ПЗУ в ПЗУГ, а также снижения скорости прогрессирования уже имеющейся ПЗУГ у пациентов с декомпенсированным ВГД. Предикторами неудачи СЛТ служат низкий КГ, высокое предоперационное ВГД и ФРР, меньшая ЦТР, узкий УПК, мелкая передняя камера и увеличенный хрусталик.
Таким образом, впервые показано, что СЛТ является эффективным методом снижения ВГД не только при ПЗУГ, но и при ПЗУ, в случаях недостаточного снижения ВГД после ПЛИТ. При этом можно предположить, что в таких глазах СЛТ является альтернативным методом по отношению к ФЭ + ИОЛ, предупреждающим развитие ГОН.
N.I. Kurysheva, G.А. Sharova
The Department of Eye Diseases at the Medical Biological University of Innovations and Continuing Education of the Federal Biophysical Center named after A.I. Burnazyan
Diagnostic Department of the Ophthalmological Center of Federal Medical‐Biological Agency of Russia
Ophthalmology Clinic of Dr. Belikova
Contact person: Galina A. Sharova, galina.shar@mail.ru
Purpose – to assess the rate of success of selective laser trabeculoplasty (SLT) in the patients with primary angle closure (PAC) who underwent laser peripheral iridotomy (LPI) but did not achieve intraocular pressure compensation (IOP).
Material and methods. This prospective study included 60 patients with PAC aged 47 to 80 years (30 – with PAC and 30 – with the initial stage of primary angle-closure glaucoma (PACG). All the patients underwent SLT with the trabecular meshwork visualization up to at least 90°. The rate of success was assessed on day 1, at 1 week, 1 month, and 6 months and once a year during 3 years based on the level of IOP, the number of hypotensive drugs used, thickness of retinal nerve fiber layer (RNFL) and ganglion cell complex (GCC), as well as mean light sensitivity (MD). The following predictors of SLT success were studied: corneal hysteresis (CH), corneal resistance factor (CRF), central corneal thickness (CCT), corneal-compensated IOP (IOPcc), anterior chamber depth (ACD), anterior chamber angle (ACA), lens thickness (LT).
Results. In both groups, in all periods, there was a significant decrease in IOP (p < 0.05 in all cases) with the maximum decrease on day 1 after SLT, and the minimum after 3 years. At 1 year, there was a significant difference in IOPcc decrease in PAC in comparison with PACG (p = 0.048), which persisted throughout the entire follow-up period (p = 0.008). At 3 years, there were no signs of GON development among the patients with PAC, and the need for hypotensive therapy was significantly lower in PACG at 2 and 3 years of follow-up (p = 0.041 and p = 0.037, respectively). The GON progression rate in PACG was -0.06 ± 0.68 dB/year. The predictors of SLT failure in both groups were determined: low CH, high preoperative IOP and CRF, lower CCT, small ACA and АСD, and increased LT (all p < 0.05).
Conclusion. The long-term SLT success is higher in PAC than in PACG, that is associated with a smaller amount of goniosynchia, a deeper anterior chamber, a less increased LT, and therefore, longer duration of laser exposure. SLT is an alternative PAC treatment preventing the development of GON in relation to clear lens extraction.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.