Глаукома, осложненная эндотелиальной дистрофией Фукса
- Аннотация
- Статья
- Ссылки
- English



В настоящее время мониторинг глаукомы осуществляется на основании структурных и функциональных изменений. Ведущую роль в раннем выявлении и контроле прогрессирования первичной открытоугольной глаукомы (ПОУГ) начальных стадий играет оптическая когерентная томография (ОКТ) [1]. Много исследований посвящено оценке факторов риска и прогрессирования глаукомы. Недавнее отечественное многоцентровое исследование показало, что прогноз тяжести течения заболевания определяется уровнем внутриглазного давления (ВГД) на момент диагностирования болезни. Кроме того, установлено, что тяжесть течения глаукомного процесса и прогрессирование ПОУГ могут определять такие местные факторы, как псевдоэксфолиативный синдром (ПЭС), синдром пигментной дисперсии, синдром сухого глаза, а также общие и социальные факторы (ишемическая болезнь сердца, артериальная гипотензия, инфаркт миокарда в анамнезе, группа инвалидности по соматическому состоянию, курение, высокая приверженность лечению, наличие высшего образования), что необходимо учитывать при индивидуальном выборе метода лечения глаукомы [2].
Как известно, у пациентов с ПОУГ имеют место изменения в эндотелии роговицы, а именно аномалии морфологии и снижение плотности эндотелиоцитов в зависимости от уровня ВГД и стадии глаукомного процесса [3–5]. Это необходимо учитывать при мониторинге пациентов с глаукомой, особенно на фоне сопутствующих заболеваний роговицы. К наиболее тяжелым из них относят эндотелиальную дистрофию роговицы Фукса [6], при которой возможно развитие вторичной буллезной кератопатии при интраокулярных хирургических вмешательствах, инфекционных заболеваниях структур переднего отрезка глаза, а также при повышении уровня офтальмотонуса, в том числе на фоне ПОУГ [7].
Согласно имеющимся данным, ПОУГ способствует активному иммунному ответу, опосредованному секрецией биологически активных эндогенных веществ (повышение концентрации интерлейкина (ИЛ) 6, воспалительного белка макрофагов 1-бета, снижение уровня гранулоцитарно-макрофагального колониестимулирующего фактора, ИЛ-13), что может утяжелять течение дистрофии Фукса [8].
Проблема тонометрии остается крайне актуальной, поскольку в реальной клинической практике контроль ВГД в диагностике и мониторинге глаукомы занимает лидирующие позиции. При любом виде тонометрии воздействие оказывается на роговицу, структура которой может быть нарушена, в частности, из-за заболеваний роговицы, что может вносить погрешность в точность измерения офтальмотонуса и влиять на лечение глаукомы [9]. Такие факторы, как возраст, уровень ВГД, длительность гипотензивной терапии, переднезадняя ось глаза, объем передней камеры глаза, состояние глазной поверхности, перенесенные антиглаукомные вмешательства в анамнезе, ПЭС, перенесенные кераторефракционные вмешательства, заболевания роговицы, вносят погрешность в данные тонометрии [10, 11]. Одним из наиболее точных методов контроля ВГД является исследование на анализаторе биомеханических свойств фиброзной оболочки глаза c использованием технологии визуализации роговицы (CorVis ST, Oculus).
Ранее в литературе упоминалось о сочетанной патологии – эндотелиальной дистрофии Фукса и псевдоэксфолиативной глаукоме. Однако в этой работе указывалось на сложность дифференциальной диагностики двух состояний, когда авторам пришла на помощь конфокальная микроскопия [12]. В нашем случае мы постарались описать особенности клинического течения двух заболеваний, когда одно осложняет другое.
Цель – рассмотреть особенности клинического течения, оценить сложность глаукомного процесса, эффективность медикаментозного, лазерного и хирургического лечения на фоне тяжелого заболевания роговицы, которое приводит к тонометрическим ошибкам и недостаточной для качественного мониторинга визуализации. Показано, что неадекватно подобранная терапия на старте и нарушение приверженности лечению в начальной стадии заболевания приводят к его прогрессированию и неконтролируемому течению.
Клинический случай
Пациентка 56 лет впервые обратилась за помощью к специалисту в 2017 г. по поводу постепенного снижения остроты зрения, дискомфорта, ощущения инородного тела в глазах. Со слов пациентки, зрение снижается с 50 лет, для чтения использует очки.
Сопутствующие заболевания: в 2008 г. оперирована по поводу злокачественного образования молочной железы, проходила курсы химиотерапии. Инвалид второй группы. Деформирующий остеоартроз коленных суставов.
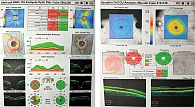
Диагностическое обследование включало визометрию, тонометрию, пахиметрию, гониоскопию, ОКТ (Cirrus HD-OCT 5000, CarlZeiss), стандартную автоматизированную периметрию (САП) на периметре TomeyAP-1000 по программе «глаукома-скрининг». Биометрические параметры глаза исследовались на приборе Zeiss IOL Master 700, эндотелиальная микроскопия проводилась на приборе SP-3000P (Topcon). Стандартная бесконтактная тонометрия выполнялась на приборе Reichert 7 CR с возможностью получения роговично-компенсированного давления. Томографию роговицы и биомеханические параметры измеряли с помощью Pentacam (Oculus) и CorVis ST соответственно. Диагностическое обследование включало также осмотр лазерного хирурга.
При осмотре острота зрения правого глаза – 0,4 с коррекцией sph +1,5 дптр, cyl -1,0 дптр ax65 = 0,8; левого глаза – 0,5 с коррекцией sph +0,5 дптр, cyl -1,0 дптр ax80 = 0,8. Переднезадняя ось правого глаза – 23,17 мм, левого глаза – 23,32 мм. Уровень ВГД в правом глазу – 21 мм рт. ст. пневмотонометрически, 25 мм рт. ст. по Маклакову, в левом глазу – 13 мм рт. ст. пневмотонометрически, 21 мм рт. ст. по Маклакову.
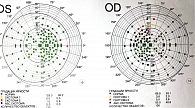
Результаты ОКТ: истончение слоя нервных волокон сетчатки (СНВС) в верхнем секторе, снижение показателей комплекса ганглиозных клеток сетчатки (ГКС) до пограничных значений в нижнем секторе и увеличение вертикального компонента экскавации до 0,74 с истончением нейроретинального пояска (НРП) в правом глазу, СНВС в норме, ГКС в норме, экскавация 0,64 при неизмененном НРП в левом глазу. На основании данных обследования пациентке выставлен диагноз: открытоугольная начальная глаукома, начальная катаракта, гиперметропия слабой степени, сложный гиперметропический астигматизм, ПЭС правого глаза, начальная катаракта, гиперметропия слабой степени, смешанный астигматизм левого глаза, синдром сухого глаза обоих глаз. Назначена местная медикаментозная терапия бримонидином 0,2% по одной капле два раза в сутки в правый глаз. Рекомендованы контроль ВГД в динамике и повторный осмотр через шесть месяцев.
При обращении в клинику через 12 месяцев (в 2018 г.) пациентка сообщила, что капли закапывала нерегулярно. Острота зрения правого глаза – 0,3 с коррекцией sph +1,5 дптр, cyl -0,75 дптр ax70 = 1,0; левого глаза – 0,4 с коррекцией sph +1,0 дптр, cyl -0,5 дптр ax92 = 0,9. Уровень ВГД в правом глазу – 28 мм рт. ст. по Маклакову, в левом – 19 мм рт. ст. по Маклакову. По результатам проведенного обследования, включавшего проведение повторной ОКТ и эндотелиальной микроскопии (рис. 1), установлен диагноз: открытоугольная развитая субкомпенсированная глаукома, ПЭС правого глаза, эндотелиальная дистрофия роговицы, гиперметропия слабой степени обоих глаз. Рекомендованы применение тафлупроста 0,015% в правый глаз, кератопротекторное лечение.
В правом глазу исследование провести не удалось из-за выраженного нарушения морфологии клеток эндотелия роговицы. В левом глазу отмечались снижение количества клеток, нарушение их гексагональности, уменьшение площади клетки. Данная двусторонняя картина соответствует эндотелиальной дистрофии роговицы (рис. 1).
При повторном обращении в 2019 г. уровень ВГД в правом глазу составил 22 мм рт. ст. по Маклакову, в левом – 19 мм рт. ст. по Маклакову. Рекомендованы консультация лазерного хирурга для решения вопроса о лазерном лечении глаукомы правого глаза, повторное проведение ОКТ, усиление терапии фиксированной комбинацией (ФК) травопроста/тимолола в правый глаз, контроль ВГД в динамике.
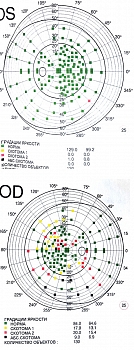
Последующий визит состоялся в 2022 г.: жалобы на туман в глазах, снижение зрения, более выраженное в правом глазу. Применяла ФК травопроста/тимолола в правый глаз. При осмотре острота зрения правого глаза – 0,4 с коррекцией sph +0,75 дптр, cyl -0,25 дптр ax10 = 0,5; левого глаза – 0,6 с коррекцией sph +0,75 дптр, cyl 0,75 дптр ax49 = 0,9. Уровень ВГД в правом глазу – 36 мм рт. ст. пневмотонометрически, в левом – 26 мм рт. ст. пневмотонометрически. При исследовании поля зрения выявлены сливная парацентральная скотома назально, расширение слепого пятна в правом глазу, единичная парацентральная относительная скотома в левом глазу. Установлен диагноз: декомпенсированная нестабилизированная с высоким ВГД глаукома правого глаза, подозрение на глаукому левого глаза. Пациентку направили на консультацию к лазерному хирургу для дообследования с проведением ОКТ и решения вопроса о хирургическом лечении глаукомы. Терапию усилили ФК травопроста/тимолола в оба глаза, дорзоламидом 2% в правый глаз.
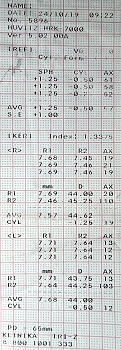
Результаты дополнительного обследования в апреле 2022 г.: при осмотре острота зрения правого глаза – 0,5 с коррекцией sph +1,0 дптр = 0,6, левого глаза – 0,5 с коррекцией sph +0,75 дптр, cyl -0,5 дптр ax40 = 0,87 (рис. 2). Центральная толщина роговицы в правом глазу – 527 мкм, в левом – 534 мкм. Глубина передней камеры в правом глазу – 3,15 мм, толщина хрусталика – 4,82 мм, в левом – 3,05 и 4,82 мм соответственно. Уровень ВГД при закапывании назначенного ранее гипотензивного препарата в правом глазу – 34 мм рт. ст. пневмотонометрически, 30 мм рт. ст. по Маклакову, в левом – 11 мм рт. ст. пневмотонометрически (рис. 3). На приеме в правый глаз закапан бримонидин 0,15%, в результате чего уровень ВГД снизился до 30 мм рт. ст. пневмотонометрически. После полного диагностического обследования (рис. 4) и ОКТ (рис. 5) верифицирован диагноз: открытоугольная далеко зашедшая декомпенсированная глаукома, ПЭС, роговичный астигматизм правого глаза, эндотелиальная дистрофия роговицы, начальная катаракта, гиперметропия обоих глаз слабой степени. Рекомендованы ФК биматопроста/тимолола и дорзоламид 2% в режиме дозирования два раза в сутки в правый глаз, консультация лазерного хирурга. Гипотензивная терапия левого глаза отменена. Показано кератопротекторное лечение обоих глаз.
Осмотр лазерного хирурга: в правом глазу угол передней камеры открыт, широкий (степень открытия III по Шафферу), интенсивная экзогенная пигментация трабекулы (пигментация 2-го класса по Шейе). Рекомендована селективная лазерная трабекулопластика (СЛТ) правого глаза. В левом глазу угол передней камеры открыт, широкий, средней интенсивности эндогенная пигментация трабекулы.
Данные рефрактометрии – гиперметропическая рефракция слабой степени в обоих глазах (рис. 2), данные кератометрии – миопический астигматизм слабой степени в правом глазу.
При исследовании поля зрения в правом глазу отмечались множественные относительные парацентральные скотомы верхненазально близко к точке фиксации, сливная относительная скотома нижне-назально в 20 градусах от точки фиксации, расширение слепого пятна. В левом глазу периферические скотомы нижненазально (рис. 4).
Резко снижена визуализация в правом глазу (исследование проводилось без медикаментозного мидриаза), из-за дистрофического процесса в роговице ее прозрачность снижена. Даже с учетом погрешности визуализации определены глубокая экскавация с выраженным вертикальным компонентом (0,85), снижение СНВС по типу «песочных часов» и истончение комплекса ГКС. По сравнению с предыдущими протоколами этот протокол продемонстрировал отрицательную динамику. В левом глазу показатели находились в пределах нормативных значений, без отрицательной динамики (рис. 5).
СЛТ в правом глазу выполнена в стандартном режиме (длина волны – 532 нм, Е – 400 мВТ, d – 50, количество импульсов – 51), однако, несмотря на максимальный медикаментозный режим, при осмотре через семь дней сохранялись повышенный уровень ВГД в правом глазу – 26,7 мм рт. ст. пневмотонометрически, 30 мм рт. ст. по Маклакову, жалобы на туман в правом глазу. При осмотре определен отек роговицы правого глаза. Пациентка была проконсультирована хирургом. Рекомендовано выполнение непроникающей глубокой склерэктомии (НГСЭ) с последующей десцеметогониопунктурой (ДГП) правого глаза.
В мае 2022 г. проведена НГСЭ правого глаза, после которой уровень ВГД составил 13 мм рт. ст. при отмене гипотензивного лечения.
При повторном обращении в клинику в октябре 2022 г. – жалобы на туман в глазах, уровень ВГД в отсутствие местной гипотензивной терапии в правом глазу – 51 мм рт. ст. пневмотонометрически, 47 мм рт. ст. по Маклакову, в левом – 27 мм рт. ст. пневмотонометрически, 30 мм рт. ст. по Маклакову (рис. 6). На приеме закапана ФК бримонидина/тимолола в оба глаза, в результате чего уровень ВГД снизился до 40 мм рт. ст. в правом глазу, до 15 мм рт. ст. – в левом. После полного диагностического обследования (рис. 7 и 8) и ОКТ верифицирован диагноз: открытоугольная далеко зашедшая оперированная с высоким ВГД глаукома, ПЭС, роговичный астигматизм правого глаза, впервые выявленная начальная субкомпенсированная глаукома левого глаза, эндотелиальная дистрофия роговицы, начальная катаракта, гиперметропия обоих глаз слабой степени. Рекомендована ФК травопроста/тимолола в оба глаза. ДГП правого глаза не рекомендована из-за сниженной визуализации за счет изменений в роговице и давности проведения НГСЭ.
На данном протоколе исследования отмечалась невозможность выполнения рефрактометрии правого глаза из-за непрозрачности сред. Представлены только результаты кератометрии. В левом глазу сохранялся прежний уровень гиперметропической рефракции слабой степени (рис. 7).
На протоколе исследования поля зрения наблюдались снижение светочувствительности сетчатки, формирование сливной скотомы верхненазально от точки фиксации, концентрическое сужение светочувствительности сетчатки до 20 градусов во всех отделах, кроме темпорального, что по сравнению с исследованием в апреле 2022 г. расценивалось как ухудшение. В левом глазу дефектов поля зрения не выявлено (рис. 8).
При последующем обращении в целях контроля ВГД его уровень составил в правом глазу 18 мм рт. ст., в левом – 16 мм рт. ст. на фоне применения травопроста 0,004% в оба глаза, ФК бринзоламида/тимолола в правый глаз.
При повторном обращении в клинику в июле 2023 г. острота зрения правого глаза составила 0,2 с коррекцией sph +1,0 дптр = 0,4, левого – 0,5 с коррекцией sph +0,75 дптр = 0,6. Уровень ВГД при использовании латанопроста 0,05% в оба глаза, ФК бринзоламида/тимолола в правый глаз: в правом глазу – 22 мм рт. ст. пневмотонометрически, в левом – 17 мм рт. ст. пневмотонометрически. После полного диагностического обследования (рис. 9) и ОКТ (рис. 10) верифицированы открытоугольная далеко зашедшая оперированная (СЛТ и НГСЭ) субкомпенсированная глаукома, ПЭС, роговичный астигматизм правого глаза, начальная компенсированная глаукома левого глаза, эндотелиальная дистрофия роговицы, начальная катаракта, гиперметропия обоих глаз слабой степени. Рекомендованы соблюдение назначенного режима лечения и консультация хирурга по поводу выполнения микроимпульсной циклофотокоагуляции.
На представленном протоколе исследования поля зрения наблюдалось углубление размеров скотом (переход из относительных в абсолютные) верхненазально, нижненазально, в области слепого пятна, а также увеличение размеров скотомы верхненазально до полного секторального выпадения. В левом глазу без отрицательной динамики (рис. 9).
На представленных протоколах ОКТ наблюдались увеличение размера экскавации до 0,89, истончение СНВС в нижнем отделе, истончение комплекса ГКС в правом глазу, в левом глазу – уменьшение комплекса ГКС в пределах 3 мкм, СНВС в пределах 5 мкм (рис. 10).
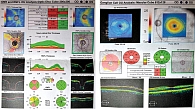
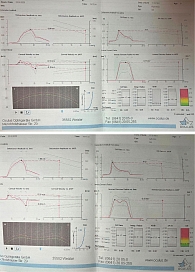
На осмотре хирурга в августе 2023 г. пациентка предъявляла жалобы на туман в глазах, выраженное ощущение инородного тела, резь в глазах, усиливающуюся при закапывании гипотензивных капель. ВГД при закапывании латанопроста 0,05% в оба глаза, ФК бринзоламида/тимолола, бримонидина 0,15% в правый глаз: в правом глазу – 19 мм рт. ст. пневмотонометрически, 22,5 мм рт. ст. при исследовании на Corvis ST, в левом – 15 мм рт. ст. пневмотонометрически, 13,2 мм рт. ст. при исследовании на Corvis ST (рис. 11).
На протоколе исследования отмечалось биомеханически скорректированное ВГД (bIOP), показатели центральной толщины роговицы и параметры жесткости фиброзной оболочки глаза имели абнормальные значения (рис. 11).
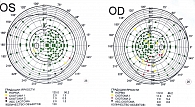
По данным биомикроскопии, в правом глазу над лимбом плоская зона фильтрации, на эндотелии роговицы дисперсия пигмента в оптической зоне, выраженная эндотелиопатия, передняя камера средней глубины, радужная оболочка субатрофична, псевдоэксфолиации по зрачковому краю больше в правом глазу. В обоих глазах начальные кортикальные помутнения, псевдоэксфолиации на передней капсуле хрусталика. На глазном дне в правом глазу диск зрительного нерва бледный, границы четкие, среднего размера, экскавация глубокая, вертикальная, размер 0,8–0,9 мм, смещение сосудистого пучка назально, нейроретинальный ободок резко истончен, перипапиллярно атрофия сосудистой оболочки. В левом глазу диск зрительного нерва бледно-розовый, границы четкие, среднего размера, экскавация глубокая, расширенная, размер 0,6 мм, смещение сосудистого пучка назально, нейроретинальный ободок розовый, перипапиллярно атрофия сосудистой оболочки.
Диагноз: оперированная открытоугольная нестабилизированная глаукома стадии IIIВ, ПЭС, состояние после СЛТ, НГСЭ, роговичный астигматизм правого глаза. Открытоугольная стабилизированная глаукома стадии IА, ПЭС, гиперметропия левого глаза слабой степени, эндотелиальная дистрофия роговицы Фукса (рис. 12), осложненная катаракта обоих глаз. Рекомендованы продолжение назначенного гипотензивного лечения, микроимпульсная циклофотокоагуляция без гарантии стабилизации процесса.
На рисунке 12 видно отложение пигментных гранул на эндотелии роговицы диффузно в оптической зоне, а также псевдоэксфолиативного материала.
Обсуждение
Данный клинический случай демонстрирует трудности, с которыми пришлось столкнуться при стабилизации глаукомного процесса. При первичной постановке диагноза начальной глаукомы не назначена терапия первого выбора – аналоги простагландинов. Однако пациентка призналась, что приверженность лечению была низкой, поскольку она не обладала достаточной информацией о заболевании, необходимости регулярного закапывания капель и контроля уровня ВГД. Данная проблема достаточно изучена и описана в зарубежных и отечественных публикациях [13, 14], но при соблюдении пациентом режима лечения возможно достижение низкой скорости прогрессирования глаукомной оптической нейропатии, как в клиническом наблюдении С.В. Диордийчук и соавт. [15]. В данном случае с учетом молодого возраста пациентки и наличия осложняющих мониторинг факторов были целесообразны более интенсивная медикаментозная терапия синтетическими аналогами простагландинов [16–18] и выполнение лазерного лечения глаукомы при ее начальной стадии, когда терапия наиболее эффективна.
В нашем клиническом случае глаукома сопровождалась эндотелиальной дистрофией роговицы Фукса – наследственным двусторонним заболеванием, которое чаще встречается у женщин, манифестирует в возрасте 40 лет и постоянно прогрессирует. Болезнь поражает эндотелий, выполняющий насосную функцию, постоянно откачивая из стромы роговицы жидкость, которая попадает туда под действием нормального ВГД. Избыточная жидкость в роговице снижает ее прозрачность, вызывает отек. По мере прогрессирования дистрофии, а также с возрастом пациентов постепенно снижается количество эндотелиальных клеток [19].
Обращает на себя внимание сложность интерпретации данных тонометрии по причине тонкой центральной толщины роговицы, с одной стороны, и тяжелого прогрессирующего заболевания роговицы со склонностью к отеку стромы роговицы, с другой. При этом прогрессированию эндотелиальной дистрофии роговицы способствует и некомпенсированный уровень ВГД. Эти взаимосвязи формируют порочный круг. Трудности реализации стандартных методик тонометрии определяют в таких случаях использование методики Corvis ST для получения более точных результатов уровня ВГД с учетом погрешностей, вносимых болезнью роговицы.
В рассмотренном клиническом случае выполнение СЛТ оказалось несвоевременным, поэтому желаемый гипотензивный эффект от ее выполнения не был достигнут. По данным отечественных авторов, наибольшая гипотензивная эффективность наблюдается в начальной стадии ПОУГ, в том числе при наличии ПЭС [20]. Исследователи также отмечают долгосрочную эффективность данной лазерной методики при ее своевременном раннем выполнении [21]. СЛТ при глаукоме и сопутствующей ей патологии роговицы считается приоритетной, поскольку не вызывает повреждения эндотелиоцитов по данным конфокальной микроскопии. Противопоказания для ее применения у пациентов с низкими показателями плотности эндотелиальных клеток роговицы не обнаружены [22].
Переход к хирургическому лечению глаукомы в данном клиническом случае был обоснован невозможностью компенсации ВГД посредством медикаментозного и лазерного лечения. В недавно опубликованном обзоре авторы разграничили абсолютные и относительные показания к проведению антиглаукомной операции, однако предложили подходить к данной градации с учетом течения заболевания [23]. Пациентку, о которой шла речь в представленном клиническом случае, можно отнести к группе (около 50% всех пациентов) с абсолютными показаниями для проведения хирургического лечения. Глаукомный процесс у лиц этой группы характеризуется повышенным уровнем ВГД, несмотря на проводимое лечение.
В ряде исследований оценивали изменения эндотелия роговицы после хирургического лечения глаукомы [24]. Показано, что хирургическое лечение глаукомы негативно влияет на эндотелий роговицы. Однако наименьшее снижение плотности наблюдается при проведении глубокой склерэктомии и трабекулэктомии [25, 26], более высокие показатели потерь эндотелия роговицы регистрируются при имплантации клапанных устройств и шунтов. Выбранная нами НГСЭ стала самым безопасным видом хирургического вмешательства.
Тем не менее в данном клиническом случае не произошло своевременного выполнения лазерной ДГП. При последующем обращении пациентки, уже с декомпенсацией ВГД, ДГП была невозможна из-за отсутствия визуализации по причине прогрессирования дистрофии роговицы и отека.
Мы рекомендовали пациентке выполнение микроимпульсной циклофотокоагуляции, которая сегодня в России считается относительно новой методикой контроля ВГД, но уже показавшей хорошие результаты. Так, в исследованиях при лечении начальной ПОУГ через месяц после процедуры отмечались достоверное уменьшение уровня ВГД и снижение количества применяемых капель [27, 28].
Важно отметить роль ОКТ в раннем выявлении прогрессирования первичной глаукомы. Проведенные ранее отечественные исследования показали, что изолированное применение статической автоматической периметрии не позволяет выявлять прогрессирование глаукомной оптической нейропатии, а сочетание ОКТ и периметрии повышает шанс обнаружения прогрессирования в полтора раза по сравнению с изолированным применением ОКТ [29].
Никто из авторов не имеет финансовой заинтересованности в представленных материалах или методах.
Конфликт интересов отсутствует.
Z.A. Beslangurova, PhD, A.V. Malyshev, PhD, Prof., A.S. Apostolova, PhD, A.A. Sergienko, PhD, A.F. Teshev, G.Yu. Karapetov, PhD, M.K. Ashkhamakhova, B.N. Hatsukova
Maykop State Technological University
Scientific Research Institution – S.V. Ochapovsky Regional Clinic Hospital No. 1, Krasnodar
Vision care clinic ʽ3Zʼ, Krasnodar
Children's Regional Clinical Hospital, Krasnodar
Adygean Republican Clinical Hospital
Contact person: Anastasia S. Apostolova, apostolovan@mail.ru
The article describes a clinical case of monitoring severe primary open-angle glaucoma (POAG), complicated by Fuchs endothelial dystrophy. This case is interesting due to the rapid, poorly controlled course of the glaucomatous process, resistance to therapy, the monitoring of which is complicated by severe corneal disease. To present the features of the clinical course, estimate the complexity of the glaucomatous process, the effectiveness of drug, laser and surgical treatment of POAG in conditions of severe corneal disease, which leads to tonometric errors and insufficient visualization for quality monitoring. And also demonstrate that inadequately selected therapy at the start and violation of adherence to treatment in the initial stage of the disease leads to its progression and uncontrolled course.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.