Систематический анализ фундаментальных и клинических исследований лигнана 7-гидроксиматаирезинола
- Аннотация
- Статья
- Ссылки
- English


Введение
Лигнан 7-гидроксиматаирезинол (7-ГМР) был найден в составе экстрактов ели (Picea abies), пихты белой (Abies alba), дугласовой пихты (Pseudotsuga menziesii) и других хвойных деревьев. 7-ГМР также является основным лигнаном зерновых (пшеницы, овса, ячменя, проса), отрубей кукурузы и цельного зерна амаранта [1]. В норвежских хвойных деревьях содержание гидроксиматаирезинола достигает 84% от общего количества лигнанов [2]. 7-ГМР и другие лигнаны растений (матаирезинол, сециолаларицирезинол, ларицирезинол, изоларицирезинол, сирингарезинол, медирезинол, пинорезинол, сезамин, сезамолинол) характеризуются антиоксидантными [3], противовоспалительными, противомикробными и противоопухолевыми свойствами [4, 5].
Ранее нами был проведен хемореактомный анализ свойств молекулы 7-ГМР в сравнении с контрольными молекулами (17-эстрадиолом, фитоэстрогеном, бета-ситостеролом, эпигаллокатехин-3-галлатом) [6]. Это позволило сформулировать молекулярные механизмы некоторых эффектов молекулы 7-ГМР:
- противовоспалительного (ингибирование 5-липоксигеназы, матриксной металлопротеиназы 2, митоген-активируемой киназы p38-альфа, рецептора лейкотриена B4, рецептора простациклина);
- противоопухолевого (антиоксидантный эффект за счет ингибирования гемоксигеназы 2, ингибирование циклинзависимых киназ 3 и 4, фактора роста эпидермиса, белка mTOR);
- вазодилататорного (ингибирование адренорецепторов и ренина);
- антибактериального и противовирусного (ингибирование вирусных протеаз 3C).
Несмотря на широкий спектр возможных фармакологических эффектов 7-ГМР, обнаруженных в результате хемореактомного анализа, по данным литературы, были изучены лишь некоторые из них. База данных Embase содержит более 200 публикаций по исследованиям 7-ГМР, база данных PubMed – 57 публикаций. В настоящей работе представлены результаты систематического анализа всех имеющихся научных публикаций по исследованиям биологических и биомедицинских эффектов молекулы 7-ГМР, последовательно рассмотрены результаты экспериментальных и клинических исследований 7-ГМР, в том числе фармакокинетика, токсичность, противовоспалительные и противоопухолевые свойства. Отдельно проанализирован вопрос о потенциальных проэстрогенных свойствах молекулы.
Фармакокинетика
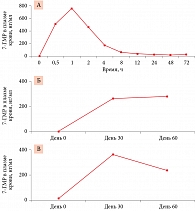
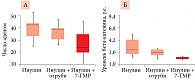
Фармакокинетика, биодоступность и влияние 7-ГМР на клинические симптомы в постменопаузе изучались у женщин, не получавших заместительную гормонотерапию (n = 22). Участницы принимали 7-ГМР по 36 мг/сут (низкая доза) либо 72 мг/сут (высокая доза) в течение восьми недель. Согласно фармакокинетическому анализу, максимальная концентрация 7-ГМР в крови составила 757 нг/мл, а время ее достижения – один час (рис. 1А). К восьмой неделе исследования уровень 7-ГМР в плазме крови достоверно увеличился при приеме 7-ГМР в обеих дозах (p < 0,05, рис. 1Б и В) [7]. Известно, что под воздействием кишечной флоры 7-ГМР трансформируется в энтеролактон – основной продукт биотрансформации растительных лигнанов в организме. На фоне применения 7-ГМР в течение восьми недель уровни энтеролактона в плазме крови увеличились в 1,5 раза в обеих группах, отмечалось снижение частоты приливов. 7-ГМР в дозе до 72 мг/сут, принимаемый на протяжении восьми недель, был безопасным и хорошо переносился [7].
Токсичность
В экспериментальном исследовании хронической токсичности 7-ГМР в форме ацетата калия крысы ежедневно получали 7-ГМР в дозах 160, 640 и 2600 мг/кг/сут в течение 13 недель. 7-ГМР существенно не влиял на какие-либо внешние клинические симптомы, результаты офтальмоскопии или двигательную активность крыс. В подгруппе самцов применение максимальной дозы ассоциировалось с некоторым уменьшением массы тела на протяжении всего исследования и увеличением относительной массы почек. На фоне использования 7-ГМР в высоких дозах наблюдался рост количества тромбоцитов у самок и количества лейкоцитов у самцов. У самок также было отмечено некоторое удлинение менструального цикла. Уровень триглицеридов плазмы дозозависимо снижался при всех трех дозировках. Таким образом, при длительном приеме 7-ГМР в дозе 160 мг/кг/сут не выявлялось никаких неблагоприятных эффектов [8].
В исследовании с участием здоровых добровольцев-мужчин не установлено каких-либо побочных эффектов от однократного приема 7-ГМР в дозе до 1350 мг [9].
Токсикология 7-ГМР была исследована на беременных крысах, которые получали дотации 7-ГМР в дозах 140–180, 460–740 и 1190–2930 мг/кг/сут с 0-го по 21-й день гестации. У животных изучались стандартные параметры репродуктивной функции (индексы плодовитости и беременности, наличие или отсутствие желтого тела, имплантации яйцеклетки, потери яйцеклетки до и после имплантации, количество ранних и поздних резорбций эмбрионов, количество живых и мертвых плодов, вес репродуктивных органов). У плодов оценивались внешние, висцеральные и скелетные изменения. Оказалось, что 7-ГМР не влияет на репродуктивную функцию и не приводит к тератогенезу. Уменьшение массы тела самок и объема потребляемой пищи наблюдалось во всех группах в течение первых трех дней беременности вследствие снижения вкусовой привлекательности корма, поскольку 7-ГМР имеет характерный горьковатый вкус [10].
Таким образом, 7-ГМР был по существу нетоксичным при назначении крысам (2000 мг/кг/сут в течение 28 суток) и собакам (665 мг/кг/сут в течение 28 суток), несмотря на то что 7-ГМР хорошо всасывается (> 50% дозы) и быстро элиминируется [9].
Противовоспалительные свойства
Лигнан 7-ГМР характеризуется выраженной противовоспалительной активностью и эффективно ингибирует специфические воспалительные реакции с участием клеток, регулирующих процессы воспаления, – моноцитов и гранулоцитов. В моноцитах линии ТНР-1 7-ГМР дозозависимо ингибирует синтез/секрецию фактора некроза опухоли (ФНО) альфа, а в гранулоцитах – снижает уровни активных форм кислорода и провоспалительного интерлейкина 8 [11].
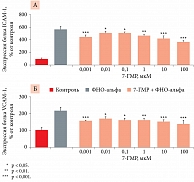
Эндотелиальное воспаление преобладает в патогенезе многих сердечно-сосудистых заболеваний. Показано, что в эндотелиальных клетках аорты 7-ГМР ингибирует индуцированную ФНО-альфа экспрессию белков клеточной адгезии ICAM-1 и VCAM-1 (рис. 2). Это приводит к снижению ФНО-альфа-индуцированной адгезии моноцитов к эндотелиальным клеткам (рис. 3) и более низкой активации провоспалительного фактора транскрипции NF-κB, значительно снижая ФНО-альфа-индуцированное фосфорилирование NF-κB по аминокислотному остатку серин-536 (на 30–80%) [12].
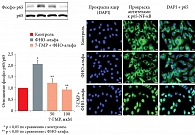
По данным другого исследования, 7-ГМР тормозит ФНО-альфа-опосредованные воспалительные процессы именно за счет ингибирования фосфорилирования провоспалительного фактора NF-κB (ФНО-альфа-связанного ядерного фактора κB, рис. 4) и ингибирования транслокации белка NF-κB внутрь клеточного ядра. В результате блокировки активности NF-κB 7-ГМР подавлял экспрессию мРНК и белка провоспалительных медиаторов ФНО-альфа (молекулы адгезии сосудистых клеток 1, интерлейкина 6, индуцибельной синтазы оксида азота) [13].
Кроме того, 7-ГМР дозозависимо тормозил ФНО-альфа-индуцированное фосфорилирование внеклеточной сигнально-регулируемой киназы 1/2 ERK (MAPK) и Akt, что важно для замедления роста опухолевых клеток, снижал уровни активных форм кислорода за счет индуцирования экспрессии ферментов антиоксидантной защиты супероксиддисмутазы и гемоксигеназы 1, повышал экспрессию эритроидного ядерного фактора 2, который активирует экспрессию ферментов антиоксидантной защиты [13].
Потенциальные эстрогенные свойства
Вопрос существования про- или антиэстрогенных эффектов 7-ГМР достаточно спорный. В цитируемом ранее клиническом исследовании с участием здоровых женщин в постменопаузе 7-ГМР быстро абсорбировался и метаболизировался до энтеролактона микробиотой кишечника. Клинически это сопровождалось статистически достоверным снижением частоты приливов на 50% от исходного уровня (p = 0,025, в течение восьми недель, рис. 5) [7]. На основании этого результата некоторые исследователи предположили, что 7-ГМР якобы обладает проэстрогенным действием. Однако данный вывод совершенно не обоснован. Рассмотрим более подробно патофизиологию приливов.
Приливы – вазомоторные симптомы, наиболее часто встречающиеся при менопаузе и гормональных расстройствах репродуктивной системы. Более 80% женщин в менопаузе страдают от приливов, и более чем у 10% из них эти симптомы значительно снижают качество жизни. Считается, что заместительная гормональная терапия эстрогенными препаратами – одно из наиболее эффективных средств устранения приливов [14].
Хотя применение эстрогенов приводит к уменьшению остроты и частоты приливов в 80–90% случаев, осторожность при назначении эстрогенных препаратов следует соблюдать у всех женщин, страдающих раком молочной железы, яичников [15], раком матки [16], венозной тромбоэмболией или имеющим семейную историю рака груди [17]. Кроме того, известны нежелательные эффекты эстрогенной терапии, такие как головная боль, избыточная задержка жидкости, болезненность молочных желез, маточные кровотечения и др. [18].
Важно отметить, что устранение приливов на фоне приема 7-ГМР вовсе не является аргументом в пользу предполагаемого «проэстрогенного» действия 7-ГМР. Дело в том, что приливы возникают вследствие по крайней мере трех патофизиологических механизмов: вегетативного (нарушения регуляции вегетативной нервной системы), абстинентного и гормонально-нейротрансмиттерного (влияние на терморегуляторное ядро гипоталамуса) [19].
Действие эстрогенов связано, по всей видимости, именно с абстинентным механизмом, то есть приливы рассматриваются как проявление своеобразной «абстиненции» эстроген-чувствительных нейрональных систем, находившихся долгое время в условиях высокого содержания эстрогенов. В самом деле, существует определенная схожесть симптоматики менопаузы и симптоматики при абстинентном синдроме в случае болезней зависимости. Косвенно подтверждает возможность абстиненции к эстрогенам провокация приливов при использовании заместительной гормональной терапии у пациенток с первичной аменореей [14].
В то же время влияние того или иного препарата на патофизиологию приливов может осуществляться и по другим механизмам. В медиальной преоптической области гипоталамуса содержится терморегуляторное ядро, активирующее механизмы для поддержания температуры тела в нормальном диапазоне, называемом терморегуляторной зоной. У женщин с приливами границы терморегуляторной зоны уже по сравнению с женщинами, которые не испытывают приливов, что обусловлено избытком катехоламинов и недостатком серотонина [19].
Например, молекула бета-аланин ни в коей мере не может считаться «проэстрогенной», однако бета-аланин эффективен в терапии эстроген-зависимых приливов [20]. Бета-аланин и синтезируемый из него карнозин облегчают симптоматику приливов благодаря антигистаминному эффекту [21]. Бета-аланин необходим для синтеза ацетилкоэнзима А – центрального кофермента биохимических путей, вовлеченных в метаболизм жиров, белков и углеводов. По данным биоинформационного и хемореактомного анализов, ингибирование бета-аланином активности глициновых и NMDA-рецепторов может быть важным механизмом терапевтического эффекта препарата при приливах [19, 22]. Таким образом, влияние на патофизиологию приливов, установленное в рамках того или иного клинического исследования, не может быть доказательством влияния 7-ГМР на рецепторы эстрогенов.
Другой механизм возможного «проэстрогенного» эффекта 7-ГМР заключается в воздействии на уровни эндогенных эстрогенов. Предполагается, что прием растительных лигнанов благотворно сказывается на метаболизме эстрогенов. Например, прием в течение месяца многокомпонентной добавки для профилактики опухолей молочной железы, содержащей 7-ГМР, индол-3-карбинол, глюкарат кальция, экстракты расторопши, крапивы, значительно увеличивал концентрацию 2-гидроксиэстрогена в моче [23]. Однако этот эффект не исследовался отдельно для 7-ГМР, так что вопрос остается открытым.
В целом, все имеющиеся аргументы в защиту предполагаемых «проэстрогенных» эффектов 7-ГМР косвенны. Опубликованных исследований, в которых демонстрировалось бы непосредственное связывание лигнанов и рецепторов эстрогенов, не найдено. По причине отсутствия прямых данных о взаимодействии 7-ГМР и других растительных лигнанов с рецепторами эстрогенов имеющиеся косвенные результаты достаточно противоречивы и зависят от применявшегося метода исследования. Например, при использовании первичных гепатоцитов линий клеток RTH-149 и ZF-L для скрининга эстрогенной активности лигнановых экстрактов in vitro эстрогенную активность измеряли как секрецию белка вителлогенина (эстроген дозозависимо индуцирует секрецию вителлогенина). В результате эстрогенная активность лигнана 7-ГМР не была подтверждена [24].
В другом исследовании потенциальную «эстрогенность» 7-ГМР и энтеролактона оценивали по другой методике: изучалось влияние различных веществ на рост и апоптотические маркеры в клеточной линии MCF-7, чувствительной к эстрогенам. Обнаружено, что испытуемые вещества (7-ГМР, энтеролактон, эстрадиол) увеличивали процент клеток MCF-7 в S-фазе клеточного цикла, причем эффекты 7-ГМР и энтеролактона были снижены в присутствии антагониста рецептора эстрогена (тамоксифена) [25]. Выводы этого эксперимента, проведенного на культуре клеток, тем не менее недостаточно обоснованны. Во-первых, рост клеток линии MCF-7 может происходить не только из-за предполагаемых «проэстрогенных» эффектов 7-ГМР, но и по другим причинам. Во-вторых, тамоксифен может влиять на рост клеток, не только взаимодействуя с рецепторами эстрогенов (например, влиять на апоптоз белков Bcl-2, Bax и др.). В-третьих, не получено прямых доказательств связывания 7-ГМР с рецепторами эстрогенов.
Следует отметить, что при анализе взаимодействий лигнана 7-ГМР со стероидными рецепторами in vitro в концентрациях менее 1,0 мкМ для 7-ГМР не установлено никакой антиандрогенной, эстрогенной или антиэстрогенной активности [26]. Таким образом, молекулярные механизмы влияния 7-ГМР на патофизиологию приливов требуют отдельного изучения.
Противоопухолевые свойства
7-ГМР характеризуется выраженными противоопухолевыми свойствами (профилактика образования опухолей, замедление роста уже имеющихся опухолей). 7-ГМР и его метаболит энтеролактон ингибируют рост модели опухоли молочной железы [27], индуцированной 7,12-диметилбензантраценом. Противоопухолевый эффект 7-ГМР наблюдается уже при использовании достаточно низкой дозы – 4,7 мг/кг/сут [28]. Важно отметить, что противоопухолевый эффект характерен именно для 7-ГМР и матаирезинола, но не для схожей с ними молекулы нортрахелогенина (рис. 6). В отличие от 7-ГМР нортрахелогенин не ингибировал рост индуцированных диметилбензантраценом опухолей молочной железы и не метаболизировался до энтеролактона [27]. Данный результат представляет существенный интерес для установления потенциальных молекулярных механизмов противоопухолевого воздействия 7-ГМР.
В эксперименте 7-ГМР и его метаболит энтеролактон уменьшали рост и метастазы клеток опухоли печени, привитых подкожно крысам (клеток гепатомы линии AH109A). Значение 50%-ной ингибирующей концентрации для пролиферации клеток гепатомы составило 200 мкМ, а для инвазии клеток гепатомы – 144 мкМ. 7-ГМР и энтеролактон подавляли пролиферацию клеток гепатомы, удлиняя время деления клеток гепатомы и увеличивая скорость апоптоза [29].
Противоопухолевый эффект 7-ГМР продемонстрирован на модели рака предстательной железы (ксенотрансплантаты онкоклеток у мышей c резекцией тимуса). Через три дня после инъекций опухолевых клеток мыши начали получать либо стандартную диету, либо стандартную диету, дополненную 7-ГМР (0,15% от общей массы). Затем в течение девяти недель наблюдали скорость роста опухоли. По сравнению с контролем прием 7-ГМР ассоциировался с меньшим объемом опухоли, более медленным темпом ее роста и большей интенсивностью апоптоза опухолевых клеток [30].
В эксперименте показано, что 7-ГМР позволяет осуществлять эффективную профилактику опухолей матки, вызванных однократным воздействием канцерогена N-этил-N'-нитро-N-нитрозогуанидина на крыс в 11-недельном возрасте. После чего осуществлялись дотации 7-ГМР (200 или 600 мг/кг в составе соевой диеты) до возраста 15 месяцев. Заболеваемость аденокарциномой матки была значительно снижена уже при приеме 200 мг/кг 7-ГМР (11%) (доля заболевших в контрольной группе – 50%, р < 0,05). 7-ГМР метаболизировался главным образом в энтеролактон и гидроксиэнтеролактон [31].
7-ГМР в дозе 30 мг/кг/сут статистически значимо ингибировал рост опухоли молочной железы крыс, индуцированной диметилбензантраценом, уменьшал образование полипов и предотвращал накопление бета-катенина в ядре (патофизиологическая метка образования полипов) [9].
Химиопрофилактическая активность 7-ГМР также была показана на модели аденоматозной полипозной кишечной неоплазии у мышей. Среднее число аденом в тонком кишечнике у мышей, получавших 7-ГМР, было значительно ниже (26,6 ± 11,0, р < 0,05) по сравнению с мышами в группе плацебо (инулин, 39,6 ± 8,9, рис. 7). 7-ГМР приводил к нормализации уровня бета-катенина в ткани аденомы, следовательно, 7-ГМР опосредует химиопрофилактический эффект через бета-катениновый сигнальный путь. Заметим, что прием 7-ГМР позволил восстановить внутриядерный уровень бета-катенина в ткани аденомы (0,41 ± 0,25 у.е.) до уровня, обнаруженного в неизмененных клетках окружающей слизистой оболочки (0,36 ± 0,28 у.е.) [32].
В России проведены первые исследования действия 7-ГМР. Так, наблюдение за 30 женщинами, перенесшими миниинвазивное хирургическое лечение по поводу удаления доброкачественных и злокачественных опухолей матки и яичников, показало, что использование в реабилитационном периоде 7-ГМР (препарат Лигнариус) в дозе 30 мг/сут в течение 60 дней позволило достоверно улучшить качество регенерации, повысить антиоксидантный статус пациенток и улучшить переносимость химио- и радиотерапии [33].
Заключение
В перименопаузальный период отмечается нестабильность темпа деления клеток репродуктивной системы, возрастает риск опухолей молочной железы, яичников, рака толстого кишечника, легких. Кроме того, повышается уровень неспецифического системного воспаления, связанного не только с опухолями, но и с сердечно-сосудистыми и цереброваскулярными заболеваниями. Гиперпролиферативный потенциал эстрогенов и их производных, используемых при проведении заместительной гормональной терапии в постменопаузальный период, усугубляет риск возникновения опухолевых заболеваний и тромбоэмболических состояний. При анамнезе, отягощенном по опухолевым заболеваниям, тромбоэмболии, системному воспалению, эффективная и безопасная профилактика жизненно важна. Пероральный прием лигнанов растительного происхождения, характеризующихся крайне низкой токсичностью, – перспективное направление такой профилактики (рис. 8).
Результаты систематического анализа исследований лигнана 7-ГМР указали на его специфические противовоспалительные (ингибирование белка NF-κB, повышение экспрессии ферментов антиоксидантной защиты супероксиддисмутазы и гемоксигеназы 1) и противоопухолевые свойства (ингибирование роста гепатомы, опухолей молочной железы, матки, предстательной железы и аденоматозной полипозной кишечной неоплазии), обусловленные нормализацией темпа деления клеток.
Таким образом, 7-ГМР – перспективное средство химиопрофилактики рака в перименопаузальный период и адъювантного сопровождения терапии эстроген-содежащими препаратами на основе эстрадиола, эстрадиола валерата, эстриола, этинилэстрадиола, гексэстрола, полиэстрадиола фосфата, фосфэстрола и особенно конъюгированных эстрогенов.
Работа выполнена при поддержке РФФИ: грант 18-07-00944
O.A. Gromova, DM, PhD, Prof., I.Yu. Torshin, PhD, A.N. Rubashkina, N.K. Tetruashvili, DM, PhD, Prof., N.P. Lapochkina, DM, PhD
Federal Research Center ‘Computer Science and Control’ of Russian Academy of Sciences, Moscow
Ivanovo State Medical Academy
National Medical Research Center for Obstetrics, Gynecology and Perinatology named after Academician V.I. Kulakov, Moscow
Contact person: Olga Alekseyevna Gromova, unesco.gromova@gmail.com
Systematic analysis of studies of 7-hydroxymatairesinol (7-HMR) indicates high bioavailability (> 50%) and low toxicity of the molecule. In the experiment, oral administration of 7-HMR at a dose of 160 mg/kg/day was not accompanied by the adverse effects, 7-HMR at a dose of 2600 mg/kg/day led to a slight decrease in body weight. Demonstrated anti-inflammatory properties of 7-HMR due to inhibition of NF-κB protein (mediates pro-inflammatory effects of tumor necrosis factor alpha) and increased expression of antioxidant defense enzymes of superoxide dismutase and hemoxygenase. Against the background of the use of 7-HMR at doses of 36 or 72 mg/day, a statistically significant decrease in the frequency of hot flashes was noted. Antitumor properties of 7-HMR are the most studied ones. In the experiments it was found that 7-HMR inhibits the growth of hepatoma, tumors of the breast, uterus, prostate and adenomatous polypus intestinal neoplasia.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.