Введение
Современное понятие «неспецифическая боль в спине» вытеснило использовавшийся прежде диагноз «дорсопатия», заменивший в свою очередь широко употребляемый ранее термин «остеохондроз» [1]. Ввиду высокой частоты дегенеративно-дистрофических поражений позвоночника, обнаруживаемых при рентгенографии у пациентов среднего и пожилого возраста, в 1960-х гг. у врачей и пациентов сформировалось устойчивое представление о зависимости боли от остеохондроза. Распространенность подобных взглядов в медицинской литературе привела к тому, что остеохондроз стал основной жалобой и одним из самых частых диагнозов у пациентов с болями в спине, головными болями и даже головокружениями. Это привело к недопустимому пренебрежению клиническим обследованием пациента. Действительно, зачем тратить время и силы на диагностический поиск, если причина боли все равно кроется в дегенеративно-дистрофическом поражении позвоночника? Однако многочисленные исследования показали, что выраженность рентгенологических проявлений остеохондроза позвоночника не соотносится с локализацией, характером, интенсивностью и длительностью болевого синдрома. Из десяти пациентов с дегенеративно-дистрофическими изменениями в позвоночнике только один имеет клинические проявления боли в спине. Кроме того, «теорию остеохондроза» опровергает сохранность патологических изменений анатомических структур позвоночника при наличии рецидивирующего течения болевого синдрома. В этой связи наличие рентгенологических проявлений остеохондроза у пациента не должно определять ни лечебную, ни экспертную тактику [1–5].
Другой распространенный клинический миф касается грыжи межпозвоночного диска. Так ли она опасна на самом деле и следует ли ее лечить? Бессимптомные грыжи межпозвонковых дисков встречаются во много раз чаще тех грыж, которые вызывают боль в спине, а точнее в спине и конечности (радикулопатия) [2, 3, 5, 6]. Размер грыжи также не имеет значения! Главные факторы, которые обусловливают наличие и характер болевого синдрома, – это направление, в котором пролабирует грыжа, и выраженность аутоиммунной воспалительной реакции организма в ответ на пролабирование пульпозного ядра через дефект фиброзного кольца. Если грыжа направлена в тело позвонка (грыжа Шморля) или в центр позвоночного канала (медиальная грыжа), она будет бессимптомной, то есть радикулопатия не разовьется. Боли в спине у таких пациентов будут скорее всего связаны со снижением высоты межпозвоночного диска, снижением его амортизирующей функции и перераспределением нагрузки на фасеточные суставы пораженного позвоночного двигательного сегмента. Из-за функциональной перегрузки и деформации сустава с рефлекторными мышечно-тоническими синдромами у таких больных прогрессирует остеоартроз [2, 3, 5, 7]. Таким образом, пациенты, имеющие медиальные грыжи межпозвонковых дисков или грыжи Шморля, чаще всего либо не отмечают симптомов совсем, либо страдают неспецифической болью в спине, обусловленной фасеточным синдромом.
Только латеральные грыжи, механически повреждающие корешки нервов или вызывающие вторичные ишемические и дизиммунные процессы, по-настоящему опасны в отношении развития радикулопатии [5, 6, 8]. Заподозрить такую грыжу можно, если боль из спины распространяется в руку или ногу и сопровождается слабостью и чувствительными расстройствами в конечности, симптомами натяжения корешка. Но и латеральная грыжа не является «приговором к операции». Современные медицинские технологии позволяют проводить лечение этих состояний безоперационно (путем блокад) или в крайнем случае малоинвазивными методами (лазерная вапоризация, холодноплазменная аблация) [2, 9, 10]. При консервативной терапии радикулопатий наблюдается типичная ситуация: на фоне лечения (или даже без него) боль в спине исчезает, хотя размер и локализация грыжи не меняются. Проспективные наблюдения за пациентами с компрессионной радикулопатией показывают достоверное уменьшение грыж и секвестраций дисков (в 75–100% случаев) и компрессии неврального содержимого (21–80%) через 14 месяцев даже в отсутствие терапии [4–6].
Постановка клинического диагноза
Современные классификации выделяют два вида боли в спине: неспецифическая (доброкачественная саморазрешающаяся в течение месяца) и специфическая (вторичный характер боли, о котором свидетельствуют симптомы – «красные флажки») [1, 2, 4, 5]. Однако вынесение подобных собирательных терминов в клинический диагноз, на наш взгляд, нецелесообразно, поскольку эти понятия не отображают этиопатогенетических особенностей заболевания у каждого конкретного больного и не определяют направления его лечения. Термин «неспецифическая боль в спине» в международной классификации болезней 10-го пересмотра (МКБ-10) соответствует базовым диагнозам раздела «Дорсалгии»: М54.2 (цервикалгия), М54.5 (люмбалгия), М54.6 (торакалгия), М54.8 (другая дорсалгия), а также частично М54.4 (люмбалгия с ишиасом). Диагнозы М54.1 (радикулопатия) и М54.3 (ишиас) к неспецифической боли в спине отнести не представляется возможным, потому что эти состояния в подавляющем большинстве случаев имеют свою специфическую причину. Например, в разделе М54.1 – это грыжа межпозвоночного диска, вызывающая дискорадикулярный конфликт, в разделе М54.3 – тоннельная невропатия седалищного нерва, обусловленная спазмом грушевидной мышцы.
Наиболее оптимальна для вынесения в клинический диагноз анатомическая классификация спондилогенных болевых синдромов:
- спондилогенная цервикалгия – неспецифическая боль в шейном отделе позвоночника (цервикобрахиалгия при иррадиации боли в руку, цервикокраниалгия при иррадиации в голову);
- спондилогенная торакалгия – неспецифическая боль в грудном отделе позвоночника;
- спондилогенная люмбалгия – неспецифическая боль в нижней части спины (люмбоишиалгия при иррадиации в ногу).
Вышеобозначенные диагнозы по сути столь же неспецифичны, как и устаревший термин «остеохондроз», поэтому требуют уточняющего расширения: с мышечно-тоническим и/или миофасциальным синдромом (обязательное указание вовлеченных мышц), фасеточным синдромом (обязательное указание уровня и стороны вовлеченных фасеточных суставов или как вариант – дисфункция крестцово-подвздошного сочленения), компрессионной радикулопатией (обязательное точное указание уровня заинтересованного корешка). Полезно также оценивать эмоционально-психическое состояние больного, вынося это в сопутствующий диагноз.
Таким образом, развернутый клинический диагноз пациента с хронической иррадиирущей в правую ногу болью в спине без признаков корешковой компрессии может звучать как «хроническая спондилогенная правосторонняя люмбоишиалгия с мышечно-тоническим синдромом подвздошно-поясничной и средней ягодичной мышц, фасеточным синдромом L5–S1 и дисфункцией правого крестцово-подвздошного сочленения, астено-депрессивный синдром» и кодироваться по МКБ-10 как М54.4. Вынесение в диагноз нейроортопедических синдромов не только позволяет уточнить патогенетические особенности заболевания (что важно для оценки динамики состояния больного при следующих визитах), но и обосновывает целесообразность применяемых методов лечения. Среди последних – нестероидные противовоспалительные препараты (НПВП) для купирования боли, миорелаксанты для уменьшения мышечно-тонического синдрома, антидепрессанты для повышения тонуса антиноцицептивной системы, интервенционные методы для локального воздействия на мышечные, суставные или корешковые источники боли, антидепрессанты для активации антиноцицептивной системы, антиконвульсанты для лечения невропатического компонента боли и т.п.
Диагностика
Основными источниками локальной боли в поясничной области в 70–80% случаев считаются миогенные нарушения (спазм, микротравматизация, ишемизация паравертебральных мышц), дисфункция фасеточных суставов (до 40% случаев) и в 5% случаев дискогенная боль [2–5]. К сожалению, данные нейроортопедического обследования часто остаются маловоспроизводимыми и неспецифичными. Такие болевые синдромы, как фасеточный, миофасциальный и мышечно-тонический, нередко являются во многом гомогенными со стороны жалоб и часто имеют «перекрывающиеся» характеристики при клиническом обследовании.
После клинического неврологического и нейроортопедического обследования для уточнения источников болевой импульсации и механизмов развития боли в ряде случаев необходимо применить инструментальные методы [1, 2, 4, 5]. При болях в шейном и поясничном отделах позвоночника и конечностях особое значение имеют методы визуализации, целесообразность применения которых определяется анамнестическими особенностями и наличием изменений в неврологическом и соматическом статусе пациентов. В подавляющем числе случаев острая и хроническая боль в спине – доброкачественное состояние, и большинство пациентов не нуждаются в дополнительных инструментальных исследованиях.
Однако наличие отчетливых неврологических и соматических расстройств («красных флажков») может потребовать срочного параклинического обследования. Так, слабость в мышцах ног, снижение чувствительности в аногенитальной области по типу седловидной анестезии, тазовые нарушения указывают на наличие компрессии корешков конского хвоста и требуют незамедлительного выполнения магнитно-резонансной или компьютерной томографии для решения вопроса о срочном оперативном вмешательстве. Отсутствие связи боли с движением, сохранение ее в ночное время, наличие в анамнезе злокачественного новообразования, ВИЧ-инфекции, приема иммунодепрессантов, беспричинное снижение массы тела, лихорадка и ночной гипергидроз, а также возраст больного младше 20 и старше 50 лет свидетельствуют о необходимости дополнительных методов исследования уже при первом обращении пациента с целью исключения в первую очередь инфекционного и опухолевого поражения позвоночника.
Во всех перечисленных случаях показана рентгенография соответствующих отделов позвоночника в прямой и боковой проекции, взятие общего анализа крови и мочи, а при подозрении на остеомиелит, эпидуральный абсцесс, поражение спинного мозга и корешков, а также в сомнительных случаях – магнитно-резонансная томография соответствующего отдела позвоночника. Если нужно уточнить состояние костных структур, в ряде случаев после рентгенографии выполняют рентгеновскую компьютерную томографию и сцинтиграфию позвоночника. При подозрении на злокачественное новообразование предстательной железы следует определить уровень специфического антигена простаты. При наличии недавней травмы в анамнезе (падение с высоты, дорожно-транспортные происшествия и т.п.), а также при длительном применении кортикостероидов и возрасте пациентов старше 55 лет также показана рентгенография позвоночника, а при недостаточной ее информативности и сохранении боли свыше десяти дней – сцинтиграфия или компьютерная томография позвоночника для исключения компрессионного и иного травматического перелома позвонков. Всем пациентам с интенсивным болевым синдромом длительностью свыше одного месяца, а также всем больным с хроническими болями в спине рекомендовано однократное проведение рентгенографии позвоночника в прямой и боковой проекции с целью исключения в первую очередь опухолевого или инфекционного поражения позвоночника, а также остеопороза. При болевом синдроме в грудной клетке всем пациентам уже при первом обращении целесообразно назначить электрокардиографию и рентгенографию легких для исключения соматической патологии (ишемической болезни сердца, инфекционного и опухолевого поражения легких и плевры) как основной причины болевого синдрома.
При обследовании пациентов с явными ортопедическими дефектами в виде грубого сколиоза, разной длины ног, косого и скрученного таза, патологии тазобедренных суставов определить этиологию боли не составляет больших трудностей. А вот точное выявление источников болевой импульсации, особенно при хронической неспецифической боли в спине, весьма затруднительно [3, 5, 7]. По мнению некоторых ведущих исследователей в этой области, без применения инвазивных методов (дискографии, диагностических блокад) точная диагностика возможна примерно в 40% случаев острых и подострых болей в спине и не более чем в 15% случаев хронических скелетно-мышечных болевых синдромов [5, 8, 9, 11]. С одной стороны, это отражает сложность строения структур поясничной области и связанную с ней трудность точного определения ноциогенной структуры, с другой – утрату первостепенной роли периферических источников боли при хронизации боли. Соответственно различается и подход к лечению острой и хронической неспецифической боли в спине.
Лечение
Традиционно считается, что лечение боли должно в первую очередь воздействовать на этиологические факторы, например, компенсацию разницы длины ног, уменьшение дегенеративных изменений хряща фасеточных суставов, удаление грыжи межпозвоночного диска и т.д. Однако этиотропная терапия часто не купирует ни острую, ни хроническую боль [2, 4, 12]. Это связано с тем, что причиной острых болей, как правило, является воспаление, которое обусловливает необходимость патогенетического лечения противовоспалительными препаратами. В основе хронических болей лежат изменения в центральной и периферической нервной системе (периферическая и центральная сенситизация, снижение нисходящих ингибирующих влияний антиноцицептивной системы), которые как бы «отрывают» боль от первопричины заболевания, делая ее самостоятельной болезнью. В таких случаях требуется патогенетическое лечение антидепрессантами или антиконвульсантами [1, 3, 5].
При острой боли в спине необходимо максимально быстро избавить пациента от мучительных болей во избежание хронизации заболевания, вызванной сенситизацией периферической и центральной нервной систем, «бомбардируемых» болевыми импульсами от воспаленных мышц, связок, фасеточных суставов и других структур позвоночника. Это достигается симптоматическими и патогенетическими методами лечения (прежде всего приемом НПВП и миорелаксантов) и попросту недоступно при этиотропной терапии, при которой для этого нужен продолжительный период времени [1–3].
Для профилактики хронизации острой скелетно-мышечной боли в спине надо как можно раньше начать обезболивающую терапию и ограничить нагрузку на пораженный отдел позвоночника путем фиксации специальными ортопедическими пособиями (корсетом, шиной Шанца в зависимости от пораженного отдела). Микротравмы в процессе реабилитации способны вызвать кинезиофобию (страх движения), а также ускорить процессы хронизации, растормаживая (сенситизируя) потоком афферентной болевой информации соответствующие отделы спинного и головного мозга. В связи с этим современный подход к лечению острой боли в спине подразумевает максимально раннее назначение препаратов, воздействующих в первую очередь на патофизиологические механизмы боли независимо от их этиологической природы [1–3, 5, 7].
Нестероидные противовоспалительные препараты
Ключевым направлением в симптоматическом и патогенетическом лечении боли в спине является применение НПВП, блокирующих выработку медиаторов воспаления – простагландинов – за счет ингибирования фермента циклооксигеназы (ЦОГ). Открытие двух изоформ ЦОГ – тканевой (или конституциональной) ЦОГ-1, постоянно присутствующей в большинстве тканей и осуществляющей синтез простагландинов, участвующих в реализации физиологических функций, и индуцибельной ЦОГ-2, существенно увеличивающей свой уровень на фоне воспаления, – позволило лучше понимать механизмы, лежащие в основе эффективности и токсичности НПВП.
Обе изоформы ЦОГ продуцируются и в периферических тканях, и в клетках центральной нервной системы. ЦОГ-2 образуется в зоне воспаления и в клетках спинного и головного мозга под действием повреждающих стимулов с периферии. Неселективные НПВП блокируют активность обеих изоформ ЦОГ, что приводит к ряду побочных эффектов, которые связаны с ингибированием ЦОГ-1, прежде всего к поражению желудочно-кишечного тракта (ЖКТ), причем на всем его протяжении (стоматит, эзофагит, гастрит, язва желудка и двенадцатиперстной кишки, энтерит, язвенный колит, проктит). Следует обратить внимание на то, что, будучи хорошими анальгетиками, неселективные НПВП блокируют висцеральные болевые ощущения, поэтому язвенное поражение ЖКТ у таких больных зачастую протекает бессимптомно, заканчиваясь либо кровотечением, либо перфорацией язвы с последующим развитием перитонита. Применение парентеральных форм неселективных НПВП (инъекции и суппозитории) не позволяет избежать вышеуказанных побочных явлений, так как при этом создается высокая концентрация препарата в сыворотке крови, что сопровождается системным воздействием на организм [1]. НПВП, обладающие повышенной избирательностью по отношению к индуцибельной ЦОГ, то есть селективные блокаторы изофермента ЦОГ-2, имеют более высокую степень безопасности в отношении ЖКТ, чем неселективные (рис. 1). Так, профиль безопасности производного эноликоновой кислоты мелоксикама (препарат Мовалис) в дозах 7,5 и 15 мг достоверно лучше, чем у золотого стандарта противовоспалительной терапии – диклофенака [13]. Примечательно, что даже прием химически нейтральных веществ (в данном случае этот термин уместнее, чем слово «плацебо», означающее «нравящийся», «благостный») сопровождался побочными явлениями со стороны ЖКТ – этот эффект в литературе получил название «ноцебо» [3]. В этой связи при высокой вероятности риска развития эрозивно-язвенных процессов в ЖКТ у больных с анамнезом язвенной болезни ЖКТ и НПВП-гастропатий и энтеропатий на фоне приема любых НПВП оправданна профилактика осложнений в виде назначения ингибиторов протонной помпы (омепразола), мизопростола [1, 2].
Наилучший профиль безопасности среди НПВП в отношении ЖКТ показал также мелоксикам (Мовалис). По данным метаанализа 35 рандомизированных клинических исследований, включавших более 27 тысяч пациентов (рис. 2), мелоксикам в дозе 7,5 мг оказался самым безопасным НПВП с точки зрения риска развития осложнений со стороны ЖКТ (диспепсии, появления язв и кровотечений). При повышении дозы мелоксикама до 15 мг риск возникновения побочных явлений возрастал, но все равно оставался значительно ниже, чем у других НПВП [13, 14]. Препарат Мовалис представлен на российском рынке с 1996 г. Около 20 лет назад врачи впервые получили парентеральный препарат для купирования острого болевого синдрома с селективным ингибированием ЦОГ-2 (ампулы Мовалис № 3). В 2015 г. препарат Мовалис расширил свою линейку новой парентеральной формой – ампулами № 5, что увеличило экономическую доступность инъекционной терапии этим оригинальным препаратом как для больных, так и для медучреждений.
Необходимо помнить, что НПВП особенно эффективны на ранних стадиях развития боли в спине. Именно на этапе острой и подострой боли с помощью традиционных НПВП можно воздействовать на выработку периферических медиаторов воспаления. В дальнейшем, когда включаются центральные патофизиологические механизмы боли, эффективность монотерапии НПВП снижается. Следует также отметить, что при острой боли в спине НПВП не рекомендуются для монотерапии дольше 10–14 дней. Если недельный курс приема препарата не купирует болевой синдром, это должно побудить врача пересмотреть тактику лечения, привлечь невролога, который поможет разобраться в структуре болевого синдрома, выявляя признаки серьезной патологии и выясняя причины неэффективности НПВП в каждом конкретном случае [1, 2, 4]. Причин такой неэффективности может быть несколько: плохое кровоснабжение в очаге воспаления (тогда противовоспалительный препарат можно ввести адресно прямо в эпицентр боли и воспаления путем блокады с местными анестетиками под ультразвуковым или рентгеноскопическим контролем) или стойкий спазм паравертебральных мышц с формированием порочного круга «боль – спазм – боль» [12].
Недостаточная эффективность монотерапии НПВП при мышечно-тонических болевых синдромах и при хронизации боли в спине обусловлена тем, что они просто не способны «успокоить» расторможенные отделы нервной системы. Для воздействия на патогенетические механизмы хронизации боли в спине (прежде всего на мышечный спазм) на втором этапе лечения используют миорелаксанты (баклофен 10–30 мг/сут, тизанидин 6–12 мг/сут, толперизон 150–450 мг/сут). Основной механизм действия вышеперечисленных препаратов реализуется путем торможения возбуждения двигательного нейрона в ответ на болевые стимулы и эмоциональный дискомфорт.
Альфа-2-адреномиметик тизанидин нормализует повышенный мышечный тонус, блокируя выделение возбуждающего нейротрансмиттера глутамата в двигательных нейронах переднего рога спинного мозга, а также активирует нисходящие антиноцицептивные влияния голубого пятна ствола мозга. Блокатор натриевых каналов толперизон подавляет ретикулоспинальные растормаживающие воздействия на гамма-мотонейроны, регулирующие тонус мышц. Активатор рецепторов гамма-аминомасляной кислоты (ГАМК) ГАМКB баклофен опосредованно воздействует на кальциевые каналы двигательных и чувствительных нейронов спинного мозга, подавляя медленные постсинаптические потенциалы, суммирующиеся в болевые импульсы и повышение тонуса мышц, а также уменьшая возбудимость нейронов лимбической системы и, соответственно, тревожность пациентов. Этим свойством, хоть и в меньшей мере, обладает «дневной транквилизатор» аминофенилмасляная кислота (Фенибут, Ноофен), также воздействующий через ГАМКB-рецепторы. Таким образом, миорелаксанты оказывают обезболивающее действие, помогая расторможенным отделам нервной системы вернуться в состояние покоя, то есть стирая «болевую память». Это не только уменьшает выраженность боли при хроническом болевом синдроме, но и предотвращает усиление острой боли и переход ее в хроническую форму [2, 5, 12].
При недостаточной эффективности НПВП в сочетании с миорелаксантами возможно, но крайне нежелательно кратковременное (несколько дней) использование слабых наркотических анальгетиков (трамадол 50–200 мг/сут). Наркотические анальгетики на время дают облегчение, но вызывают привыкание (с каждым разом требуются все большие дозы) и лекарственную зависимость (пациент уже не может обходиться без этих препаратов). В этой связи применение опиатов дольше десяти дней не рекомендуется и допустимо лишь при самых интенсивных (> 70 мм по визуальной аналоговой шкале) ноцицептивных и невропатических болях в спине и неэффективности НПВП и адъювантных анальгетиков в качестве третьей ступени обезболивающей терапии, рекомендованной Всемирной организацией здравоохранения [1, 2, 4].
Симптом-модифицирующие препараты медленного действия
В качестве базисной патогенетической терапии суставной патологии (остеоартроза фасеточных суставов и крестцово-подвздошных сочленений) при хронической суставно-мышечной боли в спине наряду с НПВП широко используются так называемые симптом-модифицирующие препараты медленного действия (Symhtomatic Slow Acting Drug for Osteoarthritis – SYSADOA), в частности содержащие комбинацию глюкозамина и хондроитина сульфата (Артра). Они также оказывают обезболивающее и противовоспалительное действие, но лишены характерных для НПВП побочных эффектов, так как механизм их противовоспалительного действия не связан с подавлением синтеза простагландинов, а обусловлен блокированием ядерного фактора каппа-Б, инициирующего распад хрящевой ткани.
Применение SYSADOA (Артра 500 мг два раза в день три недели, далее 500 мг в день три месяца) при хронической боли в спине приводит к медленному, в течение двух-трех месяцев, снижению интенсивности болевого синдрома на 50–70%. При этом использование больными дополнительных анальгетиков (НПВП, анальгетиков центрального действия) в первый же месяц лечения SYSADOA снижается вдвое, а в конце трехмесячного курса лечения потребность в обезболивающих сокращается в десять раз [15]. Основанием для применения SYSADOA служат как результаты многолетнего, безопасного и успешного применения этих препаратов при остеоартрозе (уровень доказательности 1А), так и общность воспалительно-дегенеративных процессов, происходящих в суставах конечностей и межпозвонковых (фасеточных) суставах. Терапия SYSADOA позволяет постепенно значительно уменьшить дозировки НПВП. Учитывая хроническое течение суставной патологии, требующее длительной противовоспалительной и обезболивающей фармакотерапии, и распространенную коморбидность, применение SYSADOA существенно снижает риск возникновения побочных эффектов от НПВП [3].
Немедикаментозные методы
При отсутствии противопоказаний желательно дополнить лечение немедикаментозными методами: тепловыми физиопроцедурами, мануальной терапией, вакуумным и ручным массажем. В некоторых случаях применение только вышеуказанных физиотерапевтических методов и/или ударно-волновой терапии без дополнительного медикаментозного воздействия позволяет достичь релаксации паравертебральных мышц и восстановить микроциркуляцию в миофасциальных триггерных зонах [3, 16].
Следует отметить, что на первом и втором этапах лечения пациенты с острыми болями в спине не нуждаются в обязательной консультации невролога или ревматолога и наблюдаются врачом общей практики, а затем врачом лечебной физкультуры. При острых скелетно-мышечных болях в спине нет необходимости в соблюдении постельного режима даже в первые дни заболевания, а также в использовании опоры при передвижении (трости или костыля). Следует убедить пациента, что посильная физическая нагрузка не опасна, посоветовать поддерживать повседневную активность, а после купирования острого болевого синдрома как можно скорее приступить к работе, не забывая при этом о лечебной физкультуре для предотвращения последующих эпизодов болей в спине [1–5, 16].
Интервенционные методы обезболивания
Дополнительным и наиболее эффективным малоинвазивным методом терапии скелетно-мышечных болей в спине на любом этапе лечения оказывается локальное инъекционное введение (блокада) лекарственного препарата, обладающего противоотечным и противовоспалительным действием, в очаг воспаления и устойчивого мышечного спазма [2, 8–11, 16]. Такой способ введения применяется для местных анестетиков, а также НПВП и глюкокортикоидов эпидурально, фораминально, параартикулярно в фасеточные суставы, в миофасциальные триггерные точки и др. Однако такая интервенционная терапия требует наличия специальных навыков у врача, осуществляющего эту процедуру, а в ряде случаев высокотехнологической аппаратуры, обеспечивающей правильное попадание иглы в пораженную область (рентгенографической установки с электронно-оптическим преобразователем или ультразвукового сканера). В этой связи методика блокад пока еще не распространена повсеместно, хотя и используется в медицине более ста лет – с 1906 г., когда H. Sellheim впервые применил паравертебральную блокаду межреберного нерва, вводя раствор новокаина, двумя годами ранее синтезированного A. Einhorn. Первооткрывателем интервенционных методов обезболивания был В.К. фон Анреп, который в 1879 г., проводя на себе эксперименты, первым в мире открыл местное анестезирующее действие кокаина, разработал дозирование и методику его применения.
По своему назначению блокады подразделяются на диагностические, прогностические и лечебные. С помощью диагностических блокад осуществляется уточнение диагноза ex juvantibus. Цель прогностической блокады – обозначить границы эффективности лечения и дать временно почувствовать пациенту, что он будет испытывать после высокочастотной денервации сустава или деструкции нерва и сможет ли он переносить чувствительные и вегетативные нарушения, возникшие в результате данного воздействия [11].
При проведении лечебных блокад используется большой арсенал медикаментозных средств, что, с одной стороны, определяется фармакодинамикой и механизмом их действия, с другой – этиопатогенетическими особенностями развития боли в спине.
Применяемые препараты делятся на две группы: основные (базовые) и дополнительные. В связи с быстрым наступлением обезболивающего действия в качестве базового средства для всех видов блокад (лечебных, диагностических или прогностических) наибольшее применение нашли местные анестетики [2, 9, 16]. К сожалению, продолжительность действия местных анестетиков составляет несколько десятков минут. Кроме того, они не обладают противовоспалительной и противоотечной активностью, поэтому длительное лечебное действие при их использовании в большинстве случаев невозможно.
К числу дополнительных препаратов, применяющихся для лечения боли в спине в интервенционной терапии миофасциальных, фасеточных и радикулярных болей (в лечебных блокадах), относятся гормональные средства (глюкокортикоиды). Их использование основано на противовоспалительном, десенсибилизирующем и противоотечном действии как локально в тканях, так и системно в организме [2, 9, 10]. Именно из-за системного действия глюкокортикоиды следует с осторожностью применять у пожилых пациентов, при сахарном диабете, гипертонической болезни, заболеваниях ЖКТ, сердечной недостаточности, сниженном иммунном статусе и при инфекционных заболеваниях. Альтернативными дополнительными препаратами, лишенными побочных эффектов глюкокортикоидов, являются НПВП. Они используются преимущественно для инфильтраций (блокад) триггерных зон мышц при миофасциальных синдромах и параартикулярных блокад при фасеточном синдроме.
Локальная инъекционная терапия (лечебные блокады) мелоксикамом (Мовалисом) отличается высоким профилем безопасности при миофасциальных болевых синдромах. Кроме того, Мовалис может использоваться для футлярных блокад, например, при тоннельных синдромах. Для лечебных блокад используется 1,5 мл 1%-ного раствора Мовалиса и 1–10 мл местного анестетика (0,5% новокаина) в зависимости от размеров инфильтрируемой триггерной зоны и интенсивности болевого синдрома. Добавление Мовалиса в раствор анестетика повышает эффективность и длительность обезболивающего действия новокаина за счет воздействия на механизмы воспаления, лежащие в основе патогенеза миофасциального и фасеточного болевых синдромов, а использование интервенционных техник введения создает высокую концентрацию действующего вещества в очаге воспаления [16]. Следует отметить, что в отличие от Мовалиса большинство дженериков мелоксикама непригодны для локальной инъекционной терапии, поскольку при смешивании с раствором новокаина мутнеют. Это свидетельствует о химической реакции, которая может привести к непредсказуемым последствиям при введении в мышцы – от некроза тканей (синдром Николау) до тяжелых аллергических реакций.
Помимо лечебных целей в ряде случаев проведение блокад необходимо для диагностики и определения оптимальной стратегии последующего лечения. Так, например, диагностическая блокада фасеточного сустава или крестцово-подвздошного сочленения раствором местного анестетика (2% лидокаина или 0,5% новокаина) позволяет не только определить источник боли в спине, но и предсказать эффективность малоинвазивной нейрохирургической процедуры – высокочастотной денервации сустава [3, 11]. Понятно, что без НПВП (Мовалиса) и/или глюкокортикоида длительность обезболивающего действия анестетика составит всего лишь несколько часов, но при исчезновении у пациента после блокады болевого синдрома хотя бы на час можно уверенно говорить о том, что процедура денервации будет эффективна – в этом случае блокаду можно рассматривать как прогностическую.
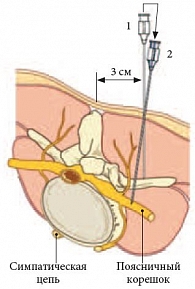
Таким же образом определяется прогноз эффективности внутридисковой электротермической аннулопластики, лазерной вапоризации или холодноплазменной аблации межпозвонкового диска при радикулопатии. Если интрафораминальное введение анестетика под контролем компьютерной томографии устраняет болевой синдром, то вышеуказанные малоинвазивные пункционные нейрохирургические воздействия могут быть эффективными [6, 8, 9]. Следует отметить, что в ряде случаев достаточный терапевтический эффект имеет интрафораминальное введение вместе с местным анестетиком раствора глюкокортикоида (например, бетаметазона), обеспечивающего патогенетическое воздействие на аутоиммунные и компрессионно-ишемические механизмы дискорадикулярного конфликта (противовоспалительное, противоотечное и ремиелинизирующее действие) [8, 10] или введение 1,5 мл 1%-ного раствора мелоксикама (Мовалиса) и 1 мл 0,5%-ного раствора новокаина, показавшего свою высокую эффективность и безопасность в малоинвазивном лечении радикулопатии [16, 17]. Отметим, что для выполнения фораминальной блокады на поясничном уровне (рис. 3) требуются специальные навыки.
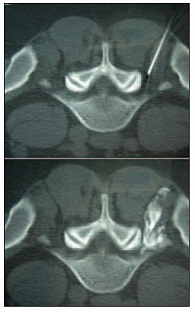
Срединная область поясничного отдела позвоночника и латеральнее расположенный участок кожи площадью 10 × 5 см обрабатываются раствором антисептика. Нащупываются гребни подвздошных костей, и раствором бриллиантового зеленого намечается межгребневая линия Якоби (она проходит на уровне нижнего края остистого отростка L4 или межпозвонкового пространства L4–L5). Отсчитываются остистые отростки поясничных позвонков до намеченного уровня блокады и маркируются бриллиантовым зеленым. Точка пункции расположена на 2,5–3 см латеральнее остистого отростка на уровне его краниального края. Эта точка проецируется на место выхода поясничного нерва из-под поперечного отростка соответствующего позвонка. Игла для спинальной анестезии длиной 70–90 мм (в зависимости от роста и массы тела пациента) вводится перпендикулярно к поверхности кожи на глубину примерно 3–5 см (у крупных пациентов это расстояние может достигать 7 см) до упора в поперечный отросток позвонка, который обходится по нижнему краю путем отведения канюли рострально, и игла медленно продвигается в каудальном направлении на 1,5–2 см к месту выхода нервного корешка. На этом этапе при введении иглы у больного может появиться ощущение прострела по типу «прохождения электротока» в зоне иннервации блокируемого корешка, что в подавляющем большинстве случаев свидетельствует о раздражении перинервия и не влечет осложнений, если выдвинуть иглу на 1 мм обратно. Убедившись в том, что аспирационная проба отрицательная, врач вводит не более 2 мл раствора. Если ввести больший объем, то раствор начинает распространяться обратно по ходу иглы (рис. 4), при этом концентрация действующего вещества (глюкокортикоида или мелоксикама) в очаге дискорадикулярного конфликта при разбавлении большим объемом анестетика может оказаться недостаточной для купирования отека и воспаления. У больных при введении раствора могут возникать парестезии в зоне иннервации блокируемого корешка, свидетельствующие о точном «попадании».
Через две – пять минут следует выяснить, изменился ли характер боли, усугубились ли нарушения чувствительности, есть ли признаки пареза «контрольных» мышц, иннервируемых этим корешком. Появление дефицитарных расстройств после блокады также свидетельствует о правильном «попадании» и не влечет осложнений – обычно чувствительные и двигательные нарушения регрессируют в течение нескольких десятков минут (зависит от длительности действия анестетика). Об эффективности блокады можно судить по снижению интенсивности болевого синдрома и увеличению угла поднимания ноги, как прямого, так и перекрестного, при исследовании симптома Ласега.
Обычно успешно проведенной фораминальной блокады достаточно для того, чтобы уменьшить выраженность болевых ощущений и чувствительных (а иногда и двигательных) расстройств до следующего обострения радикулопатии, вызванного неправильным образом жизни больного. В случае недостаточной по времени эффективности лечебных фораминальных блокад и при условии наличия несеквестрированной латеральной (фораминальной) грыжи диска (менее 7 мм) проводится малоинвазивная процедура лазерной вапоризации (или ее модификация – фораминопластика), холодноплазменной аблации или внутридисковой электротермической аннулопластики, которая эффективна у 50–65% пациентов [6]. Если и эта пункционная процедура не приводит к регрессу болевого синдрома, тогда выполняется оперативное нейрохирургическое вмешательство открытым доступом. Вопрос о пункционных или открытых нейрохирургических вмешательствах при болях в спине ставится в случае неэффективности правильно проводимой консервативной терапии в течение трех месяцев. К сожалению, нередко оперативное вмешательство проводится при отсутствии должных показаний (прогрессирующего пареза иннервируемых пораженным корешком мышц конечности, тазовых нарушений, перемежающейся хромоты, вызванной стенозом позвоночного канала), что чревато формированием хронического постдискэктомического болевого синдрома, обусловленного множеством факторов (нарушением биомеханики движения в оперированном сегменте позвоночника, спаечным процессом, хроническим эпидуритом и т.п.) [2, 4, 5]. Определение целесообразности оперативного лечения радикулопатии у пациента с грыжей межпозвоночного диска – прерогатива невролога, но окончательное решение о тактике лечения все равно остается за больным. Немаловажным фактором для достижения положительного результата может быть желание пациента сделать блокаду или быть прооперированным, а также его убежденность в отношении пользы данного метода лечения при условии полной информированности со стороны лечащего врача. Если больным положительно воспринимаются более инвазивные методы лечения или если психосоциальные или экономические факторы требуют более быстрого восстановления, то рассмотрение хирургического лечения оправданно.
Антидепрессанты
Частое наличие депрессии у пациентов с хронической болью в спине послужило поводом к включению в стандарты терапии антидепрессантов, которые неожиданно оказались весьма эффективны в лечении всех видов хронической боли, независимо от наличия коморбидной депрессии. Более того, выяснилось, что анальгетический эффект антидепрессантов развивается значительно раньше тимолептического. Это побудило исследователей искать механизмы действия этого класса психотропных препаратов при болевых синдромах. Полагают, что антидепрессанты повышают активность эндогенной подавляющей боль (антиноцицептивной) системы мозга за счет повышения концентрации ключевых нейромедиаторов антиноцицептивной системы – серотонина и норадреналина [1, 2, 4, 5]. Применение антидепрессантов в лечении хронических болей в спине ограничивают выраженные побочные явления (сонливость, потеря координации движений, повышение артериального давления, задержка мочи) и синдром отмены (возобновление болей, развитие тревоги, психомоторного возбуждения и даже судорожных припадков при резком прекращении приема этих лекарств). В этой связи назначать антидепрессанты и контролировать их постепенную отмену после не менее двух месяцев приема при хронической боли в спине должен только невролог или психиатр.
Витамины группы В
Для активации регенеративных процессов в периферических нервах при радикулопатии используются нейротропные комплексы, содержащие большие дозы витаминов группы В (В1 В6, B12). Применение витамина В12 способствует не только ремиелинизации, но и снижению интенсивности болевого синдрома. Пиридоксин участвует в синтезе сфингозина – структурного элемента мембраны нервного волокна и нейромедиаторов (серотонина, норадреналина). Таким образом, оба нейротропных компонента увеличивают скорость проведения нервного импульса и улучшают его репаративные свойства. Доказано патогенетическое воздействие тиамина, который улучшает аксоплазматический ток и восстанавливает трофическую функцию нейрона [2, 3, 16].
Антиоксиданты
Получены данные об эффективности антиоксидантов (препаратов тиоктовой кислоты) в патогенетическом лечении чувствительных и двигательных расстройств у больных с радикулопатиями.
Заключение
Поведенческая и когнитивно-поведенческая психотерапия помогает скорректировать неправильные, препятствующие выздоровлению представления пациента о природе своего заболевания, изменить социальное подкрепление болевого поведения, уменьшить зависимость от анальгетической терапии и повысить уровень повседневной активности. Анализ литературных данных, касающихся диагностики и лечения боли, а также наш собственный клинический опыт показывают, что ни один из отдельно применяющихся методов интервенционного и неинтервенционного фармакологического, физического или психологического лечения боли в спине не может сравниться по своей эффективности с междисциплинарным подходом, когда все вышеуказанные методы, назначенные комплексно, потенцируются.

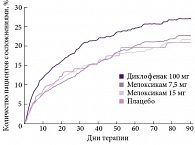
![Рис. 2. Частота развития клинически значимых побочных явлений на фоне приема НПВП со стороны ЖКТ в 35 клинических исследованиях (n = 27 039) [14]](/upload/resize_cache/iblock/f13/195_350_1/6_2.jpg)