Тиоктовая кислота: от клеточных механизмов регуляции к клинической практике
- Аннотация
- Статья
- Ссылки

Распространенность сахарного диабета (СД) 2 типа во всем мире достигла масштабов настоящей эпидемии. Согласно прогнозам эпидемиологов ВОЗ, к 2030 г. 439 млн взрослых во всем мире будут страдать СД 2 типа. В связи с этим необходим поиск новых методов адекватной коррекции гликемии, а также эффективных методов предупреждения и лечения диабетических микро- и макроангиопатий. К числу современных и перспективных лекарственных средств для терапии и профилактики диабетических нейропатий следует отнести тиоктовую (альфа-липоевую) кислоту, представляющую собой антиоксидант с многообразным положительным влиянием на патогенез сахарного диабета. В настоящее время накоплен значительный положительный опыт применения препаратов тиоктовой кислоты у пациентов с СД.
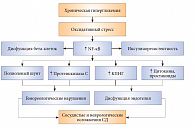
Хорошо известно, что осложнениями, определяющими качество и продолжительность жизни пациентов с СД, являются диабетические микро- и макроангиопатии, ведущую роль в развитии которых играет хроническая гипергликемия. Ключевыми звеньями патогенеза СД 2 типа являются инсулинорезистентность периферических тканей и компенсаторная гиперинсулинемия, которые взаимно отягощают друг друга. Это приводит к развитию гипергликемии, которая, согласно современным представлениям, через аутоокисление глюкозы вызывает активизацию процессов свободно-радикального окисления (СРО).
Повреждение фосфолипидного слоя плазматических мембран тканей-мишеней и бета-клеток в результате перекисного окисления липидов способствует прогрессированию инсулинорезистентности и снижению секреции инсулина вследствие активации апоптоза бета-клеток. При этом следует подчеркнуть, что оксидативный стресс (ОС) играет важную роль в патогенезе инсулинорезистентности еще до развития СД [1].
Роль оксидативного стресса в патогенезе СД и его осложнений
- повышенное образование активных форм кислорода (АФК), образующихся при окислении углеводов в результате аутоокисления жирных кислот в триглицеридах, фосфолипидах и эфирах холестерина;
- снижение активности антиоксидантных систем организма;
- активация полиолового пути утилизации глюкозы, что приводит к накоплению сорбитола и фруктозы, уменьшению содержания миоинозитола и снижению активности Na+-K+-ATФазы;
- накопление конечных продуктов неферментативного гликозилирования белков (КПНГ);
- синтез провоспалительных медиаторов;
- нарушение концентрации или обмена глютатиона и ионов некоторых металлов.
Гиперлипидемия, ишемия и гипоксия тканей, наблюдаемые при СД, являются дополнительными факторами, способствующими повышенному образованию свободных радикалов и развитию ОС. В механизмах активации ОС при диабете участвует и фактор гиперинсулинемии, который усиливает активность симпатической нервной системы. Результатом гиперсимпатикотонии является увеличение образования свободных радикалов, как непосредственно, так и через повышение продукции неэстерифицированных жирных кислот, что усиливает неблагоприятные эффекты гипергликемии [3].
Свободными радикалами называют молекулы с неспаренным электроном на внешней орбите, обладающие повышенной реакционной способностью и участвующие в переносе электрона флавиновыми элементами, обновлении состава липидов биомембран, окислительном фосфорилировании в митохондриях, митогенезе, проведении нервного импульса и др. Однако в условиях СД происходит «перепроизводство» свободных радикалов, поскольку при хронической гипергликемии и подавлении активности ферментов гликолиза окисление глюкозы происходит альтернативными путями (полиоловый, гексозаминовый и путь неферментативного гликозилирования).
В последнее время большое внимание уделяется изучению оксидации белковых молекул посредством активных форм кислорода (АФК). Установлено, что окисленные модифицированные белки продуцируют свободные радикалы, что приводит к истощению клеточных антиоксидантов. Карбонильные интермедиаты (глиоксаль, метилглиоксаль, 3-деоксиглюкозон) обеспечивают окислительное гликирование белков, формируя конечные продукты неферментативного гликозилирования, которые, в свою очередь, могут быть источниками АФК.
Связывание конечных продуктов неферментативного гликозилирования с эндотелиальными рецепторами запускает оксидативный стресс в клетке. Появление свободных радикалов в клетке активирует транскрипционный фактор NF-κB, который поступает в ядро и запускает экспрессию генов определенных белков, например, фактора адгезии лейкоцитов, цитокинов, сосудосуживающего фактора эндотелина-1 и тканевых факторов, а также генов других белков, принимающих участие в патогенезе диабетических осложнений. Транскрипционный фактор NF-κB является своего рода посредником между метаболическими и сосудистыми нарушениями, поскольку через активирование NF-κB реализуются эндотелиальная дисфункция, стресс-чувствительные механизмы развития инсулинорезистентности, дефицит секреции и активности инсулина.
Кроме того, активация NF-κB объясняет многие сосудистые нарушения, в том числе изменения сосудистой проницаемости, активности факторов роста, экстрацеллюлярных компонентов матрикса, апоптоз. Многие авторы указывают на важную роль протеинкиназы С (PKC) в развитии эндотелиальной дисфункции, а также в активации экспрессии гена сосудистого эндотелиального фактора роста, который оказывает влияние на сосудистую проницаемость и ангиогенез через РКС-зависимые пути и стресс-активированные протеинкиназы, что способствует развитию диабетических микро- и макроангиопатий. Кроме того, повышение содержания РКС приводит к активации адгезии тромбоцитов к сосудистой стенке и ускоренному развитию атероматоза [4, 5, 6].
Одной из причин эндотелиальной дисфункции при СД является снижение активности NO-синтазы. Переход на полиоловый путь утилизации глюкозы в условиях гипергликемии вызывает активацию ферментов сорбитолдегидрогеназы и альдозоредуктазы, что приводит к увеличению соотношения NADH/NAD+ и NADP+/NADPH. Недостаток NADPH нарушает процесс восстановления таких антиоксидантов, как глутатион и витамин С, и является одной из причин подавления активности NO-синтазы [7]. Помимо этого активность супероксиддисмутазы и каталазы ингибируется гликозилированием и еще более усугубляет ОС. Гликозилирование существенно влияет на скорость модифицирования ЛПНП, а значит, ускоряет прогрессирование атеросклероза.
В физиологических условиях процессы СРО уравновешиваются системой естественных антиоксидантов и биоантиокислителей. Одним из важнейших показателей гомеостаза является сохранение равновесия между скоростью ПОЛ и активностью антиоксидантной системы (витамины Е, С, В, супероксиддисмутаза, каталаза, глютатионтрансфераза, глютатионпероксидаза, глютатионредуктаза и др.). Механизм и степень выраженности антиоксидантного действия различных соединений зависит от того, в какой среде или структуре он реализует свой антиоксидантный эффект (табл. 1).
Антиоксиданты, обладающие наибольшей растворимостью в цитоплазме и внеклеточной жидкости, реализуют свое антиоксидантное действие вне клетки. Жирорастворимые антиоксиданты защищают от свободных радикалов плазматический слой клеточной мембраны, состоящий из фосфолипидов. Внутриклеточная защита осуществляется антиоксидантами, которые могут растворяться как в воде, так и жирах, поскольку они сначала должны проникнуть через клеточную мембрану, а затем лишь растворяться в цитозоле. К таким соединениям относится только один антиоксидант – альфа-липоевая кислота, поскольку она представлена во всех трех средах: внеклеточной жидкости, мембране и цитозоле клетки. Более того, синтез соединений, обладающих антиоксидантными свойствами, может осуществляться не только внутри клеток, но и в митохондриях, а система антиоксидантной защиты включает несколько десятков соединений, которые в зависимости от их количества могут обладать не только антиоксидантными, но и прооксидантными свойствами [7].
Важно отметить, что ключевым внутриклеточным антиоксидантом, участвующим в биохимических превращениях витаминов С и Е, липоевой кислоты, убихинона, в регуляции тиосульфидного равновесия и синтеза нуклеиновых кислот, в сохранении оптимального состояния и функций биологических мембран, в обмене эйкозаноидов – простагландинов и лейкотриенов – является глутатион. Глутатион выступает в качестве резерва цистеина в клетке, принимает участие в регуляции синтеза белков теплового шока, а также в реализации механизмов апоптоза. Глутатион участвует в преобразовании цитотоксичного продукта метилглиоксаля в лактат, осуществляя детоксикационную функцию [6]. В свете изложенного интересен тот факт, что альфа-липоевая кислота играет уникальную с точки зрения антиоксидантной защиты роль редуктанта. Редокс-потенциал (-320 мВ) альфа-липоевой кислоты ниже, чем у системы глутатиона (-280 мВ), следовательно, при уменьшении редокс-потенциала альфа-липоевая кислота способна восстанавливать глутатион, а также сокращать переход цистеина в цистин, что весьма важно для антиоксидантной защиты.
Исследование концентраций продуктов свободнорадикального окисления у больных СД свидетельствует о максимальной выраженности ОС в фазе декомпенсации заболевания, особенно при развитии кетоацидоза. Тем не менее достижение нормогликемии не всегда приводит к спонтанной нормализации активности свободнорадикального окисления [8]. Вышеизложенные факты являются обоснованием необходимости антиоксидантной терапии СД и его осложнений. В настоящее время антиоксидантная терапия может рассматриваться как один из обязательных компонентов комплексной терапии СД.
Среди значительного числа природных и синтетических антиоксидантов, известных в настоящее время, особое место занимают препараты альфа-липоевой кислоты (АЛК), которая обладает многоплановым метаболическим действием и доказанной способностью влиять на течение диабетической нейропатии (ДН) [9]. Альфа-липоевая кислота (синонимы: тиоктовая, тиоктиковая, тиокаприловая, липоновая, липоиковая, 1,2-дитиолан-3-пентановая кислота, витамин N) является природным соединением. Биологической активностью обладает R(+)-стереоизомер ЛК, в лечебных целях чаще применяют синтетический рацемат. Традиционно ЛК рассматривают как витаминоподобное вещество и незаменимый фактор питания. Имеются единичные сообщения о возможности эндогенного синтеза ЛК в печени млекопитающих. Биологическая роль ЛК, прежде всего, определяется ее участием в окислительном декарбоксилировании альфа-кетокислот (альфа-кетоглутарата, пирувата и продуктов реакций трансаминирования валина, лейцина, изолейцина) и в полиферментной системе декарбоксилирования глицина в качестве кофермента [10].
АЛК-зависимые ферменты проявляют наибольшую активность в митохондриях клеток, где отмечается максимальная концентрация АЛК. Благодаря воздействию на основные этапы энергетического обмена ЛК выступает в качестве корректора энергодефицита и гиперлактацидемии при СД. Участие в синтезе коэнзима А обусловливает липотропное действие АЛК и способствует нормализации процессов окисления жирных кислот. В клетках АЛК способна подвергаться ферментативному восстановлению с образованием дигидролипоевой кислоты (ДЛК), которая, по-видимому, оказывает существенную часть внутриклеточных эффектов. Антиоксидантные свойства АЛК и ДЛК при сахарном диабете реализуются не только через непосредственное связывание АФК и хелатирование ионов металлов переменной валентности, но и через участие в тиол-дисульфидном обмене и нормализации функции митохондрий. Хорошая растворимость АЛК в водной и липидной фазе клеток делают ее универсальным антиоксидантом, при этом эффекты АЛК проявляются также в предотвращении процессов повреждения ДНК и белковых молекул активными формами кислорода [11, 12, 13].
К самостоятельному сигнальному действию АЛК можно отнести участие в регуляции процессов клеточной пролиферации и апоптоза, ингибирование секреции некоторых провоспалительных цитокинов, что имеет значение в коррекции дисфункции эндотелия и нормализации синтеза оксида азота у больных СД. В настоящее время получены данные, свидетельствующие о возможном влиянии АЛК на процессы гликозилирования белков как на стадии образования продуктов Амадори, так и при дальнейших превращениях конечных продуктов гликозилирования. По мнению ряда авторов, АЛК снижает активацию транскрипционного фактора NF-κB, наблюдающуюся при взаимодействии конечных продуктов гликозилирования с рецептором RAGE [14].
Клиническое применение и терапевтические эффекты Тиогаммы (тиоктовой кислоты)
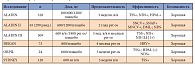
Метаболические и антиоксидантные свойства АЛК обусловливают ее нейропротективное действие. Клиническое применение тиоктовой кислоты для лечения нейропатии началось в 50-е гг. прошлого столетия. В целом ряде крупных многоцентровых исследований показано, что фармакологические эффекты АЛК дозозависимы: нейропротективное действие достигается при назначении лишь высоких доз препарата (300–600 мг/сут). Вместе с тем в эксперименте отмечена чрезвычайно низкая токсичность ЛК, поэтому дозы до 60 мг/кг в сутки следует считать безопасными. Высокодозированные препараты ЛК успешно применяются в терапии ДН, превосходя по клинической эффективности многие другие средства. Результаты наиболее крупных исследований (ALADIN I, II, III, NATHAN I, II, DEKAN, ORPIL, SYDNEY I, II), а также метаанализа, выполненного на основании данных четырех из этих работ, показали, что внутривенное введение и лечение таблетированными формами препаратов ЛК приводит к исчезновению жалоб (боли, жжения, онемения, парестезий и судорог мышц конечностей), восстановлению поверхностной и глубокой чувствительности, нормализации скорости проведения импульса по данным электронейромиографии, а также вариабельности сердечного ритма (при вегетативной форме нейропатии) (табл. 2) [15].
На фоне применения инфузионной формы АЛК у больных СД 1 и 2 типа в большинстве случаев отмечалось значительное субъективное улучшение, подтвержденное снижением баллов по шкале нейропатического симптоматического счета (NIS), нейропатического дисфункционального счета (NDS), «Гамбургского опросника болевых проявлений», а также увеличением скорости распространения возбуждения по нерву и амплитуды М-ответа при проведении стимуляционной электронейромиографии. В ряде случаев, при хорошей переносимости лечения, на 1–2-й неделе терапии нейропатические жалобы временно усиливались, что было связано, по-видимому, с восстановлением эндоневрального и увеличением кожного кровотока, контролируемого симпатическими нервами.
Результаты приведенных доказательных исследований позволили сделать следующие выводы. Внутривенное введение АЛК имеет дозозависимую эффективность в отношении невропатической симптоматики, причем доза 600 мг является оптимальной, так как использование дозы 1200 мг не приводит к увеличению эффективности лечения. Введение 14 инфузий в дозе 600 мг АЛК недостаточно для уменьшения неврологического дефицита. Вместе с тем, согласно результатам исследования ALADIN ІІІ, в котором у больных ДН применялось внутривенное введение 600 мг АЛК или плацебо в течение 3 недель, была показана возможность уменьшения неврологического дефицита, обусловленного диабетической полинейропатией у больных СД 2 типа при внутривенном назначении данного препарата.
Результаты исследования DEKAN свидетельствуют, что при продолжительном наблюдении пероральная терапия АЛК (800 мг ежедневно на протяжении 4 месяцев) оказывает положительное влияние на клиническую симптоматику диабетической вегетативной нейропатии. Исследование NATHAN II показало более высокую эффективность амбулаторного внутривенного 3-недельного введения АЛК больным СД 1 и 2 типа с диабетической полинейропатией в сравнении с группой больных СД с полинейропатией, получавших плацебо, при тестировании по шкалам TSS и NIS и подтвердило результаты предыдущих исследований, свидетельствующих о позитивных изменениях нейропатической симптоматики.
Подводя итог исследованиям, выполненным к настоящему времени, можно заключить, что применение АЛК у больных с ДН сопровождалось уменьшением позитивной неврологической симптоматики (ощущение боли, онемения, жжения и парестезий), негативной неврологической симптоматики (неврологического дефицита – снижение чувствительности всех модальностей, рефлексов на ногах и силы мышц) и улучшением показателей при электрофизиологическом исследовании. При этом было отмечено улучшение метаболического статуса больных, снижение уровня гликемии, а также снижение концентрации холестерина крови.
В настоящее время неалкогольная жировая болезнь печени (НАЖБ) рассматривается как компонент метаболического синдрома [16, 17] и сахарного диабета [18]: НАЖБ встречается у больных СД в 40–80% случаев. Это указывает на общность патогенетических механизмов нарушений в печени и СД, что обосновывает клиническое применение АЛК у данной категории пациентов. АЛК обладает положительным липотропным действием, облегчая перенос ацетата и жирных кислот из цитозоля в матрикс митохондрий для последующего окисления за счет увеличения выработки коэнзима А. Кроме того, АЛК снижает содержание холестерина и насыщенных жирных кислот в крови, предотвращая развитие атеросклероза, способствует положительным изменениям липидного спектра в сторону ненасыщенных жирных кислот. Важнейшим действием АЛК на липидный обмен следует считать мобилизацию жира из жирового депо организма с последующей его утилизацией в энергетическом обмене, а также улучшение усвоения глицина, синтеза глюкозы и белка в печени [19].
В исследовании, проведенном T. Konrad и соавт. (1999), изучалось влияние АЛК, которая применялась в дозе 600 мг 2 раза в день на протяжении 4 недель у больных СД 2 типа с избыточной и нормальной массой тела, на чувствительность тканей к инсулину, эффективность ассимиляции глюкозы и содержание пирувата и лактата в крови после орального глюкозотолерантного теста [20]. На фоне лечения больных СД 2 типа препаратом АЛК отмечалось достоверное снижение уровня лактата, пирувата, инсулинорезистентности и повышение уровня ассимиляции глюкозы тканями-мишенями. Эти данные позволили сделать вывод о том, что оксидативный стресс является одним из основных патогенетических факторов при метаболических заболеваниях печени.
Как известно, у пациентов с метаболическим синдромом развивается комплекс взаимосвязанных между собой обменных нарушений: инсулинорезистентность с относительной гиперинсулинемией, нарушение углеводного обмена, абдоминальное ожирение, артериальная гипертензия, гиперлипидемия, микропротеинурия, гиперкоагуляция, гиперурикемия, неалкогольная жировая болезнь печени. Эти состояния нередко сопровождаются развитием эндотелиальной дисфункции. С учетом патогенетических механизмов влияния АЛК на эндотелиальную функцию было проведено исследование ISLAND (Irbesartan and Lipoic Acid in Endotelial Dysfunction), показавшее, что монотерапия пероральными препаратами АЛК в течение 4 недель у больных с метаболическим синдромом приводила к увеличению эндотелий-зависимой вазодилатации брахиальной артерии. При этом наблюдалось уменьшение содержания в плазме крови интерлейкина-6 и активатора плазминогена-1. АЛК можно обоснованно отнести к средствам коррекции эндотелиальной дисфункции, которая реализуется через противовоспалительные и антитромботические механизмы [21].
В России широко используются препараты альфа-липоевой кислоты для лечения осложнений сахарного диабета. Для парентерального введения используются препараты, содержащие различные соли альфа-липоевой кислоты (этидентиаминовая, трометамоловая и меглюминовая). Меглюминовая соль альфа-липоевой кислоты (Тиогамма, «Вёрваг Фарма», Германия) при введении не вызывает ощущений жжения. Тиогамма выпускается во флаконах темного цвета (альфа-липоевая кислота должна быть защищена от света), содержит 600 мг меглюминовой соли альфа-липоевой кислоты в виде готового раствора, не требующего дополнительного разведения. Инфузия проводится непосредственно из флакона, что повышает безопасность проводимой терапии. Традиционная схема лечения больных с диабетической полинейропатией заключается в назначении в/в инъекций альфа-липоевой кислоты по 600 мг ежедневно в течение 2–4 недель. Очень важно, чтобы препарат вводился медленно. После курса в/в введения больного переводят на пероральный прием Тиогаммы в течении 2–3 месяцев по 600 мг. Препарат рекомендуется принимать за 30 минут до еды.
Заключение
