- выводиться почками в неизмененном виде, создавать высокую концентрацию в моче;
- обладать бактерицидным действием;
- обладать высокой активностью по отношению к кишечной палочке;
- быть безопасным, в том числе в случае применения у беременных, и удобным в использовании (прием 1–2 раза в день);
- иметь надежного производителя.
«Рациональная фармакотерапия в урологии – 2014». Инфекции в урологии. Современная парадигма лечения. VIII Всероссийская научно-практическая конференция
- Аннотация
- Статья
- Ссылки





Вопросы резистентности в странах Восточной и Западной Европы
Профессор Маттео БАССЕТТИ (Удине, Италия) напомнил, что с появлением пенициллина в начале прошлого века выживаемость пациентов с системной бактериальной инфекцией выросла с 10 до 90%. Позже были разработаны другие антибиотики, и казалось, что инфекционные заболевания больше не представляют серьезной угрозы. Однако начиная с 1970-х гг. мир столкнулся с новой проблемой – резистентностью микроорганизмов к антибактериальным препаратам. И сейчас, по мнению профессора М. Бассетти, мы «близки к концу эры эффективных антибиотиков». Прежде всего, главной причиной сложившейся ситуации стало чрезмерное и неправильное применение антибиотиков, и не только в здравоохранении, но и в животноводстве и сельском хозяйстве. Широкая доступность антибактериальных препаратов обернулась их бесконтрольным использованием. На розничную продажу антибиотиков приходится более 70%. В 2008 г. во всех проверенных аптеках Афин (Греция) можно было купить амоксициллин/клавулановую кислоту без рецепта. В 53% аптек продавали ципрофлоксацин без рецепта вопреки дополнительным ограничениям на назначение фторхинолонов1. Аналогичная ситуация, по словам профессора М. Бассетти, наблюдается во многих странах Евросоюза. Между тем пациенты, приобретая антибиотики, преимущественно используют их для лечения незначительных инфекций, имеющих высокую вероятность спонтанного излечения. В результате нерациональное применение антибиотиков способствует селекции резистентных штаммов микроорганизмов, таких как золотистый стафилококк, кишечная палочка, клебсиелла, синегнойная палочка, микобактерии туберкулеза и т.д. Кроме того, в последние годы фармацевтические фирмы вкладывают все меньше средств в разработку новых антибактериальных препаратов, поскольку гораздо прибыльнее разрабатывать, например, новые средства для лечения онкологических заболеваний. По этой причине за последние три года были зарегистрированы только два новых препарата (для сравнения – в 1980-е гг. каждые три месяца появлялся новый антибиотик).
Проблема резистентности микробов усугубляется все большим распространением бактерий, способных расщеплять бета-лактамные антибиотики, фторхинолоны и карбапенемы путем продукции бета-лактамаз расширенного спектра (БЛРС). Устойчивые к бета-лактамным антибиотикам штаммы кишечной палочки и клебсиеллы – наиболее частых возбудителей инфекций мочевых путей (ИМП) – выявляются во всем мире. Так, уровень БЛРС-продуцирующих микроорганизмов Escherichia coli в Латинской Америке достигает 21,6%, Азиатско-Тихоокеанском регионе – 34,9%, Европе – 8,1%. На долю штаммов Klebsiella pneumoniae, продуцирующих БЛРС, в Латинской Америке приходится 41,6%, в Африке и на Среднем Востоке – 37,6%, а в Европе – 16,3%2.
Что касается распространенности БЛРС в российских клиниках, то почти половина всех штаммов Escherichia coli и Klebsiella pneumoniae являются продуцентами БЛРС. В России прослеживается отчетливая тенденция к росту резистентности штаммов кишечной палочки к противомикробным средствам. На сегодняшний день Escherichia coli, устойчивая к бета-лактамным антибиотикам, выявляется в 13,9% случаев осложненных ИМП и в 2,3% случаев неосложненных ИМП.
Еще одной проблемой последних лет стало появление карбапенем-устойчивых бактерий. Рост резистентности к бета-лактамам заставляет все чаще применять карбапенемы, что, в свою очередь, способствует селекции карбапенем-резистентных штаммов микроорганизмов. Все больше грамотрицательных бактерий продуцируют карбапенемазы, которые вызывают инфекции, трудно поддающиеся терапии.
В 2008 г. в Индии у изолята Klebsiella pneumoniae впервые была обнаружена металло-бета-лактамаза, кодируемая плазмидным геном (New Delhi metallo-β-lactamase-1, NDM-1). В 2010 г. появились публикации, подтверждающие выделение штаммов с NDM-1 не только в Индии, но и Пакистане и Великобритании3. Супербактерии NDM-1 представляют серьезную эпидемическую угрозу, поскольку демонстрируют практически нулевую чувствительность ко всем имеющимся в практике антибиотикам, за исключением колистина.
Таким образом, нерациональная антибактериальная терапия способствует селекции резистентных штаммов микроорганизмов. Именно поэтому профессор М. Бассетти считает необходимым радикально пересмотреть отношение к назначению антибиотиков, ограничить их безрецептурную продажу, не допускать их использования при вирусных инфекциях, таких как грипп и ОРВИ, при неосложненном отите, бронхите и т.д. Бета-лактамы и особенно фторхинолоны – препараты, способствующие росту резистентности микроорганизмов, – следует рассматривать как средства резерва и не использовать их, например, для лечения острого неосложненного цистита. К сожалению, меры инфекционного контроля полезны в качестве сдерживающих резистентность, но практически не способны уменьшить показатели множественной лекарственной устойчивости внутрибольничных возбудителей.
В заключение М. Бассетти отметил, что Американское общество специалистов по инфекционным болезням (Infectious Diseases Society of America, IDSA) выступило с двумя инициативами. Первая заключается в разработке к 2020 г. десяти новых эффективных и безопасных антибиотиков, а вторая – в использовании альтернативных профилактических мер с целью сокращения частоты применения антибиотиков, особенно это касается рецидивов ИМП.
Современные подходы к лечению инфекций нижних мочевыводящих путей
Первостепенной задачей для врачей, занимающихся лечением рецидивирующих инфекций нижних мочевых путей (в первую очередь цистита), является правильная постановка диагноза. Так, по мнению профессора Любови Александровны СИНЯКОВОЙ (д.м.н., кафедра урологии и хирургической андрологии Российской медицинской академии последипломного образования), прежде всего следует исключить те заболевания, которые имеют аналогичную клиническую картину, включая инфекции, передаваемые половым путем, заболевания вирусной этиологии. Отчасти это касается и больных с гиперактивным мочевым пузырем (ГАМП).
После установления диагноза необходимо подобрать терапию, которая была бы патогенетически обоснованной и этиологически целесообразной. Необходимо учитывать, что основной структурой, защищающей эпителиальные клетки мочевого пузыря от патогенного воздействия мочи и предотвращающей адгезию микроорганизмов, является интактный гликозаминогликановый слой. Именно деструкция гликозаминогликанового слоя является одним из основных факторов рецидива ИМП. Таким образом, одной из главных задач лечения пациенток с хроническим циститом становится восстановление гликозаминогликанового слоя, в частности, с помощью введения в мочевой пузырь препаратов гиалуроновой кислоты или гепарина.
Другая задача заключается в устранении причин и факторов риска рецидивирующего цистита (таких как пролапс тазовых органов, эктопия наружного отверстия уретры, гипоэстрогенемия) и подбор адекватной антибактериальной терапии. Причем эмпирическое назначение антибиотиков возможно только на начальном этапе лечения острого заболевания, в дальнейшем следует опираться на результаты бактериологического исследования мочи, а также учитывать предшествующее применение антибактериальных препаратов и аллергологический анамнез.
Следует отметить, что частое и бесконтрольное применение антибиотиков (особенно фторхинолонов) способствует росту резистентности возбудителей, в первую очередь кишечной палочки, к этим препаратам. Профессор Л.А. Синякова предложила три метода, направленных на снижение резистентности: ограничение бесконтрольного применения (работа с пациентами) и безрецептурного отпуска антибактериальных средств (работа с провизорами), а также соблюдение стандартов лечения – применение антибиотиков по показаниям, с учетом данных локальной резистентности (работа с врачами).
В настоящее время основную роль в этиологии инфекций нижних мочевых путей продолжает играть кишечная палочка. Проникая в клетку, микроб начинает размножаться, в результате чего формируется бактериальное сообщество, так называемая биопленка (англ. biofilm). Когда количество возбудителей становится критическим, клетка разрывается и возбудитель, оказываясь во внеклеточном пространстве, заражает очередные клетки, в результате чего происходит рецидив инфекции. Причем микробы, выходящие в виде филаментов (нитей), не чувствительны к антибактериальным препаратам.
Европейская ассоциация урологов (European Association of Urology – EAU) рекомендует четыре подхода к антибактериальной терапии неосложненных ИМП4.
Во-первых, продолжительный профилактический прием низких доз антибактериальных препаратов (фторхинолонов, нитрофурантоина, ко-тримоксазола, цефалексина). Однако длительный прием антимикробных препаратов в субингибирующих дозах способствует селекции резистентных штаммов микроорганизмов, стимулирует образование биопленок. У пациенток также повышается риск дисбактериоза и дисбиоза влагалища. Однако самый главный недостаток указанного метода заключается в том, что примерно через 3–4 месяца после отмены препарата возникает рецидив инфекции.
Во-вторых, прием антибактериальных препаратов после полового акта у пациенток с посткоитальным циститом. При таком режиме профилактики снижаются доза препарата, число нежелательных реакций, уменьшается селекция резистентных штаммов. Эта рекомендация имеет высокую доказательную базу, поэтому с успехом применяется во всем мире (уровень доказательности 1а, степень рекомендации А).
В-третьих, самостоятельный прием пациентками с редкими эпизодами цистита того или иного антибиотика при невозможности своевременного обращения к врачу. При этом для подтверждения элиминации возбудителя желательно провести бактериологическое исследование через 1–2 недели после приема препарата. Однако эффективность данного метода дискутируется. Если пациентка не имеет возможности обратиться к врачу, а занимается самолечением, вероятность того, что она обратится затем в лабораторию для контрольного анализа мочи после окончания лечения, крайне мала. Таким образом, самолечение приведет только к исчезновению симптомов, а возбудитель останется и вновь вызовет обострение.
И последняя рекомендация – это периуретральное или интравагинальное применение эстрогенсодержащих препаратов у женщин в постменопаузе. Использование эстрогенов местного действия способствует снижению кислотности среды влагалища и росту численности лактобактерий, в результате чего количество рецидивов инфекций у пациенток старшей возрастной группы значительно снижается (с 23,7 до 6%). Уменьшается также частота симптомов нарушений чувствительности мочевого пузыря (учащенное мочеиспускание, императивные позывы на мочеиспускание, никтурия) с 47,4 до 9,4%. Улучшаются результаты операций по поводу опущения тазовых органов и операций с применением свободной синтетической петли (tension free vaginal tape – TVT)5, 6. Применение местных препаратов, содержащих эстрогены, оправдано также у молодых женщин, принимающих контрацептивы.
При обращении пациентки к врачу в момент обострения заболевания основная задача специалиста – сделать выбор в пользу антибактериальной терапии или же альтернативных методов лечения. При назначении антибиотиков курс лечения должен быть адекватным (до 7–10 суток в зависимости от препарата):
- фосфомицина трометамол 3 г одна доза каждые 10 дней в течение 3 месяцев;
- фуразидина калиевая соль в сочетании с магния карбонатом основным 100 мг 2 р/сут в течение 7 дней;
- норфлоксацин 400 мг 2 р/сут в течение 5 дней;
- левофлоксацин 500 мг 1 р/сут в течение 5 дней;
- ципрофлоксацин 500 мг 2 р/сут в течение 5 дней;
- цефиксим 400 мг 1 р/сут в течение 7 дней.
Следует отдавать предпочтение препаратам с бактерицидным действием, учитывая, безусловно, чувствительность к ним выделенного возбудителя. По данным российских исследователей, наиболее высокая чувствительность кишечной палочки в России отмечается к таким препаратам, как фосфомицина трометамол, калиевая соль фуразидина и цефалоспорины 3-го поколения7.
Фосфомицина трометамол подавляет адгезивные свойства грамположительных и грамотрицательных бактерий, причем действует не только на планктонные формы бактерий, но и проникает внутрь биопленки, разрушая ее. Высокая чувствительность к калиевой соли фуразидина микробов, вызывающих ИМП, доказана. Кроме того, калиевая соль фуразидина характеризуется высоким профилем безопасности и не нарушает нормальную микрофлору кишечника, а ее высокие концентрации в лимфе препятствуют лимфогенному пути распространения инфекции.
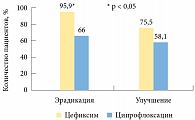
Что касается цефалоспоринов 3-го поколения (цефиксим), то следует отметить их высокую природную активность в отношении основных возбудителей ИМП и низкий уровень устойчивости уропатогенов во всем мире. В отечественном многоцентровом сравнительном исследовании была дана клиническая и микробиологическая оценка эффективности и безопасности цефиксима у пациенток с циститом8. Были выявлены достоверные преимущества цефиксима по параметрам бактериологической и клинической эффективности (рисунок) по сравнению с ципрофлоксацином. Так, эрадикацию возбудителя и стойкий бактериологический ответ отмечали в большей степени у пациенток, принимающих цефиксим. Цефалоспорины 3-го поколения также характеризуются удобством применения (1 раз в день), а следовательно, высокой приверженностью больных к лечению. Несомненным преимуществом является тот факт, что эти препараты могут использоваться у беременных начиная со второго триместра. Кроме того, цефалоспорины накапливаются в высокой концентрации не только в моче, но и в паренхиме почек, следовательно, их применение у больных с рецидивирующими инфекциями нижних мочевых путей является профилактикой развития пиелонефрита.
В лечении рецидива инфекций нижних мочевых путей могут также применяться фторхинолоны, однако следует помнить, что резистентность Escherichia coli к ним приближается к критическим цифрам – 8,4% для левофлоксацина и 9,5% для ципрофлоксацина. Для лечения рецидивирующих циститов не рекомендованы производные пипемидиновой, налидиксовой и оксалиновой кислот из-за их низкой микробиологической активности и индукции резистентности ко всей группе фторхинолонов.
Необходимо также рассматривать альтернативные антибиотикотерапии стратегии лечения рецидивирующих ИМП. Например, не так давно были получены сравнимые результаты применения ципрофлоксацина и нестероидного противовоспалительного препарата ибупрофена при обострении ИМП. Оказалось, что клиническая эффективность препаратов на 4-е и 7-е сутки была одинаковой9.
В заключение профессор Л.А. Синякова еще раз напомнила, что 90% возбудителей инфекций в организме человека находятся в виде биопленок. В этой связи эффективность лечения во многом зависит от возможности препарата воздействовать на микробы в составе биопленок. Кроме того, антибиотик для лечения рецидивирующих ИМП должен отвечать следующим требованиям:
Что касается причин рецидивирующего цистита, то одной из основных профессор Тамара Сергеевна ПЕРЕПАНОВА (д.м.н., заведующая отделом инфекционно-воспалительных заболеваний с группами клинической фармакологии и эфферентных методов лечения НИИ урологии) назвала несостоятельность врожденного иммунитета слизистых. Конечно, огромную роль играет сам возбудитель (чаще всего Escherichia coli), его вирулентность, патогенность и резистентность. Важное значение также имеет локализация очагов персистирования уропатогенного микроорганизма, будь то кишечник, влагалище или бактериальные сообщества в эпителии мочевого пузыря.
Классическая схема восходящего цистита такова: Escherichia coli выходит из кишечного резервуара, колонизирует влагалище и периуретру, восходит по мочеиспускательному каналу. Оказавшись в мочевом пузыре, кишечная палочка вызывает воспалительную реакцию. 98% штаммов, выделяемых из мочи больных циститом, обнаруживаются и в кале, что указывает на высокую распространенность данного пути развития заболевания.
Факторы, предрасполагающие к развитию рецидивирующего цистита, можно подразделить на физиологические (особенности строения урогенитальной сферы, повышенная плотность рецепторов для адгезии бактерий на слизистой, дефицит эстрогенов, половой акт) и патологические (инфравезикальная обструкция, наличие остаточной мочи, пузырно-мочеточниковый рефлюкс, нарушение иннервации мочевого пузыря, наличие инородных тел в мочевом пузыре, применение контрацептивных средств, недержание мочи и другие сопутствующие заболевания). Кроме того, следует отметить такие особенности макроогранизма, как снижение скорости потока мочи и повышение ее рН, недостаточность IgA и антимикробных пептидов, недостаточность гликозоаминогликанового слоя, фагоцитоза и апоптоза клеток слизистой мочевого пузыря.
Развитие любого воспалительного процесса – это взаимодействие между хозяином и патогенным микроорганизмом, на которое оказывают влияние их генетически детерминированные свойства. В НИИ урологии в 2013 г. проводилось исследование, в которое были включены 38 женщин – 28 пациенток с рецидивирующим циститом и 10 здоровых добровольцев. У пациенток с рецидивирующими ИМП была продемонстрирована генетически обусловленная несостоятельность иммунного ответа: повышенная экспрессия толл-подобных рецепторов TLR 2 (в 1,85 раза) и TLR 4 (в 22 раза), а также снижение концентрации генов HBD-1 (в 9,78 раз).
Колонизируя слизистую оболочку мочевого пузыря, Escherichia coli использует различные факторы адгезии, включая фимбрии, сидерофоры, адгезин. Инвазия микробов в эпителиальные клетки способствует высвобождению микробных факторов вирулентности. Вследствие этого происходит активация клеток уротелия, высвобождение медиаторов воспаления, иммунитета, дифференцировки клеток, миграция нейтрофилов в очаг воспаления. Мутанты уропатогенной Escherichia coli угнетают индукцию защитных механизмов организма-хозяина, модулируя воспалительный ответ уротелия.
Гены вирулентности Escherichia coli были изучены в НИИ урологии. Была прослежена взаимосвязь между активностью воспалительного процесса в паренхиме почки и вирулентностью Escherichia coli, определяемой специфическим набором генов в «островах патогенности». Оказалось, что при бессимптомной бактериурии у Escherichia coli отмечаются единичные гены патогенности, а внутрибольничные штаммы Escherichia coli обладают факторами патогенности и резистентности почти в 87% случаев, по сравнению с 45% для внебольничных штаммов.
Наконец, огромное значение имеет рост резистентности микроорганизмов к антибактериальным препаратам, что обусловлено нерациональным выбором препарата, несоблюдением рекомендуемых схем введения антибиотиков (дозы, длительность), избыточным применением антимикробных препаратов без показаний, использованием субингибирующих доз антибиотиков.
Трудности лечения рецидивирующей ИМП вызваны в том числе формированием микробных резервуаров в слизистой мочевых путей – внутриклеточных бактериальных сообществ. Растущие колонии бактерий, окруженные матриксом, формируют в стенке мочевого пузыря скопления в виде «коконов», выпячивающих в его просвет. Время от времени «коконы» разрываются, и бактерии, попадая в мочу, вызывают повторные ИМП.
Учитывая все вышесказанное, целью лечения острого неосложненного цистита является эрадикация возбудителя, а рецидивирующего цистита – улучшение качества жизни, в частности увеличение безрецидивного периода. Этому способствуют поведенческая терапия (уменьшение сексуальной активности, ограничение применения спермицидов, мочеиспускание и подмывание после коитуса, обильное питье), а также антимикробная и неантимикробная профилактика.
Если речь идет об антимикробной терапии, то препараты должны применяться полноценными курсами, как это было продемонстрировано в докладе Л.А. Синяковой. При этом эмпирически должны назначаться только те препараты, которые используют для лечения мочевой инфекции, а антибиотики, которые широко применяются по другим показаниям, должны быть ограничены или исключены. Что касается иммунопрофилактики рецидивирующего цистита, то в настоящее время разработаны различные вакцины, содержащие антигены бактерий, липополисахариды, липопротеины, пептидогликаны, за счет которых происходит стимуляция активности макрофагов, Т- и В-лимфоцитов, NK-клеток, усиление фагоцитоза, повышение синтеза интерферона, специфических антител и цитокинов и, как следствие, ускорение элиминации возбудителя и его токсинов.
В настоящее время наибольшее распространение в России среди вакцин против возбудителей ИМП получил Уро-Ваксом®, представляющий собой лиофилизированные бактериальные лизаты из 18 штаммов Escherichia coli. Препарат доказал свою эффективность в многочисленных рандомизированных исследованиях. Уро-Ваксом® стимулирует клеточный и гуморальный иммунитет, направленный против наиболее распространенного возбудителя ИМП – кишечной палочки, усиливая моноцитарно-макрофагальный ответ, выработку интерлейкинов, интерферонов, секреторного IgA, повышая активность Т- и В-лимфоцитов.
Эффективность применения Уро-Ваксома была показана на животных моделях (цистит индуцировали введением в мочевой пузырь липополисахарида возбудителя). Так, у мышей, получавших Уро-Ваксом®, выраженность отека, лейкоцитарной инфильтрации и геморрагических проявлений была ниже, чем у мышей, получавших физиологический раствор10. Эффективность применения Уро-Ваксома оценивалась и у беременных женщин в открытом многоцентровом исследовании: 62 пациентки (беременность от 16 до 28 недель) с бактериурией > 10⁵ КОЕ/мл получали Уро-Ваксом® до родов. Антибиотики назначались в начале исследования для купирования острого эпизода ИМП. Было показано, что Уро-Ваксом® снижает частоту рецидивов ИМП и потребление антибиотиков во время беременности11. Препарат хорошо переносился и продемонстрировал свою безопасность как для матери, так и для плода (все дети родились здоровыми с нормальным баллом по шкале Апгар).
Согласно результатам метаанализа K.G. Naber и соавт., на фоне приема препарата частота рецидивов ИМП снижается в среднем на 40%. Кроме того, уменьшаются симптомы ИМП и улучшаются лабораторные показатели: частота дизурии через 6 месяцев снижается на 52%, лейкоцитурии – на 45%, бактериурии – на 33% по сравнению с плацебо. Помимо эффективности применения препарата Уро-Ваксом® в лечении рецидивирующих ИМП, был подтвержден благоприятный профиль безопасности препарата: все побочные эффекты на фоне иммуностимулирующей терапии были сравнимы с плацебо12.
Таким образом, иммуноактивная профилактика и эффективность Уро-Ваксома доказаны в нескольких рандомизированных контролируемых исследованиях, что позволило EAU рекомендовать его для профилактического приема женщинам с неосложненными рецидивирующими ИМП13 с наивысшим уровнем рекомендаций.
Дифференциальная диагностика и рациональная антибиотикотерапия при резистентном гиперактивном мочевом пузыре и хроническом цистите у женщин
Профессор Инна Анатольевна АПОЛИХИНА (д.м.н., кафедра акушерства, гинекологии, перинатологии и репродуктологии Первого Московского государственного университета им. И.М. Сеченова, Научный центр акушерства, гинекологии и перинатологии им. акад. В.И. Кулакова) отметила, что, по различным аналитическим данным, частота встречаемости ГАМП составляет в среднем 17%. Кроме того, считается, что хроническое воспаление мочевого пузыря при подтвержденной клинически значимой бактериурии (например, с помощью хромогенного агара) способствует развитию рефрактерного ГАМП, в частности, в 90% случаев при данном заболевании диагностируется хронический цистит. Помимо этого, хронические воспалительные процессы в половых органах также существенно повышают риск развития ГАМП из-за наличия висцеро-висцерального рефлекса. Однако следует помнить, что под маской цистита могут скрываться и другие заболевания, включая опущение тазовых органов, камень нижней трети мочеточника, опухоль и инородное тело мочевого пузыря, интерстициальное воспаление.
Говоря о симптомокомплексе рефрактерного ГАМП, в первую очередь следует констатировать резкое снижение качества жизни женщины. К основным факторам риска при этом относятся возраст более 44 лет, генетическая предрасположенность, менопауза и прием некоторых лекарственных средств. Что касается менопаузы, то фактор дефицита эстрогенов является дискутабельным, так как системная заместительная гормональная терапия не дает желаемого результата, в отличие от местного применения эстрогенсодержащих препаратов. Перспективным методом профилактики развития ГАМП является воздействие на слизистую оболочку гениталий и уретры фракционным лазерным излучением. Это способствует синтезу коллагеновых и эластиновых волокон, уменьшая выраженность проявлений ГАМП.
В настоящее время активно обсуждается значимость биомаркеров в ранней диагностике ГАМП. Например, показано, что выработка фактора роста нервов, который продуцируется клетками уротелия, повышается при ГАМП и снижается при назначении антимускариновой терапии. Однако в работах российских авторов не было выявлено статистически значимой разницы в выработке данного биомаркера между группами с хроническим циститом и ГАМП. Кроме того, было показано, что рефрактерный ГАМП и хронический цистит имеют сходный генез, уровень интерлейкина 8 в моче при обоих заболеваниях увеличивается более чем в 2 раза и снижается после лечения, а также чем длительнее течение ГАМП, тем выше уровень фактора роста нервов. Что касается иммуногистохимического исследования биоптатов у больных с хроническим циститом и ГАМП, то они во многом продемонстрировали схожие изменения, указывающие на воспалительный характер поражения уротелия при обоих состояниях.
Интересные результаты были получены при лечении женщин с хроническим циститом и ГАМП. 28 женщин из группы с хроническим циститом получали только антибиотикотерапию, а у 19 женщин дополнительно использовали препарат гиалуроновой кислоты в виде инстилляций. Среди пациенток с рефрактерным ГАМП 15 женщин получали только антибиотики, а 17 – антибиотики в сочетании с препаратом гиалуроновой кислоты местно. Было показано, что инстилляции с препаратом гиалуроновой кислоты повышают эффективность антибактериальной терапии на 31%.
В заключение профессор И.А. Аполихина отметила, что в настоящее время основным методом лечения ГАМП остается применение М-холиноблокаторов. Однако идут разработки новых препаратов, которые проходят клинические испытания и в ближайшие годы появятся на российском рынке. Кроме того, не стоит умалять значимость антибиотикотерапии в лечении ГАМП, учитывая тот факт, что рефрактерный ГАМП и хронический цистит имеют схожий инфекционно-воспалительный генез.
Заключение
Актуальность вопросов лечения ИМП обусловлена не только широким распространением заболевания и высокой вероятностью рецидива, но и необходимостью оптимизации лечения.
Нерациональная антибактериальная терапия может приводить к селекции резистентных штаммов микроорганизмов. Докладчики призвали пересмотреть отношение к назначению антибиотиков, применять их только по показаниям, не допускать их использования при неосложненных вирусных инфекциях.
При назначении антимикробной терапии пациенту с ИМП необходимо следовать важным правилам: выбирать препарат с учетом локальной резистентности возбудителей, основываясь на данных доказательной медицины. При этом дозировка, схема и продолжительность приема должны соответствовать российским и международным рекомендациям.
По возможности следует прибегать к альтернативным стратегиям лечения, в особенности это касается рецидивирующих ИМП. Так, например, EAU рекомендует проводить иммунопрофилактику у женщин с неосложненными рецидивирующими ИМП путем назначения Уро-Ваксома, который активизирует собственные защитные силы организма и доказанно позволяет предотвратить развитие рецидивов цистита.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.