количество статей
7261
Загрузка...
Пожалуйста, авторизуйтесь:
Исследования
Влияние препарата Виардо на андрогенный статус и копулятивную функцию мужчины*
"ЭФФЕКТИВНАЯ ФАРМАКОТЕРАПИЯ. Эндокринология" №1 (9)
- Аннотация
- Статья
- Ссылки
Оценивалось влияние препарата Виардо, в состав которого входит богатое токоферолами 100%-ное масло зародышей пшеницы, на состояние копулятивной функции мужчин (эректильную функцию и сперматогенез) и их андрогенный статус. В исследование были включены 30 мужчин с проявлениями слабого или умеренного андрогенного дефицита стрессорной природы. Было показано, что 4-недельный курс терапии препаратом Виардо приводит к уменьшению андрогенного дефицита, способствует восстановлению полового влечения и улучшению половой функции. Одновременно наблюдалось улучшение показателей сперматогенеза (увеличение подвижности сперматозоидов и уменьшение времени разжижения эякулята). Обсуждаются механизмы действия препарата Виардо.

Рис. 1. Дизайн исследования
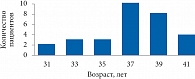
Рис. 2. Распределение пациентов по возрасту
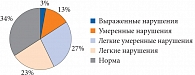
Рис. 3. Структура пациентов по степени эректильной дисфункции
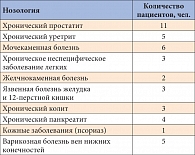
Таблица 1. Сопутствующие заболевания

Рис. 4. Динамика показателей по шкале AMS

Таблица 2. Гормональные показатели до и на фоне лечения
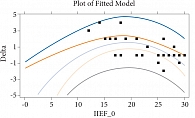
Рис. 5. Зависимость изменения показателя IIEF от его начального значения
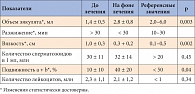
Таблица 3. Показатели эякулята до и на фоне лечения
Введение
Процесс старения мужского организма, помимо общего снижения адаптационных возможностей, приводящего к развитию широкого спектра заболеваний (прежде всего сердечно-сосудистых), характеризуется также комплексом специфических для половой сферы процессов, который в последнее время все чаще характеризуют как «мужской климакс». В целом климакс – переходный период в жизни мужчины, между средним и пожилым возрастом, сопровождающийся структурно-функциональной перестройкой органов и систем организма. Это закономерный этап биологического процесса старения, однако его протекание весьма индивидуально.
В узком понимании мужской климакс, согласно определению ISSAM (International Society for the Study of the Aging Male – Международное общество по изучению пожилых мужчин), это «биохимический синдром, возникающий в зрелом возрасте и характеризующийся недостаточностью андрогенов в сыворотке крови, сопровождающийся или не сопровождающийся снижением чувствительности организма к андрогенам, что может привести к значительному ухудшению качества жизни и неблагоприятно сказаться на функциях многих систем организма». Практика показывает, что лабораторные признаки андрогенной недостаточности выявляются у 20% мужчин старше 60 лет. Однако симптомы, характерные для возрастного гипогонадизма, могут проявляться и в молодом возрасте под действием различных факторов, приводящих к хроническому стрессу и, посредством ряда биохимических нарушений, к андрогенной недостаточности. Синдром хронической усталости, или синдром менеджера, становится в настоящее время все более распространенным явлением.
Следует отметить, что оценка андрогенной насыщенности мужского организма представляет собой неоднозначную задачу. Причиной этого являются, с одной стороны, значительные колебания уровня андрогенов в мужском организме в течение суток (до 30%), что затрудняет определение истинного содержания тестостерона в плазме крови, с другой – отсутствие прямой связи между уровнем тестостерона в плазме крови и клиническими симптомами. В последнем случае объяснение кроется в изменении чувствительности рецепторов органов-мишеней к тестостерону у пожилых мужчин. Часто мы можем наблюдать клинические проявления андрогенной недостаточности при нормальном уровне тестостерона.
Характерным является также умеренное уменьшение концентрации тестостерона в плазме крови при нормальных показателях гонадотропных гормонов. Результаты последних научных исследований свидетельствуют о важной роли тестостерона в поддержании нормальной эластичности коллагеновых волокон кавернозной ткани, а также синтеза оксида азота (NO), являющегося основным медиатором эрекции. Доказано, что даже относительно кратковременные периоды снижения тестостерона ниже порогового уровня (плазменный тестостерон – 10–13 нмоль/л, свободный тестостерон – 200–250 нмоль/л) способны необратимым образом сказаться на состоянии кавернозной ткани, приводя к ее склерозу.
Усилия современной медицины в области коррекции указанных нарушений сосредоточены в настоящее время на разработке принципов андрогензаместительной терапии (АЗТ) и создании новых препаратов тестостерона. Сегодня общедоступные лекарственные формы для АЗТ представлены трансбуккальными или пероральными препаратами, формами для внутримышечного применения (пролонгированного и короткого действия), имплантируемыми препаратами с медленным высвобождением длительного действия, накожными пластырями и гелями.
Однако, несмотря на разнообразие лекарственных форм, остается ряд нерешенных проблем. Во-первых, ни один из предложенных препаратов не способен в точности воспроизвести циркадный ритм уровня тестостерона в сыворотке крови. Во-вторых, как и большинство медицинских препаратов, андрогены потенциально способны оказывать нежелательные побочные эффекты. Это касается, прежде всего, воздействия на печень, предстательную железу, липидный профиль, сердечно-сосудистую систему, картину крови, систему сна, социальное поведение и эмоциональный статус. Отдельного внимания заслуживает ранняя диагностика рака предстательной железы в условиях АЗТ.
Перечисленные проблемы определили интерес к изучению лекарственных препаратов, способствующих поддержанию синтеза и биологических эффектов эндогенного тестостерона на нормальном уровне, что предупреждает развитие вторичного гипогонадизма. Среди прочих в зону особого внимания попали препараты-антиоксиданты, в частности витамины А, Е, некоторые микроэлементы (селен). Важное достоинство этих веществ состоит в том, что они имеют природное происхождение и входят в состав многих продуктов питания, что позволяет контролировать их поступление в организм на уровне пищевой диеты. Благодаря указанным свойствам возможна длительная профилактика метаболических расстройств. На сегодняшний день существуют специально созданные биологические препараты, являющиеся уникальными источниками природного витамина Е. Среди них можно выделить препарат Виардо, в состав которого входит 100%-ное масло зародышей пшеницы, полученное методом холодного прессования. Уникальность свойств 100%-ного масла зародышей пшеницы обусловлена присутствием в его составе трех активных комплексов: антиоксидантов-токоферолов и каротиноидов, незаменимых полиненасыщенных жирных кислот, витаминов группы В, D, F и фолиевой кислоты.
По содержанию токоферолов масло зародышей пшеницы – рекордсмен среди всех природных соединений (до 600 мг %), причем преобладает наиболее активная их форма – альфа-токоферол. Следует отметить, что, несмотря на доказанный антиоксидантный эффект витамина Е, позволяющий использовать его для профилактики сердечно-сосудистых и других заболеваний, влияние этого витамина на синтез половых гормонов остается плохо изученным. Согласно одним исследованиям, применение токоферола в больших дозах не приводит к непосредственному увеличению уровня сывороточного тестостерона. В то же время имеются данные о необходимости витамина Е как защитного фактора, препятствующего отрицательному эффекту токсических веществ на синтез стероидов. Более того, существуют данные, свидетельствующие о том, что ряд биологических эффектов тестостерона на мужской организм связан с его антиоксидантным действием, которое, однако, не проявляется в условиях дефицита витамина Е. Вместе с тем результаты исследования по влиянию токоферола и каротиноидов на заболеваемость раком предстательной железы (АТВС) указывают на возможность уменьшения уровня тестостерона под влиянием указанных соединений.
Несмотря на неполноту наших знаний о роли биологически активных веществ в предупреждении возрастных изменений, происходящих в организме человека, безопасность и физиологичность их действия позволяют в течение продолжительного периода времени осуществлять профилактику заболеваний. Это определяет интерес к проведению исследований в указанном направлении. Мы поставили цель – оценить влияние препарата Виардо на состояние копулятивной функции мужчины (эректильную функцию и сперматогенез), его андрогенный статус и определить возможные механизмы, лежащие в основе этих эффектов. Исследование было проведено кафедрой урологии МГМСУ на базе ГКБ № 50, а также отделением андрологии и урологии Эндокринологического научного центра.
Материалы и методы
Для исследования были выбраны гетеросексуальные мужчины в возрасте от 30 до 65 лет с клинической картиной андрогенного дефицита, подтвержденного опросником ASM (андрогенный статус мужчины) и измерением уровня общего тестостерона (ниже 12 нмоль/л). Все пациенты имели постоянную половую партнершу. Мы не включали в исследование мужчин, имеющих какие-либо заболевания, способные непосредственно отражаться на гормональном статусе или половой функции, или принимающих лекарства с подобным эффектом. Наличие хронических инфекций, аллергических реакций на исследуемый препарат также являлось противопоказанием для участия в исследовании.
Исследование проводилось как открытое, без плацебо-контроля и включало 30 мужчин с возрастным гипогонадизмом. Дизайн исследования (рис. 1) строился следующим образом. В течение 1-й недели проводилось предварительное обследование (проверка критериев включения и исключения, получение согласия на участие в исследовании, сбор анамнеза, оценка общего состояния органов и систем, общие клинические лабораторные тесты). Фаза лечения составила 4 недели, с визитами через 2 недели (± 2 дня) с оценкой показателей IIEF-5 (EF), DAN-PSS-Sex, гормональными тестами, выявлением переносимости препарата, побочных эффектов, изменений в общем состоянии пациента. Окончательная оценка гормонального статуса проводилась на 30 ± 3 день. На заключительном визите – 80–90-й день – оценивались показатели сперматогенеза.
Для оценки эффективности лечения мы использовали International Index of Erectile Function (вариант для EF) IIEF-5, опросник симптомов старения мужчины AMS, шкалу DAN-PSS-Sex. Анализировалась динамика показателей шкалы AMS, IIEF (EF), показателей спермограммы, результатов гормональных тестов. Статистический анализ полученных данных проводился разными методами с использованием программного пакета Statgraphics 5.0 Plus.
Результаты исследования
В соответствии с критериями включения для исследования были отобраны 30 мужчин с проявлениями андрогенного дефицита. Средний возраст больных составил 37,5 лет (рис. 2). Эти пациенты наблюдались в стационаре и амбулаторно. При этом основным поводом для обращения к урологу не всегда являлись половые нарушения. В ряде случаев эректильная дисфункция была выявлена в процессе обследования в связи с другим заболеванием.
В соответствии с дизайном исследования у всех больных было получено информированное согласие на участие в исследовании, проведен сбор анамнеза, оценка общего состояния органов и систем, выполнены общие клинические лабораторные тесты. Произведена оценка базового состояния копулятивной функции, которая осуществлялась с использованием шкалы международного индекса эректильной функции и шкалы DAN-PSS-Sex, выполнены гормональные тесты, проведено исследование эякулята. Зарегистрированные при промежуточных визитах значения этих показателей сравнивались с исходными. Согласно протоколу исследования, в него включались мужчины, у которых было обнаружено снижение уровня общего тестостерона в утренние часы ниже 12 нг/мл. Анализ данных, полученных с использованием шкалы AMS, показал, что 12 человек имели симптомы андрогенной недостаточности слабой степени выраженности, остальные 18 – умеренной. Поскольку сопутствующие органические заболевания являлись критериями исключения, мы считаем, что андрогенный дефицит (учитывая достаточно молодой возраст пациентов) у всех больных носил стрессорный характер (синдром хронической усталости, синдром менеджера и т.д.). У всех пациентов в анамнезе имели место значительные физические и психические перегрузки.
Основными симптомами, на которые жаловались больные, были ухудшение самочувствия и общего состояния, повышенная потливость, бессонница, раздражительность, мышечная слабость. Некоторые пациенты отмечали снижение сексуальной активности, качества эрекции, укорочение длительности полового акта, притупление чувства оргазма. При анализе ответов пациентов на вопросы шкалы IIEF было установлено, что у 1 (3,3%) мужчины имелось выраженное расстройство эректильной функции, у 4 (13,3%) – умеренно выраженное, у 8 (26,6%) – от легкого до умеренного, у 7 (23,3%) – легкое, а у 10 (33,3%) показатели находились в пределах нормальных значений (рис. 3).
Согласно критериям включения в исследование, пациенты, имевшие явные органические причины эректильной дисфункции, в исследование не вошли. Однако для полного исключения других возможных факторов, помимо андрогенной недостаточности, применялись специальные методы исследования, в частности триплексная ультразвуковая допплерография сосудов полового члена с фармакотестом, изучение ночной пенильной тумесценции (Rigiscan), кавернозография. По показаниям проводилось изучение общего неврологического статуса пациента.
Проведенные исследования ни в одном случае не обнаружили клинически значимых органических изменений со стороны полового члена, что позволило нам считать причиной эректильной дисфункции (когда она имела место), как и андрогенного дефицита, хронический стресс. Мы также обращали внимание на наличие сопутствующих заболеваний, которые должны были учитываться при обследовании пациента и проведении лечения. Результаты представлены в таблице 1.
Перед началом приема препарата у всех больных проводился анализ эякулята. Результаты показали, что у 15 пациентов (50%) отмечались нарушения сперматогенеза различной степени выраженности, характеризующиеся снижением подвижности сперматозоидов, уменьшением объема эякулята, повышением его вязкости и увеличением времени разжижения (мы называем данное состояние синдромом вязкой спермы), причем 10 мужчин наблюдались и лечились по поводу идиопатического бесплодия.
После проведения первичного обследования и проверки пациентов на соответствие критериям включения в исследование больным выдавался препарат Виардо и начинался курс лечения. Мы не препятствовали приему больными других препаратов, если это требовалось для лечения сопутствующих заболеваний (за исключением лекарств, указанных в критериях исключения из исследования).
Согласно протоколу в течение 4 недель каждый пациент принимал препарат Виардо перорально в дозе 1,8 г/сут (по 2 капсулы 3 раза в день). Во время каждого визита пациента производилась промежуточная оценка эректильной функции, общего самочувствия с использованием вышеописанных инструментов и выявлялись возможные побочные эффекты препарата. Через 3 месяца повторно проводился анализ эякулята.
Анализ результатов по шкале AMS после окончания курса приема препарата (через 4 недели) в сравнении с базовыми значениями показал достоверное уменьшение симптомов андрогенной недостаточности (р = 0,0004) (рис. 4). Среднее уменьшение суммы баллов по шкале AMS составило 5,9 (15,6%). В таблице 2 представлены результаты гормональных тестов, выполненных перед началом исследования и сразу по окончании курса приема препарата. Результаты исследования показывают, что у всех мужчин на фоне приема Виардо отмечалось достоверное повышение содержания тестостерона на фоне снижения уровня пролактина и снижения уровня лептина.
В процессе приема препарата Виардо и в конце курса лечения мы не отметили достоверного изменения средней суммы баллов по шкале IIEF (р > 0,05), однако методом полиномиальной регрессии удалось выявить закономерность в изменении среднего показателя IIEF, представленную на рисунке 5 (р = 0,0037). Как следует из представленной диаграммы, влияние терапии на эректильную функцию мужчин зависело от ее начального состояния: чем более выраженные нарушения функции имел пациент перед началом лечения, тем чаще наблюдался положительный результат. Так, в группе с умеренными нарушениями эрекции улучшение показателей индекса IIEF (в среднем на 19,3%) наблюдалось у всех 4 пациентов (100%). В группе мужчин, имевших эректильную дисфункцию в пределах от легких до умеренных симптомов, увеличение среднего балла по шкале IIEF (на 13,3%) наблюдалось только у 4 человек (50%). Среди больных с легкими расстройствами эрекции улучшение показателя было отмечено у 2 человек (28,6%) – в среднем на 4,3%. Наконец, среди мужчин, формально не имевших эректильных нарушений, 2 пациента (20%) также демонстрировали увеличение среднего балла IIEF на 5,6%. Указанные изменения гормонального статуса, а также параметров, полученных при заполнении анкет, соответствовали субъективным ощущениям пациентов, которые включали:
- исчезновение или значительное уменьшение адинамии;
- нормализацию полового влечения;
- улучшение эрекции;
- повышение работоспособности и физической активности;
- улучшение общего самочувствия;
- улучшение настроения;
- уменьшение количества жировой ткани, что проявлялось уменьшением окружности талии в среднем на 6,1 см за 1 месяц.
Изменения, обнаруженные при исследовании эякулята, представлены в таблице 3. Полученные результаты демонстрируют достоверное увеличение под влиянием лечения подвижности сперматозоидов при отсутствии эффекта на содержание лейкоцитов в эякуляте. Также отмечалось увеличение объема эякулята и уменьшение времени его разжижения. Все перечисленные показатели являются андрогенозависимыми, что предполагает андрогенопосредованное влияние препарата Виардо на сперматогенез. В процессе приема Виардо мы не отметили ни одного случая побочного действия препарата.
Обсуждение и выводы
Повышение содержания тестостерона на фоне снижения уровней пролактина и лептина позволяет предположить наличие у препарата Виардо как центрального – гипоталамо-гипофизарного, скорее всего антистрессорного действия (уменьшение секреции пролактина ведет к усилению стимулирующего действия лютеинизирующего гормона на клетки Лейдига, секретирующие тестостерон), так и периферического эффекта, опосредованного уменьшением количества жировой ткани (снижение уровня продуцируемого в ней лептина). Последнее ведет к уменьшению ароматизации тестостерона в андрогены. Снижение концентрации глобулинов, связывающих половые стероиды, оказывает дополнительное позитивное действие, приводя к повышению уровня свободного тестостерона.
Этот механизм позволяет объяснить, каким образом у мужчин с приобретенным андрогенным дефицитом стрессорного характера препарат Виардо восстанавливает половое влечение и улучшает половую функцию. Улучшение показателей сперматогенеза у мужчин с идиопатическим бесплодием (увеличение подвижности сперматозоидов и уменьшение времени разжижения эякулята) также, по всей видимости, обусловлено повышением содержания тестостерона – основного гормона, влияющего на созревание сперматозоидов и разжижение эякулята.
Таким образом, результаты проведенного нами исследования позволяют сделать вывод, что препарат Виардо – эффективное и безопасное средство лечения мужчин с приобретенным андрогенным дефицитом стрессорного характера. Он может быть рекомендован как для монотерапии, так и в составе комбинированной терапии для лечения идиопатического бесплодия, а также нарушений половой функции психогенного характера.
1. Butler R.N., Fossel M., Pan C.X. et al. Anti-aging medicine. 2. Efficacy and safety of hormones and antioxidants // Geriatrics. 2000. Vol. 55. № 7. P. 48–52, 55–56, 58.
2. Richards J.B., Hallford D.M., Duff G.C. Serum luteinizing hormone, testosterone, and thyroxine and growth responses of ram lambs fed locoweed (Oxytropis sericea) and treated with vitamin E/selenium // Theriogenology. 1999. Vol. 52. № 6. P. 1055–1066.
3. Verma R.J., Nair A. Effect of aflatoxins on testicular steroidogenesis and amelioration by vitamin E // Food Chem. Toxicol. 2002. Vol. 40. № 5. P. 669–672.
4. Hartman T.J., Dorgan J.F., Woodson K. et al. Effects of long-term alpha-tocopherol supplementation on serum hormones in older men // Prostate. 2001. Vol. 46. № 1. P. 33–38.
5. Travert C., Fofana M., Carreau S. et al. Rat Leydig cells use apolipoprotein E depleted high density lipoprotein to regulate testosterone production // Mol. Cell. Biochem. 2000. Vol. 213. № 1–2. P. 51–59.
6. Salonen J.T., Nyyssönen K., Salonen R. et al. Antioxidant Supplementation in Atherosclerosis Prevention (ASAP) study: a randomized trial of the effect of vitamins E and C on 3-year progression of carotid atherosclerosis // J. Intern. Med. 2000. Vol. 248. № 5. P. 377–386.
7. Bhardwaj A., Verma A., Majumdar S. et al. Status of vitamin E and reduced glutathione in semen of oligozoospermic and azoospermic patients // Asian J. Androl. 2000. Vol. 2. № 3. P. 225–228.
8. Bunout D. Therapeutic potential of vitamin E in heart disease // Expert. Opin. Investig. Drugs. 2000. Vol. 9. № 11. P. 2629–2635.
Новости на тему
01.09.2022 01:00:00
Отправить статью по электронной почте
Ваш адрес электронной почты:
Адрес электронной почты получателя:
Разделите несколько адресов электронной почты запятой
Сообщение(не обязательно)
Не более 1500 символов
Анти спам:
Для предотвращения спама, пожалуйста, введите в поле слово, которое видите ниже.
Обновить код
* адреса предоставленные Вами будут использоваться только для отправки электронной почты.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.