Влияние андрогенного дефицита на состояние углеводного обмена у мужчин
- Аннотация
- Статья
- Ссылки
- English
В статье представлены данные о влиянии дефицита андрогенов на риск возникновения ожирения, инсулинорезистентности и сахарного диабета 2 типа.
В статье представлены данные о влиянии дефицита андрогенов на риск возникновения ожирения, инсулинорезистентности и сахарного диабета 2 типа.


Эпидемиология
Согласно результатам первого крупномасштабного исследования ММАS (2000 г.), уровень общего тестостерона в крови у мужчин начинает снижаться в 30–35 лет на 0,8%, уровень свободного тестостерона и альбумин-связанного тестостерона – на 2,0% в год [1]. Одновременно с уменьшением концентрации тестостерона увеличивается уровень глобулина, связывающего половые стероиды (ГСПС), на 1,6% в год, что также приводит к снижению уровня свободного тестостерона. Эти данные позволили рассматривать ГСПС как маркер возрастного андрогенного дефицита у мужчин. В ходе исследования ММАS также установлено, что андрогенный дефицит встречается у 30% мужчин в возрасте 60 лет и 80% – в возрасте 80 лет. Согласно результатам другого исследования, частота выявления сниженного уровня тестостерона составляет не менее 30% у мужчин в возрасте 40–79 лет [2].
Распространенность андрогенного дефицита у российских мужчин оценена в условиях амбулаторной практики урологов и врачей смежных специальностей [3]. В данном эпидемиологическом исследовании при проведении скрининга установлено, что у каждого третьего мужчины независимо от возраста и характера первичной патологии имеют место клинико-лабораторные признаки андрогенного дефицита. Эти данные подтверждаются результатами российского эпидемиологического исследования распространенности дефицита тестостерона у мужчин с сахарным диабетом (СД), проведенного по инициативе Российской ассоциации эндокринологов в 2017–2019 гг. Так, встречаемость гипогонадизма у мужчин с СД 2 типа составила 32,7% [4].
Высокая распространенность андрогенного дефицита в общей популяции мужчин среднего и пожилого возраста, а также частое сочетание с метаболической патологией заставляют задуматься о его роли в возникновении метаболических нарушений, необходимости своевременной диагностики и коррекции.
Андрогенный дефицит и сахарный диабет 2 типа
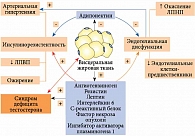
В исследовании MMAS (2006 г.) показано, что в течение последних 20 лет в мужской популяции активно прогрессирует тенденция к снижению концентрации тестостерона [5]. Уменьшение уровня тестостерона достоверно связано с возрастом. Частота развития метаболического синдрома при гипогонадизме, особенно у пациентов среднего возраста, повышается. Дефицит тестостерона приводит к стимуляции роста висцеральных адипоцитов и, как следствие, ожирению. В свою очередь ожирение, декомпенсированный и длительно протекающий СД 2 типа могут ухудшить тяжесть дефицита андрогенов (рис. 1).
В исследовании, проведенном C.A. Allan и соавт. (2007 г.), установлена обратная связь между окружностью талии (показатель висцерального ожирения) и уровнем тестостерона во всех возрастных группах [6]. D.G. Goulis и соавт. (2008 г.) установили, что при избыточном весе страдает тестикулярная функция, что проявляется уменьшением уровня общего тестостерона и ГСПС [7]. Известно, что жировая ткань является эндокринным органом [8]. Ее ароматаза способствует превращению тестостерона и андростендиона в эстрогены – эстрон и эстрадиол. Повышенное количество эстрогенов приводит к подавлению секреции гонадотропин-рилизинг и лютеинизирующего гормонов, что также ведет к снижению уровня тестостерона. Аналогичные данные получены при анализе метаболических нарушений и репродуктивной функции у мужчин [9].
По мнению некоторых исследователей, андрогены могут влиять на метаболизм глюкозы и развитие инсулинорезистентности независимо от наличия избыточной массы тела и ожирения. Под действием 5-альфа-редуктазы тестостерон метаболизируется до 5-альфа-дигидротестостерона и 17-бета-эстрадиола. Последний метаболит влияет на усиление синтеза соматотропного гормона и развитие нарушения толерантности тканей к глюкозе с повышением уровня инсулина и формированием инсулинорезистентности [10].
Согласно данным P.M. Mah и соавт. (2010 г.), снижение уровня тестостерона повышает риск возникновения инсулинорезистентности и, следовательно, СД 2 типа [9]. R. Defay и соавт. в ходе исследования CALDIA (1998 г.) также установили, что наличие СД 2 типа у мужчин ассоциируется с более низким уровнем тестостерона [11]. В исследование CALDIA было включено 186 пациентов – 77 меланезийцев и 16 европейцев, которых разделили на группы исследования и контроля. Каждая из групп также включала по 104 женщины меланезийской расы, 69 из них находились в предменопаузальном периоде и 35 – в постменопаузальном. В обеих этнических группах наличие СД 2 типа было связано с более низкими уровнями тестостерона, но между европейцами различия оказались более выраженными. Уровень тестостерона отрицательно коррелировал с индексом массы тела (r = -0,35, p < 0,01) и уровнем инсулина натощак (r = -0,37, р < 0,001) только у меланезийцев. У меланезийских женщин с СД 2 типа уровень ГСПС был более низким (р < 0,001). Средний уровень ГСПС не был связан со статусом менопаузы [11].
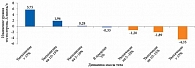
Распространенность сексуальных дисфункций при метаболическом синдроме изучали G. Corona и соавт. (2009 г.) [12]. Из 236 пациентов 96,5% жаловались на эректильную дисфункцию, 39,6% – на снижение полового влечения. Ученые выявили, что концентрация общего тестостерона уменьшалась по мере увеличения числа компонентов метаболического синдрома (рис. 2) [12].
Влияние уровня тестостерона на риск развития СД 2 типа у мужчин от 40 до 70 лет с десятилетним интервалом оценивалось в исследовании MMAS (2000 г.) [1]. Низкие уровни тестостерона и ГСПС были предикторами развития как инсулинорезистентности, так и СД 2 типа. При снижении уровня свободного тестостерона на одно стандартное отклонение (4 нг/дл) риск развития СД 2 типа составлял 1,58, уровня ГСПС на одно стандартное отклонение (16 нмоль/л) – 1,89. Эти данные позволили предположить, что дефицит андрогенов является независимым фактором риска возникновения СД 2 типа.
В исследовании TELECOM, проведенном D. Simon и соавт. (1997 г.), при обследовании 1292 пациентов выявлено, что у мужчин с низким уровнем общего тестостерона по сравнению с лицами с нормальными его значениями значительно более высокие значения индекса массы тела (р < 0,01), соотношения окружности талии к окружности бедер (р < 0,001), систолического артериального давления (р < 0,05), глюкозы плазмы натощак и через два часа после нагрузки глюкозой (р < 0,04 и р < 0,02 соответственно), триглицеридов (р < 0,001), общего холестерина (р < 0,04), липопротеинов низкой плотности (ЛПНП) (p < 0,01), аполипопротеина B (р < 0,01), инсулина натощак и через два часа после нагрузки глюкозой (р < 0,0001), а также более низкие показатели липопротеинов высокой плотности (ЛПВП) (р < 0,01) и аполипопротеина A1 (р < 0,05) [13]. После поправки на индекс массы тела и соотношение «окружность талии/окружность бедер» концентрация инсулина натощак и через два часа после нагрузки, уровень триглицеридов также достоверно различались между группами (р < 0,04, р < 0,001 и р < 0,03 соответственно). ГСПС достоверно был снижен в группе пациентов с низким уровнем тестостерона (р < 0,0001), однако значения биодоступного тестостерона в группах существенно не различались. В этом исследовании «случай – контроль» получены дополнительные и более убедительные доказательства отрицательной связи между уровнем тестостерона и плазменным инсулином у мужчин.
Помимо нарушения углеводного обмена дефицит андрогенов влияет на липидный обмен и приводит к нежелательному повышению интенсивности перекисного окисления липидов под действием их свободнорадикального окисления [14].
Приведенные выше закономерности в ряде работ подвергаются сомнению. Например, в исследовании R.Y. Chen и соавт. (2006 г.) показано, что уровень тестостерона продолжает снижаться даже у здоровых мужчин в возрасте 80 лет и старше [15]. Несмотря на более низкий уровень общего тестостерона у мужчин с висцеральным ожирением и метаболическим синдромом по сравнению со здоровыми мужчинами и наличие отрицательной связи между его уровнем и окружностью талии, а также уровнем ЛПНП, влияние низких показателей тестостерона на риск развития СД 2 типа не доказано. Ученые предположили, что андрогенный дефицит является следствием, а не причиной метаболического синдрома.
Безусловно, необходимо проведение дальнейших исследований, однако нельзя отрицать тот факт, что дефицит андрогенов и висцеральное ожирение, нарушение углеводного обмена – взаимоотягощающие состояния.
Коррекция андрогенного дефицита
Не вызывает сомнений, что основой коррекции гипогонадизма, развившегося на фоне инсулинорезистентности (ожирения и СД 2 типа, метаболического синдрома), должно быть снижение массы тела. Известно, что концентрация тестостерона отрицательно коррелирует с индексом массы тела и инсулинорезистентностью [16].
Результаты долгосрочного наблюдения в исследовании EMAS (n = 2395) свидетельствуют, что увеличение или уменьшение массы тела имеет четкую обратную связь с концентрацией тестостерона (рис. 3) [17].
Снижение веса с помощью диеты, физической активности, фармакотерапии или бариатрической хирургии способствует не только повышению общего и свободного тестостерона, но и преодолению функционального гипогонадизма, ассоциированного с ожирением [17–19]. Однако необходима потеря веса хотя бы на 10% от исходного.
Важно отметить, что модификация образа жизни приводит к менее значимому снижению массы тела и повышению концентрации тестостерона. В то же время любое вмешательство второй линии, будь то фармакотерапия или бариатрическая хирургия, всегда должно быть дополнением к диетотерапии и физической активности [18].
Влияние диетотерапии, физических нагрузок, заместительной терапии тестостероном на снижение массы тела и коррекцию гипогонадизма оценили V.A. Giagulli и соавт. (2019 г.) [20]. Некоторые положения их работы наряду с результатами исследований других ученых представлены ниже.
Диетотерапия
В ряде исследований, доступных к настоящему времени, доказана эффективность низкокалорийных и очень низкокалорийных диет в повышении концентрации общего и свободного тестостерона, ГСПС, снижении инсулинорезистентности, общего холестерина, ЛПНП и триглицеридов, маркеров воспаления (С-реактивного белка, интерлейкина 6), улучшении таких показателей, как инсулин, лептин, ЛПВП, функции эндотелия. Снижение инсулинорезистентности статистически более значимо было связано с уровнем тестостерона [20–24]. В недавнем метаанализе, объединившем результаты 22 исследований, в которых оценивалась эффективность лечения функционального гипогонадизма, за исключением терапии тестостероном, было показано, что потеря 5 кг веса обусловливает повышение уровня тестостерона на 1 нмоль/л [25]. Полученные данные свидетельствуют о необходимости диетотерапии как первой линии лечения функционального гипогонадизма, развившегося на фоне ожирения и инсулинорезистентности. В то же время важно подчеркнуть, что варианты диет, представленные в этих исследованиях, были со значительным ограничением калорий (до 600–900 ккал/сут). В одном из них даже использовалась программа голодания, дополняемая 320 ккал/сут. Это практически невыполнимо в реальной клинической практике.
Физическая активность в сочетании с диетотерапией
Для уменьшения избыточной массы тела и ассоциированных с ней метаболических нарушений также важно увеличение расхода энергии.
В исследовании H. Kumagai и соавт. (2018 г.) оценивалось изолированное влияние аэробной физической нагрузки разной интенсивности (легкой, умеренной и высокой) на уровень тестостерона у 28 мужчин с избыточной массой тела или ожирением, а также у 16 мужчин без избыточного веса [26]. Средний возраст пациентов составил 50,0 ± 1,2 года. После 12 недель регулярных физических нагрузок уровень общего и свободного тестостерона значительно возрос у мужчин с ожирением (p < 0,01). При этом именно высокая физическая нагрузка ассоциировалась с увеличением уровня общего тестостерона (β = 0,47, p = 0,011) [20, 26]. Указанный эффект недостижим у ослабленных мужчин более старшего возраста. У мужчин с ожирением (индекс массы тела более 30 кг/м2) старше 65 лет с низкими показателями физического функционирования после 12 месяцев снижения веса (примерно на 10% от исходного) не было зафиксировано достоверно значимого улучшения показателей как общего, так и свободного тестостерона [20, 27]. Положительный эффект сочетания средиземноморской диеты с физической нагрузкой на гормональный профиль у мужчин с ожирением отмечен в исследовании А. de Lorenzo и соавт. (2018 г.) [28]. Средиземноморская диета предполагает повышенное потребление свежих овощей и фруктов, оливкового масла холодного отжима, белков в составе овощей, бобовых и рыбы. В данном исследовании диета предполагала снижение калорийности пищи на 170–250 ккал/сут (относительно величины основного обмена), получение белков из расчета 1,5 г/кг идеальной массы тела. Суточная калорийность в макронутриентах распределялась следующим образом: углеводы – 45–50%, белки – 20–25%, жиры – 30% (насыщенные – 7%, полиненасыщенные жирные кислоты – 10–20%, мононенасыщенные – 10–20%, холестерин – менее 1 мг/сут). Потребление пищевых волокон составляло 25–30 г/сут, соли – менее 5 г/сут. Прием алкоголя не разрешался. Предписывалась также физическая нагрузка длительностью 150 мин/нед в умеренном режиме (50–70% от максимальной частоты сердечных сокращений) и/или 90 мин/нед в интенсивном режиме (более 70% от максимальной частоты сердечных сокращений). Физические упражнения было рекомендовано выполнять как минимум три раза в неделю. Через три месяца параллельно со снижением жировой массы зафиксировано возрастание концентрации общего тестостерона (р = 0,002) [20, 28].
Исследование DPP, длившееся с 1996 по 1999 г., стало одним из крупнейших, в котором оценивался эффект снижения веса на уровень тестостерона. В него было включено 886 мужчин. Средний возраст – 52 года, средний индекс массы тела – 32 кг/м2. Участники исследования были рандомизированы на три группы. В первой группе получали плацебо дважды в день (n = 278), во второй – метформин 850 мг два раза в день (n = 315), в третьей – модифицировали образ жизни (n = 293). Через 12 месяцев масса тела уменьшилась на 0,12, 2,73 и 7,87 кг соответственно. Уровень общего тестостерона увеличился только в последней группе – на 1,15 нмоль/л [20].
Как уже упоминалось ранее, мероприятия по изменению образа жизни должны лежать в основе лечения функционального гипогонадизма, ассоциированного с инсулинорезистентностью. Однако далеко не всегда пациенты способны длительно соблюдать предписания по диетотерапии и режиму физической активности. У мужчин старшего возраста снижение веса может сопровождаться потерей мышечной массы и минеральной плотности костной ткани, что будет дополнительным основанием для уменьшения физической нагрузки. Кроме того, как отмечалось ранее, на фоне модификации образа жизни и снижения массы тела показатели тестостерона могут не достичь нормальных значений.
Заместительная терапия тестостероном
Может ли заместительная терапия тестостероном усилить эффект мероприятий по модификации образа жизни и предотвратить потерю мышечной массы, связанной с диетотерапией?
Исследования последних лет свидетельствуют, что применение препаратов тестостерона способствует улучшению состава тела (снижению жировой и набору тощей массы), повышению чувствительности тканей к инсулину. Важно отметить, что уменьшение веса на фоне ограничения калорийности питания обусловливает снижение как жировой, так и тощей массы. При сочетании низкокалорийной диеты с терапией тестостероном масса тела снижается только за счет потери жировой массы [20, 29].
Таким образом, тестостерон играет ключевую роль в регуляции энергообмена, липогенеза, метаболизма углеводов и жиров, а также в поддержании азотистого баланса организма [30].
Положительный эффект терапии тестостероном на состав тела отмечается у гипогонадных мужчин старшего возраста с и без других метаболических нарушений.
В рандомизированном контролируемом исследовании, проведенном K.L. Hildreth и соавт. (2013 г.), оценивался эффект тестостерона (в виде трансдермального геля) по сравнению с плацебо у мужчин с низким пограничным уровнем тестостерона. В течение 12 месяцев помимо данного лечения в одной группе проводились физические тренировки. Сочетание применения тестостерона с физической активностью способствовало статистически значимому улучшению показателей жировой (р = 0,03) и тощей (р = 0,01) массы по сравнению с плацебо. В группе нетренировавшихся мужчин также фиксировалось достоверное улучшение показателей жировой (р = 0,005) и тощей (р = 0,03) массы по сравнению с группой плацебо. Кроме того, у них наблюдалось повышение силы верхней части тела (р = 0,03) [31].
Аналогичные результаты получены в популяции гипогонадных мужчин с СД 2 типа и метаболическим синдромом. Так, в работе S. Dhindsa и соавт. (2016 г.) показано, что у мужчин, получавших терапию тестостероном (внутримышечно) в течение шести месяцев, масса тела не уменьшилась, однако потеря подкожного жира составила примерно 3 кг, набор тощей массы – примерно 3 кг (р < 0,01). При этом содержание висцерального жира не изменилось [32].
Метаболические показатели также важны при оценке влияния терапии тестостероном. Исследования последних лет убедительно доказывают, что использование препаратов тестостерона улучшает некоторые параметры.
Связь между снижением чувствительности тканей к инсулину, риском развития СД 2 типа и андрогенным дефицитом подтверждена в исследовании MRFIT [33]. Установлено, что более высокий уровень тестостерона и ГСПС у пожилых мужчин ассоциируется с более высокой чувствительностью тканей к инсулину и снижением риска развития метаболического синдрома независимо от уровня инсулина и состава тела. Следовательно, андрогены могут предупреждать риск развития или ухудшения показателей метаболического синдрома. Как эндогенный, так и экзогенный тестостерон снижает количество висцерального жира, влияя на специфичные рецепторы андрогенов в адипоцитах и стимулируя аденилатциклазу, протеинкиназу А и гормонспецифическую липазу, в результате потенцируется липолиз и снижается количество жира в адипоцитах [34].
В исследовании E.T. Schroeder и соавт. (2004 г.) у мужчин с избыточным весом и низким уровнем тестостерона андрогенная терапия в течение 12 недель способствовала улучшению некоторых параметров метаболического синдрома [35]. В частности, выявлено значительное и долговременное уменьшение региональной абдоминальной и периферической жировой ткани, а также увеличение чувствительности тканей к инсулину.
Положительный эффект экзогенных андрогенов у мужчин с СД 2 типа и возрастным андрогенным дефицитом продемонстрирован в исследовании M.A. Boyanov и соавт. (2003 г.) [36]. Так, терапия андрогенами приводила к достоверному снижению уровня гликированного гемоглобина (HbA1c) с 10,40 до 8,60%, веса на 2,66%, соотношения «окружность талии/окружность бедер» на 3,96% и количества висцеральной жировой ткани на 5,65%.
В начале 90-х гг. в работах P. Marin и соавт. указывалось на улучшение чувствительности тканей к инсулину, которая оценивалась с помощью эугликемического клэмп-теста, у пациентов с ожирением без СД на фоне терапии тестостероном в пероральной и трансдермальной формах [37–39]. Эти данные были подтверждены в более поздних исследованиях у пациентов с СД 2 типа, получавших трансдермальный гель тестостерона [32, 40]. Однако данные о влиянии терапии тестостероном на показатели углеводного обмена у мужчин с СД 2 типа противоречивы.
D. Kapoor и соавт. (2006 г.) отметили положительное влияние терапии тестостероном по сравнению с приемом плацебо на показатели HbA1c и гликемии натощак [41]. В другом исследовании у пациентов с впервые выявленным СД, получавших терапию тестостероном в трансдермальной форме, через год наблюдалось снижение уровня HbA1c с 7,5 до 6,3%. Тестостерон был дополнением к диете и физическим нагрузкам. Сахароснижающие препараты больные не получали [42]. В многоцентровом проспективном рандомизированном двойном слепом плацебоконтролируемом исследовании TIMES оценивались эффекты заместительной терапии тестостероном в виде трансдермального геля на инсулинорезистентность, сердечно-сосудистые факторы риска и другие симптомы у мужчин с гипогонадизмом и СД 2 типа и/или метаболическим синдромом. В исследовании приняло участие 220 больных. Длительность наблюдения составила 12 месяцев. На фоне лечения показатель HOMA-IR уменьшился на 15,2% через шесть месяцев (p = 0,018), на 16,4% через 12 месяцев (p = 0,006). Анализ данных подгруппы пациентов с СД 2 типа показал, что через девять месяцев уровень HbA1c в ней значимо снизился по сравнению с группой плацебо. В группе плацебо значения HbA1c, наоборот, повысились. Средняя разница по HbA1c составила 0,446% (р = 0,035), что дало суммарную разницу 20,58% (p = 0,005). Данный тренд сохранялся через 12 месяцев с разницей 20,49% (p = 0,066). Между группами не наблюдалось значимых различий по частоте развития нежелательных явлений, большинство из них были легкими или умеренными [40].
Влияние заместительной терапии тестостероном на гликемический контроль изучалось в нескольких метаанализах. В частности, метаанализ X. Cai и соавт. (2014 г.), в который были включены только рандомизированные контролируемые исследования [43], показал, что было проведено только пять исследований по оценке метаболизма глюкозы, содержания липидов и жировой ткани. Общее количество их участников – 351, средняя продолжительность наблюдения – 6,5 месяца. Применение тестостерона способствовало снижению концентрации глюкозы натощак (средняя разница составила -1,10 при 95%-ном доверительном интервале (ДИ) -1,88– -0,31), инсулина натощак (-2,73 (95% ДИ -3,62– -1,84)), HbA1c (-0,87 (95% ДИ -1,32– -0,42)) и триглицеридов (-0,35 (95% ДИ -0,62– -0,07)). В отношении других исходов значимых различий между группами тестостерона и контрольными группами не наблюдалось.
В метаанализ, проведенный G. Corona и соавт. (2016 г.), были включены 59 рандомизированных контролируемых клинических исследований с общим числом пациентов на заместительной терапии тестостероном 3029 и 2049 в группе контроля [44]. На фоне заместительной терапии тестостероном значимо снизились масса тела, окружность талии и индекс массы тела. Такое лечение ассоциировалось со значительным уменьшением жировой массы, увеличением тощей массы и значимым снижением гликемии натощак. Ее влияние на гликемический контроль было более выраженным у более молодых пациентов.
В ряде других исследований не отмечено воздействие терапии тестостероном на показатели углеводного обмена [32, 45, 46]. Отсутствие эффекта на гликемический контроль и другие метаболические показатели может быть связано с методологическими погрешностями и особенностями этих исследований (маленькая выборка, небольшая длительность лечения, разные исходные показатели гликемии натощак в сравниваемых группах), а также с особенностями популяции пациентов, в частности низким, близким к нормальному уровнем исходного HbA1c. На показатели HbA1c на фоне терапии тестостероном могло повлиять увеличение эритропоэза независимо от колебаний гликемии. Поэтому нужны дальнейшие исследования с тщательным сбором данных.
В настоящее время целью заместительной терапии является поддержание уровня сывороточного тестостерона в пределах нормы [47]. Согласно рекомендациям экспертов Европейской ассоциации урологов (European Association of Urology – EAU), а также Эндокринологического общества США, необходимо восстановить уровень тестостерона до средненормальных значений [48, 49]. Эксперты Американской ассоциации клинических эндокринологов целевым уровнем тестостерона при проведении заместительной терапии считают 9,7–27,8 нмоль/л [50], Американской урологической ассоциации – 15,6–20,8 нмоль/л [51].
Таким образом, целью заместительной терапии тестостероном является улучшение клинических симптомов и достижение уровня тестостерона, соответствующего средненормальным значениям у здоровых молодых мужчин (14,0–17,5 нмоль/л) [49].
Согласно последним зарубежным и отечественным клиническим рекомендациям, оценка уровня общего тестостерона показана всем мужчинам с ожирением, метаболическим синдромом и СД. Гипогонадизм диагностируется при наличии клинических симптомов, ассоциированных с дефицитом андрогенов, и выявлении стойкого снижения уровня тестостерона (при двукратном определении). В перечень минимальных обследований также входит определение пролактина, лютеинизирующего гормона и тиреотропного гормона. Пороговым значением тестостерона, позволяющим разграничить нормальное состояние и потенциальный дефицит, следует считать 12,1 нмоль/л для общего тестостерона сыворотки крови. При уровне общего тестостерона от 8 до 12 нмоль/л целесообразно определить уровень ГСПС с последующим расчетом уровня свободного тестостерона. Калькулятор опубликован на сайте Международного общества по изучению вопросов старения мужчин (http://www.issam.ch/freetesto.htm).
По данным большинства исследователей, нижняя граница нормы составляет 243 пмоль/л (0,243 нг/дл) [47–49].
При выборе метода лечения следует учитывать возраст больного и его планы в отношении сохранения фертильности. Молодым пациентам с гипогонадизмом, развившимся на фоне ожирения, для которых актуально сохранение репродуктивной функции, назначение андрогенной терапии нежелательно, так как все препараты тестостерона подавляют сперматогенез. Когда необходимости в сохранении репродуктивной функции нет, рекомендуется заместительная терапия.
Противопоказаниями к терапии препаратами тестостерона являются [52]:
- рак предстательной железы;
- рак грудной железы у мужчин;
- необходимость репродуктивной реабилитации;
- гематокрит > 54%;
- тяжелая хроническая сердечная недостаточность четвертого класса по классификации Нью-Йоркской кардиологической ассоциации.
В динамике противопоказаний к терапии препаратами тестостерона в отношении предстательной железы наблюдается тенденция к уменьшению ограничения таковой. В частности, в рекомендациях EAU абсолютным противопоказанием для назначения заместительной терапии тестостероном является активный местнораспространенный и метастатический рак простаты. В то же время указывается, что заместительная терапия не увеличивает риск развития рака предстательной железы, хотя необходимы дальнейшие проспективные исследования в этой области. Впервые в тексте рекомендаций обсуждается вопрос о том, что при наличии у мужчин симптомов патологии нижних мочевыводящих путей и/или аденомы предстательной железы скорее низкий, а не высокий уровень тестостерона оказывает негативное влияние на их течение. Относительные противопоказания при значениях IIPS > 19 связаны с исключением данной категории больных из проводившихся ранее клинических исследований [48].
В настоящее время для заместительной терапии применяются препараты тестостерона для инъекционного и трансдермального введения, различающиеся фармакокинетическими показателями. Решение о выборе конкретного препарата принимает врач совместно с пациентом.
Препараты эфиров тестостерона для инъекционного введения используют уже несколько десятилетий. Однако после внутримышечного введения часто возникает резкое и супрафизиологическое повышение концентрации тестостерона в крови в первые несколько дней после инъекции. В последние дни интервала между дозами уровень гормона уменьшается за границы нормы. Указанные колебания концентраций тестостерона могут отражаться на настроении, либидо и работоспособности пациентов. Пролонгированное действие инъекционных препаратов становится серьезным фактором риска в случае патологического повышения гематокрита и связанного с ним нарушения свертываемости крови. Эритроцитоз чаще отмечается на фоне применения инъекционных форм тестостерона по сравнению с использованием трансдермальных форм. Данный факт может объясняться достижением более высоких плазменных концентраций при инъекционном введении [53]. Кроме того, указанные препараты представляют собой масляный раствор в объеме нескольких миллилитров, что может вызывать боль в месте инъекции [54, 55].
Повышение уровня тестостерона до физиологических значений и его значительные колебания (даже в рамках физиологических значений) могут не ощущаться пациентами, однако это не умаляет значения объективных биохимических процессов и отдаленных малоизученных последствий таковых, особенно при длительной терапии. Патологическое повышение гематокрита отмечалось у 43,8% пациентов, получавших инъекции эфиров тестостерона [56]. Превышение показателей гематокрита более чем на 54% является основанием для прекращения заместительной терапии тестостероном до их нормализации.
При сравнении безопасности лекарственных форм тестостерона почти у полумиллиона пациентов (36% использовали инъекции, 9% – пластырь и 55% – гели) установлено, что инъекционные формы тестостерона характеризуются более высоким риском развития сердечно-сосудистых осложнений (инфаркта миокарда, нестабильной стенокардии и инсульта), более высокой частотой госпитализаций и смертей по сравнению с гелевыми формами (рис. 4) [57, 58].
Во многих руководствах, в том числе российских [47] и европейских [48], начинать андрогензаместительную терапию рекомендовано с препаратов короткого действия. Это позволяет быстро прекратить лечение в случае возникновения любых нежелательных явлений.
К препаратам короткого действия относится 1%-ный гель тестостерона (Андрогель®). Он обеспечивает равновесную концентрацию тестостерона без супрафизиологических колебаний. Трансдермальная форма представляет собой 1%-ный спиртовой гель тестостерона в индивидуальных саше. В каждом саше содержится 50 мг действующего вещества. Ежедневное нанесение по 50–100 мг геля позволяет увеличить концентрацию тестостерона до средненормальной [59]. Около 25% пациентов требуется более 50 мг геля для достижения целевого уровня тестостерона в крови.
Трансдермальный препарат тестостерона Андрогель® (50–100 мг) при нанесении на кожу воспроизводит циркадный ритм и поддерживает уровень тестостерона в пределах средних физиологических значений.
Абсорбция тестостерона через кожу варьируется от 9 до 14% в зависимости от нанесенной дозы. Далее тестостерон поступает в системный кровоток в относительно постоянных концентрациях в течение суток. Уровень тестостерона в сыворотке крови возрастает с первого часа применения препарата Андрогель® и достигает постоянного значения на второй день. Суточные колебания тестостерона имеют такую же амплитуду, как и при циркадных ритмах изменения содержания эндогенного тестостерона. При трансдермальном введении препарата отсутствуют супрафизиологические пики концентрации тестостерона в крови, обычно возникающие при инъекционном способе применения. Применение 50 мг Андрогеля увеличивает концентрацию тестостерона в плазме в среднем на 2,5 нг/мл (8,7 нмоль/л).
После прекращения лечения уровень тестостерона начинает снижаться примерно через 24 часа после последнего нанесения геля. К исходному уровню он возвращается через 72–96 часов после нанесения последней дозы.
Заключение
Определение уровня тестостерона необходимо у всех пациентов с ожирением, метаболическим синдромом и СД 2 типа. Андрогенодефицит у таких пациентов может развиваться постепенно без выраженных клинических симптомов. В данной популяции его распространенность варьируется от 25 до 33%. Патогенетические механизмы этого процесса продолжают изучаться.
Коррекция андрогенодефицита у мужчин с инсулинорезистентностью должна включать модификацию образа жизни, а также заместительную терапию тестостероном при наличии показаний.
Результаты исследований свидетельствуют, что заместительная терапия способствует повышению чувствительности тканей к инсулину, увеличению тощей массы, снижению маркеров воспаления и жировой массы. Во время терапии должны контролироваться гематологические показатели (эритроциты, гематокрит) и состояние простаты.
При выборе формы препарата необходимо руководствоваться данными об эффективности, безопасности и удобстве применения. С позиции безопасности при длительном применении инъекционные формы имеют ряд недостатков по сравнению с трансдермальными формами.
Удобство и безболезненность Андрогеля позволяют сохранить приверженность пациентов лечению в долгосрочной перспективе.
A.M. Mkrtumyan, MD, PhD, Prof., L.V. Yegshatyan, PhD, Yu.A. Shishkova, PhD
A.I. Yevdokimov Moscow State University of Medicine and Dentistry
A.S. Loginov Moscow Clinical Scientific and Practical Center
Contact person: Ashot M. Mkrtumyan, vagrashot@mail.ru
The increase in life expectancy can be considered as the triumph of science. However, the population aging brings with it many new challenges. Thus, the natural aging process results in a decrease in the level of sex hormones. Currently, it is proved the role of sex hormone deficiency in the development of abdominal obesity, insulin resistance, hyperinsulinemia, which in turn are recognized as pathogenetic components of type 2 diabetes.
The article presents data on the impact of androgen deficiency on the risk of obesity, insulin resistance and type 2 diabetes.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.