Одним из наиболее авторитетных источников информации для врачей по вопросам диагностики и лечения различных заболеваний являются клинические рекомендации, подготовленные ведущими медицинскими специалистами на основе современных доказательных данных. Несмотря на существование большого числа рекомендаций, посвященных проблеме ведения пациентов с инфекциями нижних дыхательных путей (ИНДП), особое внимание врачебной общественности в свое время было привлечено к согласительным рекомендациям Европейского респираторного общества (European Respiratory Society, ERS) и Европейского общества клинической микробиологии и инфекционных заболеваний (European Society of Clinical Microbiology and Infectious Diseases, ESCMID). Предыдущая версия документа была опубликована в 2005 г. За прошедшее время некоторые представления о ИНДП претерпели изменения, появились новые данные об этиологии респираторных инфекций, резистентности ключевых возбудителей заболеваний. Доказательная база, составляющая основу формирования современных рекомендаций, значительно расширилась, что потребовало пересмотра и обновления их отдельных положений. Актуальная версия рекомендаций стала результатом согласованного мнения европейских экспертов в области респираторной медицины, клинической микробиологии и инфекционных болезней и была выработана на основании анализа данных, полученных в ходе контролируемых клинических исследований, опубликованных до мая 2010 г. [1].
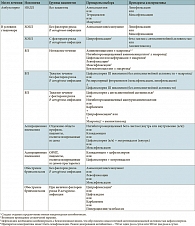
При составлении обсуждаемого документа авторами была использована следующая шкала оценки уровня доказательности данных (табл. 1). Положения рекомендаций сопровождаются индексом доказательности, указывающим на степень их достоверности (табл. 2).
В настоящих рекомендациях рассматриваются вопросы ведения пациентов с внебольничными ИНДП. Нозокомиальные респираторные инфекции, ИНДП у детей, пациентов с тяжелыми дефектами иммунитета остались за рамками документа.
Определение
Авторы рекомендаций выделяют симптомы, наиболее характерные для отдельных заболеваний дыхательных путей, и предлагают следующие определения.
Инфекция нижних дыхательных путей представляет собой остро развившееся (не более 21 дня) заболевание, основным проявлением которого является кашель в сочетании по меньшей мере с одним симптомом поражения дыхательных путей (одышка, продукция мокроты, хрипы, боль в грудной клетке) при отсутствии очевидной диагностической альтернативы (синусит, бронхиальная астма и т.д.).
Острый бронхит – остро возникшее заболевание у пациента без хронической патологии легких, ведущим клиническим признаком которого является кашель (продуктивный или непродуктивный) сопровождающийся другими симптомами инфекции дыхательных путей, при отсутствии подозрения на наличие иного заболевания (синусит, бронхиальная астма и т.д.).
Грипп – остро развившееся заболевание, характерными симптомами которого являются лихорадка, головная боль, миалгии, кашель, боль в горле.
Пневмонию, по мнению экспертов, следует предполагать при наличии остро возникшего кашля и по крайней мере одного из следующих признаков:
- одышки;
- тахипноэ;
- лихорадки более четырех дней;
- физических признаков (фокус крепитации и/или мелкопузырчатые хрипы, бронхиальное дыхание, укорочение перкуторного звука).
Диагноз становится определенным при наличии рентгенологически подтвержденной очаговой инфильтрации легочной ткани.
Европейские эксперты предлагают оказаться от использования термина «пневмония, связанная с оказанием медицинской помощи», поскольку в ходе контролируемых исследований не получено убедительных доказательств отличия структуры и профиля антибиотикорезистентности возбудителей данной группы пневмоний от таковых при внебольничной пневмонии (ВП).
Обострение хронической обструктивной болезни легких (ХОБЛ) – ухудшение в состоянии пациента, характеризующееся появлением/нарастанием одышки, усилением кашля, увеличением объема отделяемой мокроты и/или изменением ее цвета и требующее модификации проводимой терапии. Сочетание вышеуказанных симптомов с очаговыми изменениями в легочной ткани позволяет предположить наличие ВП.
Сходная клиническая симптоматика характеризует обострение бронхоэктазов.
Этиология
Анализируя данные, полученные при изучении этиологии ИНДП, авторы документа отмечают, что структура возбудителей респираторных инфекций в последние годы не претерпела существенных изменений. Ключевыми внеклеточными возбудителями ВП остаются Streptococcus pneumoniae и Haemophilus influenzae. Среди внутриклеточных патогенов ведущая роль принадлежит Mycoplasma pneumoniae, несколько реже встречаются представители Legionella spp. и Chlamydia spp. Вклад респираторных вирусов в развитие ВП и других внебольничных ИНДП (моно- и микст-инфекция) достигает согласно результатам проведенных исследований 30 и 60% соответственно.
У пациентов, госпитализированных в отделение реанимации и интенсивной терапии (ОРИТ), возрастает этиологическая роль Staphylococcus aureus, Legionella spp., грамотрицательных бактерий. Результаты исследований, на которые ссылаются европейские эксперты, свидетельствуют о высокой распространенности микст-инфекций. Так, частота выделения двух и более микроорганизмов (в том числе вне- и внутриклеточных возбудителей, бактерий и вирусов) у госпитализированных иммунокомпетентных пациентов с ВП составляет от 6 до 26%.
Авторы рекомендаций обращают внимание на распространение во внебольничной среде такого исходно нозокомиального возбудителя, как метициллинорезистентный S. aureus (MRSA), получившего название «внебольничный MRSA» (community-acquired MRSA, CA-MRSA). Отличительным признаком CA-MRSA служит продукция лейкоцидина Пантона – Валентина (Panton – Valentine Leukocidin, PVL) – экзотоксина, разрушающего лейкоциты и являющегося важным фактором вирулентности стафилококков. Инфицирование CA-MRSA сопровождается развитием тяжелых некротизирующих пневмоний, пневмоторакса, эмпиемы и септицемии.
Говоря об этиологии обострения ХОБЛ, эксперты обращают внимание на тот факт, что в данной клинической ситуации структура возбудителей в значительной степени коррелирует с имеющимися у пациента нарушениями вентиляционной функции легких. Наиболее часто обострение заболевания обусловлено инфицированием новыми штаммами S. pneumoniae, H. influenzae и Moraxella catarrhalis.
Наличие бронхоэктазов, особенно в сочетании с нарушением вентиляционной функции легких, предшествующий прием антимикробных препаратов (АМП) ассоциируются с колонизацией бронхиального дерева Pseudomonas aeruginosa.
Вместе с тем авторы документа подчеркивают, что даже при тщательно выполненных исследованиях этиологию большого числа ИНДП установить не удается.
Резистентность основных возбудителей ИНДП к антимикробным препаратам
Проблема лечения респираторных инфекций связана в первую очередь с высоким уровнем резистентности пневмококка к пенициллину и другим традиционно применяемым АМП.
Данные мониторинга устойчивости S. pneumoniae к АМП в европейских странах, полученные в рамках исследования EARSS (European Antimicrobial Resistance Surveillance System), свидетельствуют о широком распространении штаммов пневмококка, резистентных к пенициллину и эритромицину. Частота выделения пневмококков, нечувствительных к данным антибиотикам, в некоторых европейских странах (Кипр, Мальта) достигает 47%. В то же время авторы рекомендаций отмечают, что в странах с традиционно высоким уровнем резистентности возбудителя, таких как Франция, Израиль, Норвегия, Бельгия, распространение устойчивых штаммов S. pneumoniae в течение последних лет значительно уменьшилось. Наиболее активными антипневмококковыми бета-лактамами остаются карбапенемы. Высокая чувствительность возбудителя сохраняется к действию цефепима, цефтриаксона и цефотаксима. Среди пероральных бета-лактамных антибиотиков максимальной активностью в отношении S. pneumoniae обладает амоксициллин. Использование цефуроксима при пневмонии с бактериемией, вызванной штаммами пневмококка, нечувствительными к пенициллину, согласно результатам исследований ассоциируется с увеличением смертности пациентов.
В 2008 г. в соответствии с рекомендациями Института клинических и лабораторных стандартов (CLSI, США) были пересмотрены контрольные значения минимальной подавляющей концентрации (МПК) пенициллина для пневмококка. Согласно прежним стандартам чувствительность, умеренную резистентность и резистентность возбудителя к пенициллину определяли значения МПК ≤ 0,06, 0,12–1 и ≥ 2 мг/л соответственно. В последней версии рекомендаций CLSI эти значения сохранены для пациентов с пневмококковой инфекцией без менингита, которые в качестве антибактериальной терапии (АБТ) могут получать пенициллин внутрь. При необходимости парентерального введения антибиотика установлены новые контрольные значения МПК, составляющие ≤ 2, 4 и ≥ 8 мг/л, что расширяет потенциальные возможности использования пенициллина для лечения пневмококковых инфекций без менингита и способствует предотвращению роста резистентности возбудителя к антибиотикам широкого спектра действия. Результаты исследований, на которые ссылаются европейские эксперты, свидетельствуют об эффективности использования бензилпенициллина (3,2 млн ЕД шесть раз в сутки) и цефалоспоринов III поколения (цефтриаксон 1 г два раза в сутки и цефотаксим 2 г четыре раза в сутки) для лечения экстраменингеальных пневмококковых инфекций, вызванных штаммами возбудителя с МПК пенициллина ≤ 8 мг/л. Применение пероральных цефалоспоринов при пневмококковых инфекциях, вызванных штаммами с МПК пенициллина ≥ 2 мг/л, нецелесообразно.
Говоря о резистентности S. pneumoniae к макролидным антибиотикам, авторы документа подчеркивают, что согласно результатам проведенных исследований значение МПК эритромицина для пневмококка 0,5 мг/л (низкий уровень устойчивости возбудителя) может служить предиктором клинической неэффективности. Применение данной группы антибиотиков в течение предшествующих трех месяцев, недавнее использование пенициллина или ко-тримоксазола, пожилой возраст пациентов, ВИЧ-инфекция являются клиническими маркерами возможной неэффективности макролидов при пневмококковой инфекции.
Высокую активность в отношении S. pneumoniae сохраняют респираторные фторхинолоны: частота выявления устойчивости к препаратам данной группы в европейских странах составляет около 1%. Вместе с тем эксперты отмечают, что результаты недавно опубликованных исследований позволяют предположить рост резистентности возбудителя к левофлоксацину, моксифлоксацину и гатифлоксацину, достигающий в ряде стран (Италия, Испания) 2–3%.
Устойчивость H. influenzae к бета-лактамам формируется, как известно, в основном благодаря распространению штаммов микроорганизмов, способных вырабатывать бета-лактамазы. Согласно данным мониторинга резистентности возбудителя, в европейских странах продуцентами бета-лактамаз являются от 0,7 до 17,6% штаммов возбудителя. Макролидные антибиотики обладают лишь умеренной активностью в отношении гемофильной палочки (клинически значимой активностью обладают только азитромицин и кларитромицин). При этом, как свидетельствуют результаты исследований, до 98% штаммов H. influenzae способны снижать чувствительность к макролидам за счет активного выведения антибиотиков данной группы из микробной клетки.
СА-MRSA в большинстве случаев устойчив к бета-лактамным антибиотикам, но сохраняет чувствительность к другим группам АМП. Обсуждая лечение ВП, вызванной данным возбудителем, европейские эксперты отмечают отсутствие снижения уровня PVL на фоне монотерапии ванкомицином, что определяет необходимость сочетания гликопептида с клиндамицином или линезолидом, назначение которых позволяет уменьшить продукцию экзотоксина.
Авторы документа считают важным подчеркнуть, что профиль устойчивости возбудителей существенно варьирует в разных странах и отдельных регионах, что определяет необходимость использования при выборе препаратов локальных данных о резистентности микроорганизмов к АМП1.
Рекомендации по ведению амбулаторных пациентов
Предваряя данный раздел рекомендаций, авторы отмечают, что клинические проявления различных ИНДП нередко оказываются сходными, что определяет трудность их дифференциальной диагностики. Наибольшее внимание уделено проблеме своевременной диагностики и дифференциальной диагностики ВП.
Диагностика
Развитие пневмонии, по мнению экспертов, следует предполагать при наличии остро возникшего кашля и по крайней мере одного из следующих признаков:
- одышки;
- тахипноэ;
- тахикардии > 100 в мин;
- лихорадки более четырех дней;
- физических признаков (фокус крепитации и/или мелкопузырчатые хрипы, бронхиальное дыхание, укорочение перкуторного звука).
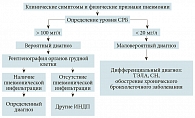
При подозрении на наличие пневмонии должен быть определен уровень С-реактивного белка (СРБ). Диагноз пневмонии следует считать вероятным при значении показателя > 100 мг/л, низкий уровень СРБ (< 20 мг/л) делает данный диагноз маловероятным.
Для уточнения диагноза необходимо проведение рентгенографии грудной клетки [B1]. Бактериоскопию с окраской по Граму и посев мокроты у амбулаторных пациентов авторы рекомендаций признают необязательными методами исследования [B1].
Дифференцировать ИНДП необходимо с застойной сердечной недостаточностью, тромбоэмболией легочной артерии (ТЭЛА), хроническим заболеванием дыхательных путей (табл. 3).
Наличие симптомов ИНДП у пациентов с нарушенным глотанием может свидетельствовать о развитии аспирационной пневмонии и требует проведения рентгенографии грудной клетки [C3].
Авторы рекомендаций обращают внимание на необходимость оценки вероятности развития осложнений у пациентов с ИНДП и выделяют следующие факторы риска осложненного течения заболевания:
- возраст ≥ 65 лет [А3]:
- сопутствующие заболевания (ХОБЛ, сахарный диабет, сердечная недостаточность);
- госпитализация в течение предшествующих 12 месяцев;
- прием глюкокортикостероидов (ГКС) внутрь;
- использование АМП в течение предшествующего месяца;
- отсутствие симптомов поражения верхних дыхательных путей;
- нарушение сознания;
- тахипноэ > 30/мин, тахикардия > 100/мин, снижение артериального давления < 90/60 мм рт. ст.;
- пневмония;
- возраст < 65 лет:
- сахарный диабет;
- бронхиальная астма;
- пневмония.
Наличие злокачественных новообразований, почечной и печеночной недостаточности увеличивает вероятность осложнений ИНДП у пациентов всех возрастных групп [C3].
Лечение
Авторы документа подчеркивают, что муколитики, противокашлевые и антигистаминные препараты, бронходилятаторы и ингаляционные ГКС не рекомендованы для лечения остро возникшей ИНДП [А1].
АБТ респираторных инфекций в амбулаторных условиях целесообразна в следующих клинических ситуациях:
- подозреваемая или диагностированная пневмония [С1];
- обострение ХОБЛ (при наличии показаний для назначения АМП) [С3];
- сопутствующие заболевания (сердечная недостаточность, инсулинозависимый сахарный диабет, выраженные нарушения неврологического статуса (инсульт и т.д.)) [С3].
Показаниями для назначения антибиотиков при обострении ХОБЛ у амбулаторных пациентов являются [С1]:
- наличие всех трех основных критериев обострения (нарастание одышки, увеличение объема отделяемой мокроты, усиление ее гнойности)2;
- обострение ХОБЛ у пациентов с тяжелым течением заболевания.
В качестве препаратов выбора для лечения ИНДП в амбулаторных условиях европейские эксперты по-прежнему рассматривают амоксициллин или тетрациклин. При непереносимости тетрациклина в странах с низким уровнем распространенности макролидорезистентных штаммов пневмококка могут быть использованы азитромицин, кларитромицин, рокситромицин.
Препаратами альтернативы являются левофлоксацин или моксифлоксацин [С1]. Выбор антибактериальных средств, подчеркивают авторы рекомендаций, должен осуществляться в соответствии с локальными данными о чувствительности микроорганизмов. Оценка эффективности АБТ проводится через 48–72 часа после начала лечения.
Анализ результатов проведенных исследований по применению противовирусных средств при ИНДП продемонстрировал, что назначение этих препаратов целесообразно только при наличии у пациента типичных проявлений гриппа (лихорадка, мышечные боли, слабость, симптомы поражения дыхательных путей) на фоне неблагоприятной эпидемиологической ситуации в первые двое суток заболевания [С1].
Выбор места лечения
Одним из ключевых вопросов ведения пациентов с ИНДП является выбор места лечения (амбулаторно, в отделении общего профиля или ОРИТ). В обсуждаемом документе сформулированы следующие показания для госпитализации:
- тяжелое течение ИНДП при подозрении на наличие пневмонии (в первую очередь следует оценить такие симптомы, как тахипноэ, тахикардия, гипотензия и нарушение сознания);
- неэффективность АБТ у пациентов с пневмонией;
- пневмония у лиц пожилого возраста при наличии тяжелых сопутствующих заболеваний (сахарный диабет, сердечная недостаточность, ХОБЛ и т.д.);
- подозрение на наличие ТЭЛА или злокачественного новообразования в легком [С3].
Авторы рекомендаций подчеркивают, что перечисленные показания основаны не на результатах клинических исследований, а являются согласованным мнением экспертов.
Выбор места лечения пациента с ВП должен определяться на основании индивидуализированной оценки каждого конкретного случая заболевания. Решая вопрос о необходимости госпитализации, следует не только оценить тяжесть состояния, но и учесть социальные факторы.
Известен ряд клинико-лабораторных шкал, которые на основании оценки прогноза ВП дают рекомендации по выбору места лечения. В ряде недавно опубликованных работ показана сравнимая прогностическая значимость таких распространенных шкал, как PORT (Pneumonia Outcomes Research Team), CURB-65 (Confusion, Urea, Respiratory rate, Blood Pressure) и CRB-65. Шкала CRB-65, предполагающая оценку только клинических параметров, представляется наиболее простой и доступной для практического использования. Эксперты отмечают, что пациенты, набравшие ≥ 1 балла по шкале CRB-65 (исключая возраст ≥ 65 лет как единственный критерий), требуют лечения в условиях стационара [A3]. Отсутствие необходимости определения лабораторных и рентгенологических критериев при сравнимой прогностической ценности шкалы CRB-65 позволило европейским экспертам рекомендовать ее в качестве основного инструмента для оценки прогноза ВП.
Необходимость госпитализации пациента в ОРИТ определяет тяжесть его состояния. Крайне важно, отмечают эксперты, своевременно выявить признаки тяжелого течения заболевания, требующие неотложной терапии. Тяжелое течение ВП характеризует наличие по меньшей мере двух из приведенных ниже признаков [А3]:
- систолическое артериальное давление < 90 мм рт. ст.;
- тяжелая дыхательная недостаточность (PaO2/FIO2 < 250);
- многодолевая (> 2) пневмоническая инфильтрация
или одного из перечисленных:
- необходимость введения вазопрессоров > 4 часов;
- необходимость проведения механической вентиляции.
Неотложная госпитализация пациента в ОРИТ требуется в случае развития острой дыхательной недостаточности, тяжелого сепсиса или септического шока, быстрого прогрессирования очагово-инфильтративных изменений в легких [А3].
В последние годы все большее внимание при оценке тяжести состояния пациентов с ВП привлекает исследование сывороточного уровня таких биомаркеров, как СРБ, прокальцитонин, D-димер, провазопрессин, предсердный натрийуретический пептид, проадреномедуллин и триггерный рецептор миелоидных клеток. Целесообразность использования этих тестов в рутинной практике в настоящее время активно изучается.
Рекомендации по ведению госпитализированных пациентов
Внебольничная пневмония
Объем диагностических исследований у госпитализированных пациентов, указывают эксперты, определяется тяжестью течения ВП [А3].
При возможности получить гнойную мокроту у пациента целесообразно выполнить микробиологическое исследование [А3]. Интерпретация результатов культурального исследования должна проводиться с учетом данных, полученных при бактериоскопии (идентичный морфотип возбудителя подтверждает достоверность исследования) [B3]. Авторы обсуждаемого документа признают, что инвазивные методы получения неконтаминированного материала не показаны абсолютному большинству пациентов с ВП. Их проведение может быть оправданным при неразрешающейся ВП, а также у пациентов, находящихся на искусственной вентиляции легких (ИВЛ) [А3].
Обязательным исследованием для госпитализированных пациентов с ВП является посев венозной крови, осуществляемый до начала АБТ (проводится забор двух образцов крови из двух разных вен) [А3]. Учитывая нежелательные реакции при проведении трансторакальной тонкоигольной аспирационной биопсии, это исследование, подчеркивают эксперты, необходимо выполнять только по индивидуальным показаниям в случае неинформативности менее инвазивных диагностических процедур с обязательным учетом тяжести состояния пациента [А3]. Наличие значительного плеврального выпота определяет необходимость выполнения диагностического торакоцентеза [А3].
При тяжелом течении ВП, а также при наличии факторов риска легионеллезной пневмонии рекомендуется выполнение иммунохроматографического теста с определением в моче растворимого антигена L. pneumophila (серогруппа I). Отрицательный результат теста, по мнению авторов, не исключает диагноза легионеллезной пневмонии [А3]. При тяжелом течении заболевания эксперты также считают целесообразным выполнение теста с определением в моче пневмококкового антигена [А3].
Серологическая диагностика инфекций, вызванных M. pneumoniae, C. pneumoniae и L. pneumophila, не рассматривается авторами рекомендаций в ряду обязательных методов исследования [А3]. Для идентификации внутриклеточных возбудителей и респираторных вирусов может быть выполнена полимеразная цепная реакция (ПЦР) [А3].
Авторы обсуждаемого документа подчеркивают, что антибактериальная терапия ВП должна быть начата непосредственно после установления диагноза [А3]. В случае развития септического шока задержка с назначением АМП не должна превышать одного часа [А1].
Выбор стартовой АБТ осуществляется с учетом следующих групп факторов:
1) группа А:
- возраст пациента (≥ 65 лет);
- общая оценка прогноза заболевания (пневмония, являющаяся проявлением терминальной стадии тяжелого сопутствующего заболевания, требует проведения симптоматической терапии);
2) группа B:
- предшествующие госпитализации и повторные курсы АБТ (пневмонию после недавних повторных курсов АМП, а также пневмонию, возникшую менее чем через три месяца после выписки из стационара, следует рассматривать как нозокомиальную);
- факторы риска тяжелой иммуносупрессии (увеличивается этиологическая значимость оппортунистических патогенов, терапия определяется соответствующими рекомендациями);
3) группа C:
- тяжесть течения заболевания;
- сопутствующие заболевания;
- место жительства пациента;
- вероятность аспирации;
- локальные данные о резистентности микроорганизмов к АМП;
- индивидуальная переносимость антибиотиков.
Рекомендации по эмпирической терапии ВП у госпитализированных пациентов представлены в табл. 4 и 5 [С4].
У пациентов с нетяжелым течением заболевания, по мнению экспертов, отсутствует необходимость обязательного назначения АМП, активных против внутриклеточных возбудителей. Лекарственная форма амоксициллина/клавуланата с повышенным содержанием аминопенициллина (2000 мг/125 мг) может иметь преимущество при лечении ВП, вызванной пенициллинорезистентным пневмококком. Авторы рекомендаций еще раз обращают внимание на недопустимость использования при ВП ципрофлоксацина.
Рекомендации по антибактериальной терапии ВП с известной этиологией представлены в табл. 6.
Как отмечают эксперты, результаты недавно проведенных исследований свидетельствуют, что эффективность респираторных фторхинолонов, особенно левофлоксацина, при лечении легионеллезной инфекции превосходит таковую макролидов. Среди макролидных антибиотиков наибольшей активностью в отношении данного возбудителя обладает азитромицин.
Авторы документа воздерживаются от конкретных рекомендаций по длительности АБТ. Вместе с тем отмечается, что в большинстве случаев продолжительность лечения не должна превышать восьми дней [C2]. Сывороточный уровень прокальцитонина и других биомаркеров может служить критерием, позволяющим уменьшить продолжительность терапии.
Лечение амбулаторных пациентов с ВП следует начинать с перорального приема АМП [А3]. Назначение антибиотиков внутрь (без предшествующего парентерального введения) возможно также и у части госпитализированных пациентов. В случае ступенчатой терапии переход на пероральный прием препарата возможен при стабилизации состояния пациента и улучшении клинической картины заболевания [А3].
Говоря о неантимикробной терапии ВП, эксперты отмечают целесообразность введения низкомолекулярного гепарина при развитии острой дыхательной недостаточности (ОДН) [А3], проведения неинвазивной вентиляции легких у части пациентов с ХОБЛ [В3] и при развитии острого респираторного дистресс-синдромома [А3], а также обращают внимание на неоправданность назначения в данной клинической ситуации ГКС [А3]. Ранняя мобилизация пациентов с ВП ассоциируется согласно результатам проведенных исследований с лучшими исходами заболевания [А3].
Рекомендации по эмпирической терапии аспирационной пневмонии представлены в табл. 7.
Основными критериями эффективности лечения являются снижение температуры тела, уменьшение признаков дыхательной недостаточности, стабилизация гемодинамики, изменение сывороточного уровня СРБ (повторное исследование целесообразно через 3–4 дня после начала терапии). Рентгенологические признаки пневмонии, обращают внимание эксперты, сохраняются более длительное время, чем клинические симптомы заболевания. Решение о выписке пациента из стационара следует принимать исходя из клинического состояния пациента [А3].
Авторы документа предлагают выделять два типа неэффективности АБТ при ВП [А3]:
1) неразрешающаяся пневмония. Отсутствие ответа на проводимую терапию в течение 72 часов после госпитализации обусловлено в большинстве случаев резистентностью возбудителей, их высокой вирулентностью или наличием у пациента иммунодефицитных состояний. Неэффективность лечения спустя 72 часа после госпитализации ассоциируется с развитием осложнений;
2) меденно разрешающаяся пневмония. В данной клинической ситуации, по мнению экспертов, прежде всего следует установить возможные факторы риска затяжного течения заболевания [C3].
Обострение ХОБЛ
В обсуждаемом документе сформулированы следующие показания для назначения АБТ у данной категории пациентов [А2]:
- обострение ХОБЛ I типа3;
- обострение ХОБЛ II типа4 (обязательным условием является наличие в качестве одного из двух основных критериев обострения гнойной мокроты);
- обострение ХОБЛ, требующее проведения неинвазивной или искусственной вентиляции легких (ИВЛ).
Авторы рекомендаций подчеркивают нецелесообразность назначения АБТ пациентам с обострением ХОБЛ II типа без гнойной мокроты и с обострением ХОБЛ III типа5 [А2].
Согласно результатам проведенных исследований ключевыми микроорганизмами, ответственными за развитие обострений ХОБЛ, остаются S. pneumonia и H. influenzae. Еще один респираторный патоген M. catarrhalis определяет возникновение не более 10% случаев обострений заболевания. Наличие тяжелой бронхиальной обструкции (объем форсированного выдоха за первую секунду (ОФВ1) < 50% от должных значений) ассоциируется с увеличением этиологической значимости грамотрицательных микроорганизмов (в том числе P. aeruginosa).
Микробиологическое исследование мокроты (или эндотрахеального аспирата в случае ИВЛ) согласно настоящим рекомендациям является обязательным методом исследования у госпитализированных пациентов с ХОБЛ [А3].
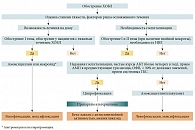
Определяя тактику ведения пациентов с обострением ХОБЛ, европейские эксперты предлагают следующую стратификацию [А3]:
1) группа А: госпитализированные пациенты без факторов риска P. aeruginosa-инфекции;
2) группа В: госпитализированные пациенты с факторами риска P. aeruginosa-инфекции.
Вероятность инфекции, обусловленной P. aeruginosa, высока, если присутствуют по меньшей мере два из указанных признаков [А3]:
- недавняя госпитализация;
- частые курсы АБТ (более четырех в год) / прием АМП в течение предшествующих трех месяцев;
- тяжелое течение заболевания (ОФВ1 < 30% от должных значений);
- прием ГКС внутрь (преднизолон > 10 мг/сут в течение двух недель).
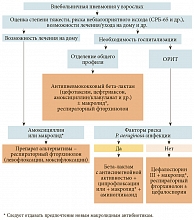
В качестве препарата выбора для лечения пациентов первой группы (без факторов риска P. aeruginosa-инфекции) авторы документа предлагают использовать амоксициллин/клавуланат. Препаратами альтернативы служат левофлоксацин и моксифлоксацин [А2].
Основным антибиотиком для лечения пациентов второй группы (с факторами риска P. aeruginosa-инфекции) остается ципрофлоксацин. В случае применения левофлоксацина режим дозирования препарата должен быть 750 мг один раз в сутки или 500 мг два раза в сутки. При необходимости парентерального введения антибиотиков может быть назначен бета-лактам с антисинегнойной активностью или аминогликозид [А2]. Путь введения препаратов определяет тяжесть состояния пациента. Переход с парентерального введения на пероральный прием антибиотика осуществляется при стабилизации состояния, как правило, на третий день терапии [А3].
В случае неэффективности проводимой АБТ следует:
- исключить неинфекционные причины обострения (декомпенсация сердечной недостаточности, ТЭЛА и др.), провести повторное микробиологическое исследование [С3];
- рассмотреть возможность назначения антибиотика, обладающего активностью в отношении неферментирующих бактерий (в том числе P. aeruginosa) и полирезистентных пневмококков [С3].
Обострение бронхоэктазов6
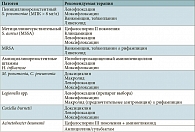
На страницах документа обсуждается также тактика ведения пациентов с обострением бронхоэктазов. Все пациенты данной категории, отмечают авторы рекомендаций, нуждаются в назначении антибиотиков [В3]. До начала лечения следует выполнить микробиологическое исследование мокроты [В3]. Выбор АМП в данной клинической ситуации определяет отсутствие/наличие у пациента факторов риска P. aeruginosa-инфекции. Модификация проводимой терапии осуществляется на основании результатов микробиологического исследования [А3].
Рекомендации по АБТ при обострении бронхоэктазов представлены в табл. 8.
Как свидетельствуют результаты проведенных исследований, длительная АБТ у пациентов с гнойными бронхоэктазами нецелесообразна [B2].
Использование ципрофлоксацина в комбинации с ингаляционным введением тобрамицина ассоциируется с лучшими результатами лечения.
В обобщенном виде рекомендации европейских экспертов по антибактериальной терапии ИНДП представлены в табл. 9.
Профилактика
Введение гриппозной вакцины с целью профилактики ИНДП рекомендовано при наличии высокого риска возникновения осложнений гриппа [А2].
Вакцинация показана:
- лицам ≥ 65 лет;
- лицам, проживающим в учреждениях закрытого типа;
- пациентам с хроническими бронхолегочными и сердечно-сосудистыми заболеваниями;
- лицам, страдающим сахарным диабетом, заболеваниями почек, гемоглобинопатиями;
- женщинам, которые будут находиться во 2-м или 3-м триместрах беременности во время сезонного подъема заболеваемости;
- медицинским работникам, осуществляющим лечение и уход за лицами, входящими в группы риска.
Авторы рекомендаций подчеркивают преимущество использования инактивированной вакцины [А1], а также отмечают, что повторные вакцинации не сопровождаются увеличением риска возникновения нежелательных явлений и снижением иммунного ответа [B1].
Введение пневмококковой вакцины согласно настоящим рекомендациям предусмотрено для пациентов, имеющих факторы риска развития пневмококковой инфекции [А1]. К таковым европейские эксперты относят [B3]:
- возраст > 65 лет;
- деменцию;
- нахождение в учреждениях закрытого типа;
- хронические заболевания нервной и сердечно-сосудистой систем, ХОБЛ, цереброваскулярные заболевания, сахарный диабет, хронические заболевания печени;
- функциональную или органическую асплению;
- пневмонию в анамнезе.
Пациентам с аспленией показана однократная ревакцинация, которая может быть выполнена не ранее чем через пять лет после первичной вакцинации. Кроме того, ревакцинация может быть показана пожилым пациентам, имеющим высокий риск возникновения пневмококковой инфекции [B3].
Согласно результатам контролируемых исследований такие методы профилактики, как вакцинация против H. influenzae, применение пероральных вакцин с инактивированными возбудителями, не подтвердили эффективность для предупреждения обострений у пациентов с хроническим бронхитом и ХОБЛ и соответственно не рекомендованы для применения по этим показаниям [В1].
Не рекомендовано для данной категории пациентов и профилактическое применение антибиотиков [А1]. В ходе контролируемых исследований не подтверждена эффективность ингаляционного введения тобрамицина и длительного использования макролидов для профилактики обострений ХОБЛ [C4]. Кроме того, не получено достаточных доказательств, подтверждающих эффективность профилактического использования тобрамицина и макролидных антибиотиков при бронхоэктазах без муковисцидоза [C2].
Использование ингаляционных ГКС [B1] и длительнодействующих бронхолитиков [C4], а также АБТ-инфекций верхних отделов респираторного тракта [А1] не предупреждает возникновения ИНДП. Отсутствуют доказательные данные, подтверждающие целесообразность профилактического применения физиотерапевтических методов лечения, гомеопатических средств [C4]. Назначение муколитиков в зимние месяцы показано пациентам с частыми обострениями ХОБЛ, не принимающим ингаляционные ГКС [B1]. Вместе с тем авторы документа не рекомендуют использовать этот метод профилактики обострений у пациентов с бронхоэктазами [B1].
На страницах документа обсуждается также возможность различных лекарственных препаратов влиять на частоту возникновения ИНДП. Эксперты отмечают, что, по имеющимся данным, статины и ингибиторы АПФ уменьшают риск возникновения ВП, а также риск летального исхода при данном заболевании. Ингаляционные ГКС у пациентов с ХОБЛ, снижая частоту обострений заболевания, не уменьшают риск возникновения ИНДП.
Заключение
Необходимость следовать клиническим рекомендациям, в том числе рекомендациям по ведению пациентов с ИНДП, в настоящее время не вызывает сомнений. Алгоритм врачебных действий позволяет избежать многих распространенных диагностических и лечебных ошибок и тем самым сократить сроки госпитализации, минимизировать стоимость лечения и самое главное – снизить летальность. Предлагаемый европейскими экспертами унифицированный подход к ведению пациентов, основанный на анализе современных доказательных данных, представляет несомненный интерес для врача, который сталкивается с такой полинозологической патологией, как ИНДП, и испытывает определенные трудности при проведении дифференциального диагноза и выборе лечебной тактики. В то же время существующие региональные различия в профиле устойчивости ключевых респираторных патогенов, особенности организации медицинской помощи и сложившаяся практика АБТ препятствуют безусловному заимствованию положений рекомендаций ERS/ESCMID специалистами отечественного здравоохранения.
Так, в качестве одного из препаратов выбора для лечения амбулаторных пациентов с ИНДП европейские эксперты рассматривают тетрациклин. Рекомендовать данный антибиотик в качестве препарата выбора или даже альтернативы для лечения респираторных инфекций в Российской Федерации не позволяет высокая частота выделения тетрациклинорезистентных штаммов S. pneumoniae [2]. Напротив, в отличие от ряда европейских стран в России активность в отношении пневмококка сохраняют макролидные антибиотики. В 2006–2009 гг. уровень резистентности S. pneumoniae к эритромицину не превышал 4,6%, азитромицину и кларитромицину – 7,3% [2]. Последние активны и в отношении H. influenzae. Невысокий уровень распространенности макролидорезистентных штаммов основных возбудителей ИНДП в России позволяет сохранять макролидам наряду с амоксициллином статус препаратов выбора при лечении нетяжелой ВП у амбулаторных пациентов без сопутствующих заболеваний и простого (неосложненного) обострения ХОБЛ [3, 4].
В алгоритме диагностики ВП [5], предлагаемом авторами документа, ключевая роль отводится определению уровня СРБ (рис. 1). В подавляющем большинстве отечественных амбулаторно-поликлинических учреждений данное исследование не выполняется и при подозрении на наличие заболевания проводится рентгенография органов грудной клетки.
Выбор антимикробной терапии при ИНДП, по мнению европейских экспертов, осуществляется исходя из места лечения пациентов (рис. 2 и 3). В амбулаторных условиях как при ВП, так и при обострении ХОБЛ, рекомендовано назначение амоксициллина, тетрациклина или макролидных антибиотиков. При их неэффективности следует использовать левофлоксацин или моксифлоксацин. В перечень возможных альтернатив для лечения амбулаторных пациентов не включен амоксициллин/клавуланат, который, как считают авторы документа, следует использовать в условиях стационара. У госпитализированных пациентов ингибиторозащищенный аминопенициллин рекомендован в качестве препарата выбора для лечения обострения ХОБЛ без факторов риска P. aeruginosa-инфекции (рис. 3) и наряду с другими антипневмококковыми бета-лактамами и респираторными фторхинолонами при ВП нетяжелого течения (рис. 2).
В отличие от европейских коллег российские эксперты предлагают более дифференцированный подход к назначению АМП у амбулаторных пациентов. Согласно современным отечественным рекомендациям, регламентирующим подходы к диагностике, лечению и профилактике ВП, применение амоксициллина или макролидов в амбулаторных условиях целесообразно лишь при отсутствии у пациентов факторов риска неблагоприятного исхода заболевания (предшествующая АБТ, сопутствующие заболевания). При наличии таковых следует назначить амоксициллин/клавуланат (возможно сочетание с макролидом) или респираторный фторхинолон [3]. Выбор АМП при обострении ХОБЛ, по мнению российских экспертов, определяется прежде всего наличием/отсутствием факторов риска осложненного обострения заболевания. При неосложненном обострении ХОБЛ рекомендовано назначение амоксицилина или современных макролидов (азитромицина, кларитромицина). В случае осложненного обострения ХОБЛ (без факторов риска P. aeruginosa-инфекции) существующие отечественные рекомендации, посвященные ведению пациентов данной категории, предусматривают назначение респираторных фторхинолонов или амоксициллина/клавуланата независимо от места лечения пациентов [4, 5].
Различным представляется мнение европейских и российских экспертов и о рубрикации ВП. В обсуждаемых рекомендациях ERS/ESCMID амбулаторные пациенты объединены в одну группу, что определяет унифицированный подход к назначению им АМП. Рубрикация ВП у госпитализированных пациентов выглядит следующим образом:
- ВП нетяжелого течения;
- ВП тяжелого течения без факторов риска P. aeruginosa-инфекции;
- ВП тяжелого течения c факторами риска P. aeruginosa-инфекции.
Тот же принцип – учет вероятной этиологической значимости P. aeruginosa – положен европейскими экспертами в основу рубрикации других ИНДП (обострение ХОБЛ, обострение бронхоэктазов).
Российские эксперты, учитывая различия в этиологической структуре, распространенности лекарственно-устойчивых штаммов респираторных патогенов и в прогнозе заболевания, выделяют следующие группы пациентов с ВП [3]:
- ВП нетяжелого течения у лиц без сопутствующих заболеваний, не принимавших за последние три месяца АМП ≥ 2 дней (возможно лечение в амбулаторных условиях);
- ВП нетяжелого течения у лиц c сопутствующими заболеваниями и/или принимавшими за последние три месяца АМП ≥ 2 дней (возможно лечение в амбулаторных условиях);
- ВП нетяжелого течения (лечение в условиях стационара: отделение общего профиля);
- ВП тяжелого течения (лечение в условиях стационара: ОРИТ).
Предлагаемая на страницах российских рекомендаций классификация пневмонии предусматривает выделение в отдельную группу пневмоний, связанных с оказанием медицинской помощи. Авторы обсуждаемого документа считают такое выделение нецелесообразным в силу отсутствия убедительных доказательств отличия структуры и профиля антибиотикорезистентности возбудителей данной группы пневмоний от таковых при ВП.
Тем не менее, несмотря на существующие различия, новые рекомендации ERS/ECMID, регламентирующие подходы к диагностике, лечению и профилактике такой широко распространенной патологии, как ИНДП у взрослых, являются весьма полезными и представляют большой интерес для российской врачебной общественности.







![Таблица 8. Антибактериальная терапия при обострении бронхоэктазов [С4]](/upload/resize_cache/iblock/41b/195_350_1/41b85ba73a68789d6248923c6b11eb10.jpg)