Возможности мультиспектральной фотометрии в диагностике атипичных меланоцитарных новообразований кожи
- Аннотация
- Статья
- Ссылки
- English
На сегодняшний день не существует достоверных высокочувствительных методов дооперационной диагностики атипичных меланоцитарных новообразований кожи. Перспективным направлением является лазерная аутофлуоресцентная спектроскопия. Данная методика основана на различиях в интенсивности и спектральном составе аутофлуоресцентного излучения нормальной и патологической ткани.
В клинических исследованиях продемонстрирована ее эффективность при выявлении опухолей различной локализации.
На сегодняшний день не существует достоверных высокочувствительных методов дооперационной диагностики атипичных меланоцитарных новообразований кожи. Перспективным направлением является лазерная аутофлуоресцентная спектроскопия. Данная методика основана на различиях в интенсивности и спектральном составе аутофлуоресцентного излучения нормальной и патологической ткани.
В клинических исследованиях продемонстрирована ее эффективность при выявлении опухолей различной локализации.

Введение
Неинвазивная и высокочувствительная дооперационная диагностика атипичных меланоцитарных новообразований кожи (МНК) представляет собой трудную задачу.
Повышенное внимание к меланоцитарной дисплазии главным образом объясняется склонностью к злокачественному перерождению. Частота встречаемости атипичных МНК широко варьируется и зависит от многих факторов. Одни авторы указывают на выявление меланоцитарной дисплазии у 5–10% здоровых лиц белой расы [1, 2]. Согласно данным других авторов, спорадический вариант диспластического меланоцитарного невуса встречается с частотой от 7–24 до 30–50% популяции [3–6]. Отмечено, что заболеваемость повышена в странах Северной Европы, особенно в Исландии, и достаточно низкая в Японии [6–11]. Атипичные невусы могут составлять от 5 до 17% гистологических диагнозов удаленных меланоцитарных новообразований кожи [12, 13].
На сегодняшний день проблемой является как сам факт сложности клинической диагностики атипичного невуса, так и отсутствие четких клинических критериев постановки диагноза [14–19]. Одна из главных трудностей связана с тем, что зачастую нет возможности отличить атипичный невус от меланомы, опираясь лишь на клинические и дерматоскопические данные. Применяемые для выявления меланомы методы, такие как ABCD-метод (А – асимметрия, В – неровность границ, С – неравномерность окраски, D – диаметр более 6 мм), CASH-метод (C – цвет, A – архитектура образования, S – симметричность, H – гомогенность), шкала Menzies, не являются высокочувствительными для диагностики атипичных меланоцитарных новообразований [20–22]. Клиническая картина диспластического невуса иногда имеет типичные признаки меланомы, а также может не отличаться от простых невусов, на что указывают многие авторы [7, 11, 23–25]. В крупном многоцентровом исследовании [7] у 716 пациентов были проанализированы плоские пигментные образования кожи, которые характеризовались средним и крупным размером (5 мм и более), в сочетании с хотя бы одним из признаков по ABC [26]. У 43% обследованных была диагностирована меланома, у 10% – диспластические невусы.
Отсутствие единых протоколов и клинических рекомендаций также определяет трудности в выборе оптимальной лечебной тактики при диспластических невусах [27].
Выявление гистологических признаков тяжелой меланоцитарной дисплазии в крае резекции пигментных новообразований кожи обусловливает необходимость проведения повторных операций по иссечению остаточной опухоли, что влечет за собой как нежелательные риски, связанные с повторными операциями на коже, так и возможные медико-юридические проблемы [28–30].
Профилактическое удаление всех пигментных образований кожи, имеющих клинические признаки диспластических невусов, нецелесообразно и не гарантирует снижения риска развития меланомы [7, 11, 16, 24].
Одним из наиболее частых вопросов, возникающих у клиницистов, диагностирующих диспластический невус, является целесообразность проведения гистологического исследования.
Суммируя изложенное, становится очевидной необходимость поиска способа достоверной дооперационной верификации диспластического невуса и его дифференциальной диагностики [16].
Перспективным направлением в диагностике новообразований различной локализации является лазерная аутофлуоресцентная спектроскопия (мультиспектральная фотометрия). Данная методика основана на различиях в интенсивности и спектральном составе аутофлуоресцентного излучения нормальной и патологической ткани [31–35]. Показано, что мультиспектральный анализ пигментных новообразований кожи с использованием лазерного излучения длиной волны возбуждения флуоресценции 632 нм и регистрацией реакции аутофлуоресценции в диапазоне 450–950 нм позволяет достоверно определить характер патологического процесса в тканях. Данный метод хорошо зарекомендовал себя при ранней диагностике метаплазии слизистой оболочки желудка и ободочной кишки, опухолей сетчатки, плевры, полости рта, а также ряда других заболеваний [36–39].
Цель и задачи исследования
Цель настоящего исследования – повысить результативность диагностики МНК путем определения дифференциально-диагностических критериев на основании показателей реакции аутофлуоресценции.
Для реализации данной цели были поставлены следующие задачи:
- провести аутофлуоресцентную диагностику пигментных новообразований кожи с оценкой кривой спектра и пиков флуоресценции для выявления атипичных меланоцитарных новообразований;
- сравнить данные, полученные при проведении мультиспектрального анализа, с патогистологическими данными удаленных пигментных новообразований;
- проанализировать отдаленные результаты наблюдения для оценки информативности аутофлуоресцентной диагностики и определения оптимальной лечебной тактики.
Материал и методы
Под наблюдением находились 177 пациентов европеоидной расы с пигментными новообразованиями кожи различной локализации. Их возраст варьировался от 19 до 77 лет. Средний возраст составил 48,5 ± 13,5 года. МНК чаще локализовались на спине и плечах, груди и животе.
В исследование включали лиц как со спорадическими невусами, так и с синдромом множественных невусов.
Из исследования исключали пациентов, у которых МНК были проявлениями различных клинических синдромов, таких как синдром множественных пигментных пятен, синдром Пейтца – Егерса, синдром Олбрайта, а также пациентов с новообразованиями, имеющими классические клинические и дерматоскопические признаки, такие как невус Шпица и голубой невус.
В исследование также не включали пациентов с локализацией меланоцитарных новообразований на коже головы, лица и шеи, поскольку на данных участках трудно добиться воздействия прямого пучка света. Кроме того, обилие сальных желез на лице, ввиду повышенного содержания в них протопорфирина, способно искажать картину аутофлуоресценции.
Все пациенты проходили комплексное обследование, включая диагностику генетически обусловленных заболеваний.
Мультиспектральному анализу подвергались только МНК размером 5 мм и более.
Мультиспектральный анализ МНК проводился с использованием лазерного излучения длиной волны возбуждения флуоресценции 632 нм и регистрацией реакции аутофлуоресценции в диапазоне 450–950 нм. Для этого применялся спектральный анализатор Викинг – Биоспек (Россия) с последующей обработкой данных с помощью специализированного программного обеспечения. Спектры были получены на различных длинах волн в диапазоне 450–950 нм с шагом 10 нм.
Исследование проводилось в амбулаторных условиях без предварительного введения фотосенсибилизирующих средств. Оценивались кривые спектров и пиков флуоресценции. Сравнивали также формы спектров, полученных от МНК и неизмененной кожи. Уровень аутофлуоресценции, полученный от неизмененной кожи, в среднем составлял 0,5 ± 0,05 и регистрировался в диапазоне 640–720 нм, что условно было принято за референсный показатель. В последующем выполнялись хирургическое удаление МНК и их гистологический анализ. К признакам меланоцитарных дисплазий относили наличие лимфоцитарного инфильтрата, выявление при гистологическом исследовании атипичных пролиферирующих меланоцитов, характеризующихся увеличением соотношения «ядро/цитоплазма», усилением окраски ядра и редкими фигурами митоза. Наличие атипии также подтверждалось экспрессией маркера меланоцитарной дифференцировки HMB-45 при проведении иммуногистохимического исследования.
В случае отказа пациента от хирургического удаления МНК проводилось динамическое наблюдение новообразований, в том числе с применением мультиспектрального анализа, как с целью своевременного выявления их злокачественного перерождения, так и с целью анализа отдаленных результатов наблюдения.
Методика проведения аутофлуоресцентной дерматоскопии представлена на рис. 1 и 2.
Результаты и их обсуждение
На основании оценки уровня аутофлуоресценции пациенты были распределены на три группы.
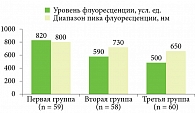
В первую группу вошли 59 человек с высоким уровнем аутофлуоресценции – 0,82 ± 0,05 усл. ед., получаемым от пигментных новообразований и регистрировавшимся в диапазоне 710–840 нм с пиком флуоресценции в диапазоне 790–810 нм. Вторую группу составили 58 пациентов, у которых отмечался менее высокий средний уровень аутофлуоресценции – 0,59 ± 0,05 усл. ед., пиковые значения определялись в диапазоне 720–740 нм. В третью группу вошли 60 пациентов, у которых средний уровень аутофлуоресценции не превышал пороговых значений и в среднем составлял 0,50 ± 0,05 усл. ед. в диапазоне 645–710 нм. Распределение пациентов по уровням аутофлуоресценции и пикам флуоресценции представлено на рис. 3.
Далее была проведена оценка результатов гистологического исследования. Из 59 пациентов первой группы 46 выполнено хирургическое удаление МНК и при гистологическом исследовании выявлены признаки меланоцитарной дисплазии (МД) умеренной и тяжелой степени – наличие лимфоцитарного инфильтрата, атипичных пролиферирующих меланоцитов, усиление окраски ядра, редкие фигуры митоза. 13 пациентов отказались от хирургического вмешательства. При динамическом наблюдении через 6 и 12 месяцев у них отмечался рост новообразований в среднем в полтора-два раза. Средний уровень аутофлуоресценции увеличился до 0,98 ± 0,05 усл. ед., что было на 16% больше исходного. В результате еще 10 пациентов дали согласие на хирургическое удаление новообразования. При гистологическом исследовании у них были выявлены признаки меланоцитарной дисплазии умеренной и тяжелой степени.
Из 58 пациентов второй группы МНК были удалены у 29. У 15 из них выявлены признаки МД умеренной и легкой степени. У 14 пациентов данных в пользу МД не получено. Оставшиеся 29 пациентов находились под динамическим наблюдением. Через 6 и 12 месяцев установлено, что размеры МНК значимо не изменялись, однако у 13 больных средний уровень аутофлуоресценции увеличился на 12% и составил 0,71 ± 0,05 усл. ед. Следует отметить, что у данных пациентов пигментные новообразования локализовались на участках кожи, подвергающихся частой травматизации и инсоляции.
Среди 60 включенных в третью группу пятерым было выполнено хирургическое удаление МНК по косметическим показаниям и при гистологическом исследовании данных за МД не получено. У 55 больных при динамическом наблюдении через 6 и 12 месяцев не отмечено достоверного роста размеров МНК и уровня аутофлуоресценции. Результаты патогистологического анализа и оценки уровней аутофлуоресценции представлены в таблице.
Исходя из результатов исследования, можно предложить следующие критерии выбора лечебной тактики: у пациентов с высоким уровнем аутофлуоресценции (0,82 усл. ед. и более) следует избегать выжидательной тактики. Им необходимо рекомендовать хирургическое удаление невусов ввиду высокой вероятности развития меланоцитарной дисплазии. У пациентов со средним уровнем аутофлуоресценции (от 0,59 до 0,71 усл. ед.) лечебная тактика будет зависеть от наличия или отсутствия дополнительных факторов риска, в частности от наличия пигментного образования в зоне частой травматизации или инсоляции. В отношении пациентов с низким уровнем аутофлуоресценции (до 0,50 усл. ед.) допустима выжидательная тактика в отсутствие признаков роста пигментного новообразования либо уровня аутофлуоресценции при динамическом наблюдении.
Заключение
Анализ спектров, полученных от пигментных новообразований кожи, продемонстрировал высокий уровень флуоресценции (0,82 ± 0,05 усл. ед. с пиком флуоресценции на уровне 790–810 нм) при наличии меланоцитарной дисплазии тяжелой степени, средний уровень флуоресценции (0,59 ± 0,05 усл. ед. с пиковыми значениями в диапазоне 720–740 нм) при наличии меланоцитарной дисплазии умеренной и легкой степени и низкий уровень флуоресценции (в среднем 0,50 ± 0,05 усл. ед. в диапазоне 645–710 нм) при отсутствии признаков меланоцитарной дисплазии. Данные результаты были подтверждены при проведении последующих гистологических исследований меланоцитарных новообразований в трех группах пациентов. Через 6 и 12 месяцев при повторном исследовании неудаленных пигментных новообразований в случае развития в них меланоцитарной дисплазии отмечался рост уровня флуоресценции, что также коррелировало с гистологическими данными.
Применение методов спектральной фотометрии на основе реакции аутофлуоресценции позволяет диагностировать развитие меланоцитарной дисплазии либо с определенной долей вероятности судить о ее отсутствии и таким образом избегать гипердиагностики и неоправданного хирургического вмешательства.
E.A. Krokhmaleva, Yu.N. Perlamutrov, MD, PhD, Prof., K.B. Olkhovskaya, PhD, A.A. Akopyan, PhD
A.I. Yevdokimov Moscow State University of Medicine and Dentistry
Contact person: Elizaveta A. Krokhmaleva, Liza_kroxa@bk.ru
Noninvasive and highly sensitive preoperative diagnosis of atypical melanocytic skin neoplasms is a difficult task. The interest in atypical melanocytic nevi is mainly due to their tendency to malignant degeneration.
The problem is both the fact of the complexity of the clinical diagnosis of atypical nevus, and the fact that the clinical criteria for making this diagnosis are not clearly defined today. To date, there are no reliable highly sensitive methods of preoperative diagnosis of atypical melanocytic skin neoplasms. Laser autofluorescence spectroscopy is a promising direction in the diagnosis of neoplasms of various localization. This technique is based on differences in the intensity and spectral composition of autofluorescence radiation of normal and pathological tissue. Clinical studies have demonstrated the effectiveness of the autofluorescence diagnostic method in detecting tumors of various localization.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.


