Антибиотик-ассоциированная диарея в поликлинической практике: оптимизация тактики ведения и прогнозирования течения
Авторами охарактеризованы особенности антибиотикассоциированной диареи (ААД), а также представлены данные исследований, касающихся профилактического применения пробиотиков. По мнению международных экспертов, такая стратегия позволяет добиться благоприятного течения ААД и минимизировать возможные побочные эффекты при приеме антибактериальных препаратов.


Сведения об авторах:
М.А. Осадчук, д.м.н., профессор, заслуженный деятель науки РФ, заведующий кафедрой и клиникой поликлинической терапии Института клинической медицины им. Н.В. Склифосовского ФГАОУ ВО Первый МГМУ им. И.М. Сеченова Минздрава РФ (Сеченовский Университет),
А.А. Свистунов, д.м.н., профессор, член-корреспондент РАН, первый проректор ФГАОУ ВО Первый МГМУ им. И.М. Сеченова Минздрава РФ (Сеченовский Университет)
Инфекция Clostridioides difficile (CDI), ранее известная как Clostridium difficile, является во всем мире ведущей причиной ААД, которая часто возникает во время или после лечения антибактериальными препаратами [1]. Ее частота варьирует от 5% до 25% в зависимости от типа используемого антибиотика [2, 3]. В последние годы отмечается дальнейший рост ААД, ассоциированный как с внебольничной, так и внутрибольничной инфекцией [4, 5]. Вместе с тем необходимо учитывать, что хотя инфекция C. difficile традиционно считается инфекцией, поражающей пациентов в медицинских учреждениях, она все чаще выявляется в сообществе среди лиц, которые в последнее время не госпитализировались или не находились в учреждениях длительного ухода [6, 7]. Только в 2011 г. в США CDI была причиной почти полумиллиона инфекций и привела примерно к 29 000 смертей [8]. CDI и связанные с ней госпитализации увеличились в 2000-х годах, в основном из-за появления эпидемического штамма риботипа 027 [9, 10]. Внедрение более чувствительных тестов C. difficile в конце 2000-х, таких как тесты амплификации нуклеиновых кислот (NAATs – nucleic acid amplification tests), привело к существенному увеличению числа больных инфекцией C. difficile [11, 12]. В Испании частота заболеваемости CDI, полученной в медицинских учреждениях, составляет 6,5 эпизода на 10 000 пациенто-дней госпитализации и 22,3 эпизода на 100 000 жителей [13]. В европейском исследовании EUCLID среднее число эпизодов CDI достигает 7 на 10 000 койко-дней, было подсчитано, что 23% случаев были пропущены [14]. Заслуживают особого внимания данные, свидетельствующие о том, что примерно у 25% пациентов с CDI она не диагностируется из-за использования нечувствительных диагностических тестов [15, 16]. Внутрибольничная CDI (HA-CDI – Hospital-acquired CDI) при ности пребывания в стационаре, что сопровождается значительными финансовыми затратами [17]. Так, только в 2015 г. общая годовая стоимость лечения CDI в США оценивалась примерно в 6 млрд долларов [18]. При этом следует подчеркнуть, что меняющаяся эпидемиология CDI, связанная с гипердиагностикой и чрезмерным лечением, а также растущие расходы системы здравоохранения США создали стимул для продолжения исследований в области выявления и лечения клинически значимой CDI.
Этиология и патогенез CDI
ААД определяется как диарея, развивающаяся с начала лечения антибиотиками до 6–8 нед. после его прекращения, в результате несоблюдения назначений противомикробных препаратов и при избыточном потреблении антибиотиков второго ряда [19]. Считается, что симптоматическая инфекция возникает из-за продукции C. difficile токсинов А и В, что приводит к повреждению эпителиального барьера посредством нарушения межклеточных плотных контактов [19]. Вместе с тем C. difficile вызывает изменение микробиоты кишечника, что позволяет спорам C. difficile размножаться в его слизистой оболочке. Текущее или недавнее (в течение 8 нед.) применение антибиотиков является одним из наиболее важных факторов риска CDI [18, 20]. Антибиотики, такие как клиндамицин, цефалоспорины третьего поколения, амоксициллин и фторхинолоны, существенно повышают риск развития CDI [21]. Использование антибиотиков увеличивает риск ААД как минимум в 8–10 раз в 1-й месяц и в 3 раза в последующие 2 мес. [20]. Внебольничная CDI (CA-CDI – Community-acquired CDI) также привлекла большое внимание в последнее десятилетие [22]. Заслуживают внимания данные о том, что почти 40% всех случаев CDI связаны с передачей внутри сообщества [20]. CA-CDI поражает более молодое население и тех, кто не подвергался воздействию антибиотиков. У таких пациентов имеется более низкий риск инфекций CDI [20].
Методы выявления C. difficile или его токсинов в контексте чувствительности и специфичности
Высокоэффективный метод, который может быть реализован в лабораториях, заключается в приеме только образцов диарейного стула и отбраковке образцов сформированного стула. Врачи редко подозревают CDI при отсутствии диареи. Поэтому диагноз CDI требует клинических проявлений и положительных лабораторных тестов на наличие C. difficile или его токсинов [17]. Вместе с тем точная диагностика CDI вызывает определенные трудности из-за разработки в последние годы множества тестов с различной чувствительностью, специфичностью и направленностью (бактерии, токсины, ферменты клеточных мембран, гены токсинов) [23, 24]. Более того, в эпоху молекулярного тестирования было идентифицировано несколько других токсигенных штаммов, таких как риботипы 078 и 244, с меняющейся чувствительностью к антибиотикам [25, 26]. Внедрение в клиническую практику высокочувствительных диагностических тестов для стратификации пациентов с подозрением на CDI позволяет избежать чрезмерного использования ресурсов и ненадлежащего лечения бессимптомных носителей / колонизаторов инфекции. Верификация инфекции C. difficile включает определение токсигенной культуры (TC – toxigenic culture), анализ нейтрализации цитотоксичности клеточной культуры (CCCNA – cell culture cytotoxicity neutralization assay), ферментативные иммунные анализы (EIA – enzyme immune assay) для токсина A и токсина B, тест амплификации нуклеиновых кислот (NAAT – nucleic acid amplification test) и тесты на глутаматдегидрогеназу (GDH – glutamate dehydrogenase) (табл. 1). Концепция комбинированного тестирования или многоступенчатого алгоритма была основным моментом недавно пересмотренных рекомендаций, опубликованных Американским обществом инфекционных заболеваний (IDSA – Infectious Diseases Society of America) и Американским обществом медицинской эпидемиологии (SHEA – Society for Healthcare Epidemiology of America) [6]. Многоэтапный алгоритм включает в себя комбинированное тестирование с тестом на GDH плюс EIA, NAAT плюс EIA или тест на GDH плюс NAAT в соответствии с заранее определенными критериями для тестирования образцов стула. Этот двухэтапный алгоритм также был поддержан Европейским обществом клинической микробиологии и инфекционных заболеваний (ESCMID – European Society of Clinical Microbiology and Infectious Diseases), было предложено использовать для скрининга тест на GDH или NAAT с последующим тестированием положительных образцов с помощью ИФА (EIA – enzyme immune assay) для подтверждения токсигенности присутствующих Clostridioides [27].
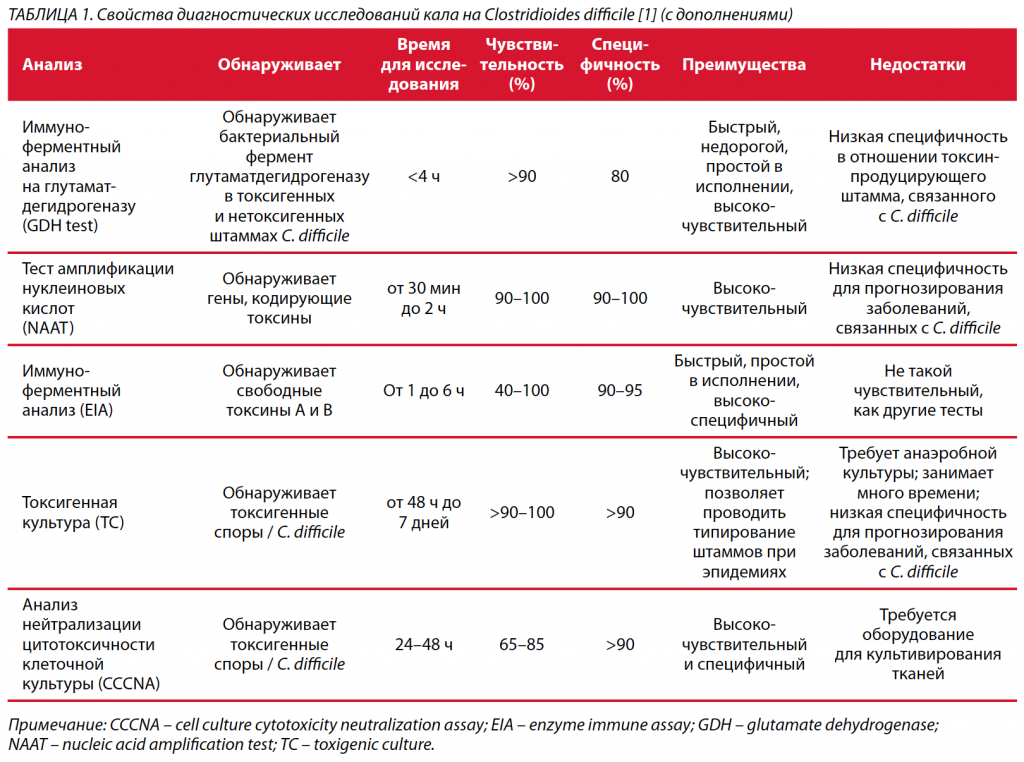
Возможности рутинной лабораторной и инструментальной диагностики CDI
Попытка использовать в качестве скрининга для диагностики и риска рецидива ААД фекальные биомаркеры, такие как фекальный кальпротектин и лактоферрин, не увенчалась успехом [28], хотя определялась достоверная корреляция с наличием и выраженностью воспаления [29, 30].
Проведение компьютерной томографии (КТ) органов брюшной полости у лиц с подозрением на CDI не рекомендуется из-за недостаточной чувствительности диагностического теста в 39% случаев [31]. Тем не менее пациентам со сложной клинической картиной, у которых при КТ брюшной полости обнаруживаются такие признаки, как утолщение стенки толстой кишки или отпечатки пальцев слизистой оболочки, с высокой степенью вероятности можно поставить диагноз CDI, данному контингенту необходимо проводить рациональную антибактериальную терапию [31]. При этом следует подчеркнуть, что колоноскопия для поиска псевдомембран и получения образца стула не является необходимой для постановки или подтверждения диагноза в большинстве эпизодов и может даже быть связана с повышенным риском осложнений [4]. Однако она может быть полезна в условиях ассоциированной патологии толстой кишки, неубедительных лабораторных анализов, при подозрении на наличие кишечной непроходимости, когда образец кала недоступен, или при остром ухудшении состояния для определения дальнейшей тактики ведения больного и необходимости срочного хирургического вмешательства [32]. О классическом псевдомембранозном колите сообщается примерно в половине случаев CDI, при которых проводится эндоскопия, что ограничивает использование этого метода исследования в качестве раннего теста для подтверждения CDI [32]. Вместе с тем гибкая ректороманоскопия без подготовки толстой кишки часто адекватна и показала свою эффективность для установления диагноза во многих случаях, когда тесты на токсины дают отрицательные результаты [33].
Классификация и клиника CDI
Существует несколько классификаций CDI, базирующихся на эпидемиологии и тяжести заболевания. IDSA/ SHEA классифицируют CDI на связанную с оказанием внутрибольничной медицинской помощи (начало заболевания на 4-й день госпитализации или после нее), ассоциированную с оказанием внебольничной медицинской помощи (начало заболевания в течение 4 нед. после выписки из медицинского учреждения) и внебольничное заболевание (спорадическая CDI или начало не менее чем через 4 нед. после выписки из больницы) [34]. Это проливает свет на сохраняющийся риск CDI у пациентов после выписки из стационара из-за подавленного иммунитета и длительного курса антибиотиков во время госпитализации. Несмотря на эту предложенную классификацию, лечение CDI чаще всего описывается в зависимости от тяжести и количества эпизодов [35]. Существует множество факторов, которые были изучены для прогнозирования ответа или неудачи лечения, риска рецидива и степени тяжести. Не существует валидированного критерия для оценки тяжести CDI при поступлении; однако наличие лихорадки (>38,5 C), количества лейкоцитов >15109/л и креатинина >1,5 мг/дл было связано с тяжелой или осложненной CDI [29] (табл. 2).
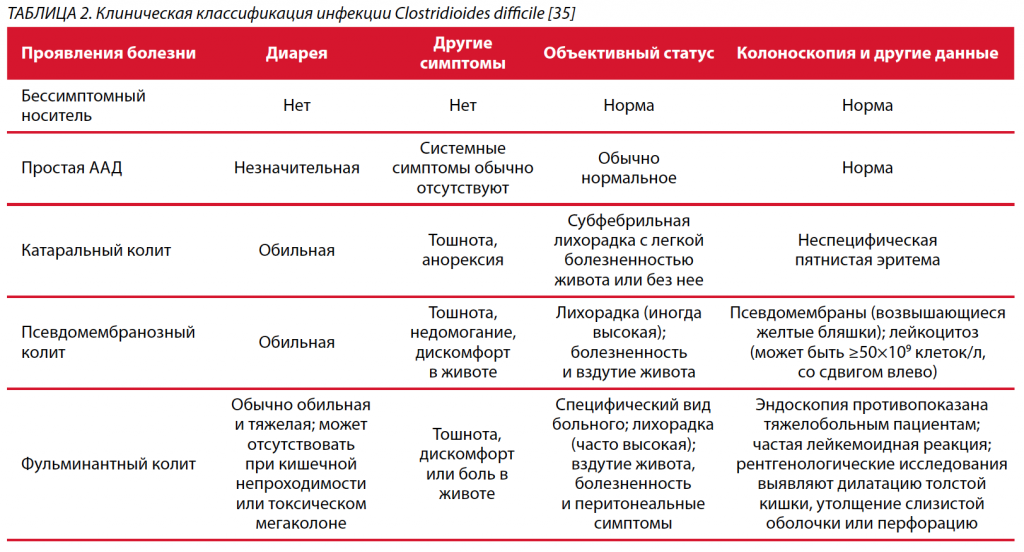
CDI следует подозревать при эпизодах диареи у пациентов любого возраста, с традиционными факторами риска CDI или без них. У некоторых больных может не быть диареи, как в случае толстокишечной непроходимости или необъяснимого лейкоцитоза, что затрудняет клиническую диагностику и увеличивает вероятность летального исхода [6]. F. Alasmari et al. приводят данные, что примерно 15% пациентов были колонизированы токсигенными C. difficile spp. на момент поступления в стационар [36]. J.H. Kwon et al. показали, что тщательный отбор пациентов на основании клинических проявлений необъяснимой водянистой диареи (Бристольская шкала стула – 6–7; по крайней мере три стула – от жидкого до водянистого в течение 24 ч), связанной с болью в животе или спазмами, и объективных данных может существенно повысить положительную прогностическую ценность тестов [37].
Первым шагом всегда должна быть всесторонняя оценка анамнеза для исключения другой этиологии диареи, включая применение слабительных средств в течение предшествующих 48 ч после появления симптомов, введение химиотерапевтических средств, использование энтерального питания, осуществление интраабдоминального хирургического вмешательства и наличие таких сопутствующих заболеваний, как язвенный колит, болезнь Крона, синдром раздраженного кишечника, и других неинфекционных причин [37, 38]. По данным ряда авторов, использование слабительных средств было отмечено у каждого пятого пациента, проходящего обследование на CDI в больнице [38, 39]. Исходы для пациента, инфицированного C. difficile, варьируют от бессимптомной колонизации до тяжелой диареи, которая может прогрессировать до токсического мегаколона, перфорации кишечника, септического шока и летального исхода [1]. Вместе с тем следует отметить, что в последние годы заболеваемость CDI в ряде стран имеет тенденцию к уменьшению. Это объясняется быстро снижающейся распространенностью гипервирулентного штамма BI/NAP1/027 [29, 40] и более рациональным использованием антибиотиков [29, 41].
Когда следует госпитализировать пациентов?
Пациенты должны быть госпитализированы при тяжелом течении заболевания, осложнениях или других обстоятельствах, при которых амбулаторное лечение невозможно: обезвоживание и непереносимость пероральных препаратов; признаки перитонита, токсического мегаколона, возможного сепсиса или других осложнений. Также следует госпитализировать пациентов с признаками или факторами риска тяжелого заболевания, такими как повышенный уровень креатинина, наличие лейкемоидной реакции или пожилой возраст. Госпитализация в реанимацию необходима для пациентов с тяжелым течением заболевания и нестабильным клиническим состоянием, таким как септический шок, токсический мегаколон, перитонит или тяжелая дегидратация с гипотензией или дисфункцией органов-мишеней [34].
Неблагоприятные прогностические критерии
Лейкоцитоз более 20109 клеток/л или уровень креатинина >176,8 мкмоль/л [>2,0 мг/дл] ассоциированы с 30-дневной смертностью 25,5% в ретроспективном исследовании 1721 пациента с задокументированной инфекцией C. difficile [42]. Ретроспективное обсервационное когортное исследование пациентов, находящихся в отделениях интенсивной терапии по поводу инфекции C. difficile, показало, что уровень лактата, равный или более 5 ммоль/л, является независимым предиктором 30-дневной смертности [43].
Факторы, определяющие рецидивирующее течение CDI, включают возраст ≥65 лет, продолжительное использование антибиотиков, тяжелый начальный приступ CDI и подавление продукции соляной кислоты [44].
Лечение CDI
Целью лечения является разрешение диареи и предотвращение рецидива CDI. Базовый подход к терапии пациентов с CDI включает: восполнение жидкости и электролитов, отмену ингибиторов перистальтики кишечника, антикислотных и антибактериальных препаратов, которые могли явиться причиной заболевания или возникших осложнений [4]. Не вызывает сомнения тот факт, что рациональное использование антибиотиков и меры инфекционного контроля (например, гигиена рук) являются наиболее рентабельными методами, значительно снижающими частоту возникновения CDI и ее рецидивов [41].
Поддерживающие меры, такие как регидратация и коррекция дисбаланса электролитов, должны применяться у всех пациентов с диагнозом CDI. С введением более чувствительных анализов на наличие C. difficile, таких как NAATs, выявляется больше случаев CDI, из которых не все требуют лечения [13]. Сведение к минимуму ненужного воздействия антибиотиков и быстрое прекращение их приема играют ключевую роль в лечении CDI (табл. 3). Эмпирическая антибактериальная терапия считается нецелесообразной при подозрении на CDI, за исключением молниеносной CDI и случаев, когда выполнение диагностических исследований носит затруднительный характер [45]. Эмпирическая терапия также увеличивает риск ложноотрицательных результатов полимеразной цепной реакции на предварительно обработанных образцах кала.

Метронидазол долгое время был рекомендуемым в качестве начальной терапии CDI. Однако в последних рекомендациях IDSA/SHEA, опубликованных в 2018 г., метронидазол заменен на ванкомицин (125 мг перорально 4 р./сут в течение 10 дней) или фидаксомицин (200 мг перорально 2 р./сут в течение 10 дней) в качестве препаратов первой линии [29]. Это было важным решением, подкрепленным убедительными клиническими данными. Применение метронидазола должно быть ограничено ситуациями, в которых ванкомицин или фидаксомицин противопоказан или пероральное введение невозможно.
Фидаксомицин получил признание в качестве стандарта лечения начальных эпизодов CDI после того, как два рандомизированных двойных слепых исследования III фазы продемонстрировали не меньшую эффективность фидаксомицина по сравнению с ванкомицином, с устойчивым уровнем клинического излечения от 88% до 92% и более низкой частотой рецидивов [46]. Более низкая частота рецидивов была связана с более целенаправленной активностью и специфичностью фидаксомицина в отношении CDI по сравнению с ванкомицином. После публикации руководящего документа ESCMID, в котором фидаксомицин было рекомендовано применять у пациентов с рецидивирующей CDI, опубликованный метаанализ и сравнительное исследование показали, что фидаксомицин можно рассматривать в качестве терапии первой линии у пациентов с CDI и высоким риском рецидива [47]. В связи с этим недавно опубликованные рекомендации IDSA предлагают ванкомицин или фидаксомицин в качестве базовой терапии начальной CDI в первичном звене здравоохранения [48]. Новые опубликованные данные продемонстрировали, что у пациентов, получавших безлотоксумаб, содержащий полностью человеческие моноклональные антитела, специфичные к токсину B CDI, плюс лечение антибиотиками, направленное против данной инфекции, приводили к снижению рецидива rCDI на 40% через 12 нед. [24]. В двух глобальных исследованиях III фазы (MODIFY I и MODIFY II) безлотоксумаб продемонстрировал значительное снижение частоты рецидивов CDI по сравнению с плацебо (17% против 28% в MODIFY I и 16% против 26% в MODIFY II; р<0,001) у взрослых, получающих лечение антибиотиками по поводу первичной CDI или rCDI [49]. К сожалению, последние клинические рекомендации IDSA, включающие 53 терапевтические рекомендации, не содержат показаний по применению безлотоксумаба в клинической практике [50].
Комбинированная терапия (например, ванкомицин и метронидазол) не рекомендуется пациентам с тяжелой CDI, за исключением случаев, осложненных кишечной непроходимостью [4]. Данные литературы свидетельствуют о том, что рифаксимин, нитазоксамид, фузидиевая кислота, тигециклин и тейкопланин в настоящее время не рассматриваются в качестве вариантов терапии CDI, тем более что новые методы лечения и стратегии rCDI снижают риск рецидива [4].
Одним из основных препятствий в лечении CDI является рецидив, который определяется как повторное появление симптомов с положительным диагностическим тестом в течение 2–8 нед. после первого эпизода CDI. Статистические данные свидетельствуют о том, что примерно у четверти пациентов, особенно при лечении метронидазолом или ванкомицином, возможен рецидив заболевания [42]. При этом следует учитывать, что у этой группы больных смертность увеличивается на 33% по сравнению с теми, у кого был только один эпизод CDI [51]. Были получены данные, что рецидив CDI в 75–85% случаев связан с ранее леченным штаммом и в 15–25% случаев с новым штаммом из-за сохраняющихся факторов риска [52]. Однако как в том, так и в другом случае проводится однотипная медикаментозная терапия.
Начальное лечение тяжелой CDI включает ванкомицин 125 мг перорально 4 р./сут в течение 10 дней или фидаксомицин 200 мг перорально 2 р./сут в течение 10 дней [1, 29]. Разрушение слизистой оболочки при тяжелом заболевании может вызвать системную абсорбцию ванкомицина, поэтому у пациентов с почечной недостаточностью следует контролировать уровень ванкомицина в сыворотке [27].
Трансплантация фекальной микробиоты (FMT – Fecal microbiota transplantation) была предложена в качестве терапии первой линии для тяжелых случаев CDI. Ретроспективное когортное исследование 111 пациентов, проведенное Hocquart et al., констатирует значительное улучшение выживаемости при тяжелой CDI (отношение шансов 0,08; р=0,001) и указывает на необходимость дальнейших исследований в поддержку FMT в качестве лечения первой линии [53]. Кроме этого, FMT является одним из наиболее эффективных способов профилактики рецидива CDI и должна быть предложена пациентам с множественными рецидивами, особенно тем, у которых был неэффективен цикл постепенного введения перорального ванкомицина или фидаксомицина. Однако следует подчеркнуть, что применение FMT недоступно в большинстве лечебных учреждений и вызывает опасения, связанные с выбором безопасной дозы и наличием потенциальной угрозы передачи неизвестных в настоящее время микроорганизмов [54, 55]. В последнее время проводятся исследования, которые предполагают профилактику CDI с помощью вакцинации [56] или антибиотиков.
Фульминантная CDI определяется как инфекция, осложненная гипотензией, шоком, кишечной непроходимостью или мегаколоном. Ранняя диагностика и лечение имеют важное значение, так как заболевание может быстро прогрессировать и имеет высокий уровень смертности, достигающий 44% [57]. Антибиотикотерапия молниеносной CDI состоит из энтерального введения ванкомицина по 500 мг (перорально или через назогастральный зонд) 4 р./сут и парентерального введения метронидазола по 500 мг каждые 8 ч. В случаях кишечной непроходимости ректальный ванкомицин можно вводить через клизму с осторожностью из-за риска перфорации толстой кишки (500 мг в 100 мл физиологического раствора в прямую кишку, оставлять как можно дольше и вводить каждые 6 ч) [1, 29].
У пациентов с нормальным стулом или при наличии легкой диареи с нормальными или почти нормальными значениями лейкоцитов и креатинина, не имеющих тяжелого заболевания или осложнений, антибактериальная терапия может быть прекращена. Однако данный контингент больных должен наблюдаться в течение нескольких дней, чтобы определить, не ухудшается ли их состояние [34].
Пациентов с тяжелой осложненной или молниеносной CDI, отсутствием эффекта проводимой медикаментозной терапии в течение первых 24–48 ч и повышенным уровнем лактата (≥2,2 ммоль/л) или числа лейкоцитов (≥20 000) должен осмотреть хирург [43]. В настоящее время рекомендуемой операцией при инфекции C. difficile является субтотальная колэктомия. Альтернативной, менее инвазивной процедурой, позволяющей сохранить толстую кишку, является петлевая илеостомия с антеградным промыванием ванкомицином [29]. Систематический обзор 1433 пациентов, перенесших экстренную операцию по поводу CDI, показал, что самыми надежными предикторами послеоперационной смертности являются предоперационная интубация, острая почечная недостаточность, полиорганная недостаточность и шок, требующий применения вазопрессоров [59]. Тотальная колэктомия с концевой илеостомой демонстрировала самые низкие показатели смертности и повторных операций [59].
Использование пробиотиков в терапии и профилактике инфекции C. difficile
ААД возникает тогда, когда антибиотик нарушает экологию кишечной микробиоты, изменяя разнообразие и количество бактерий в кишечнике. Эти изменения влияют на способность резидентной микробиоты противостоять инвазии патогенных микроорганизмов [60] или чрезмерному росту условно-патогенных микроорганизмов, эндогенно присутствующих в микробиоте [61]. Поэтому даже после восстановления общего числа бактерий может наблюдаться длительный дисбаланс кишечной микробиоты, который существенно снижает восприимчивость пациента к инфекциям и другим заболеваниям. В связи с этим профилактика инфекции C. difficile является национальным приоритетом, поскольку усилия по повышению ее качества и рациональному использованию антибиотиков продолжают расширяться в сфере здравоохранения и на государственном уровне [62].
Группа экспертов, созданная Международной научной ассоциацией пробиотиков и пребиотиков (ISAPP – International Scientific Association for Probiotics and Prebiotics) совместно с Продовольственной и сельскохозяйственной организацией ООН (FAO – Food and Agriculture Organization) / ВОЗ, определила пробиотики как живые микроорганизмы, которые при введении в достаточных количествах приносят пользу для здоровья хозяина [63]. Наиболее эффективные пробиотики включают такие виды бактерий, как Lactobacillus и Bifidobacterium, и виды дрожжей Saccharomyces [64].
Кохрейновское исследование, включающее 82 работы из разных стран мира с общим количеством пациентов 12 127, из которых 17 были опубликованы в 1980-х и 1990-х гг., 28 – в период с 2000 по 2009 г. и 37 – в период с 2010 по 2019 г., свидетельствует о том, что пробиотики не показали достаточную эффективность в монотерапии острой инфекционной диареи [65]. Поэтому их используют в основном в терапии в комбинации с антибактериальными препаратами или с целью профилактики острой инфекционной диареи. Вместе с тем до настоящего времени отсутствуют национальные рекомендации по использованию пробиотиков для предотвращения инфекции, вызванной C. difficile, у пациентов, получающих антибиотики. Поэтому на данном этапе развития клинической медицины постоянно обсуждаются вопросы о настоятельной необходимости использования пробиотиков в профилактике и терапии ААД. Так, ряд метаанализов свидетельствует о том, что краткосрочное использование пробиотиков может быть безопасным и эффективным средством профилактики ААД для пациентов, у которых нет иммунодефицита или тяжелого истощения [66]. В связи с этим проводятся обширные исследования для изучения потенциальной роли пробиотиков в регулировании дисбактериоза кишечника, который, в свою очередь, предрасполагает к развитию CDI. До недавнего времени традиционно имелось ограниченное количество данных, подтверждающих эффективность пробиотиков в профилактике и лечении CDI. В недавнем метаанализе N.T. Shen et al. оценили 19 рандомизированных контролируемых испытаний, включавших 6261 госпитализированного пациента, им в дополнение к антибиотикам назначались препараты, содержащие Saccharomyces boulardii, Lactobacillus spp., Bifidobacterium spp. и Streptococcus spp., отдельно или в различных комбинациях, с целью предотвращения развития CDI. Исследование продемонстрировало многообещающие результаты с более чем 50% снижением частоты CDI у пациентов, одновременно с антибиотиками получавших пробиотики [67].
В литературе приводятся данные метаанализа по профилактическому приему пробиотиков в ходе постспециального анализа [67]. Авторы разделили всех пациентов на три группы в зависимости от степени базового риска развития ААД: низкий (0–10%; 7 исследований), умеренный (11–30%; 21 исследование) и высокий (>31%; 14 исследований). При низком риске не было получено достоверных различий в группах, получающих пробиотики и не получающих. В противоположность сказанному, среди участников с умеренным или исходно высоким уровнем риска развития ААД были продемонстрированы статистически значимые результаты по эффективности профилактического приема пробиотиков: при умеренном риске – 39% (RR=0,61 (95% CI 0,48 до 0,78), р<0,0001), при высоком – 45% (RR=0,55 (95% CI от 0,46 до 0,66), р<0,00001) [68]. В ряде работ приводятся данные о наличии универсального защитного эффекта пробиотиков при проведении антибактериальной терапии (RR=0,65 (95% CI 0,54–0,78), р<0,00001) [69, 70]. При этом ни в одном из включенных исследований не сообщалось о серьезных побочных эффектах [68–70].
Особого внимания заслуживает метаанализ специалистов из Нидерландов, выполненный на основе 32 исследований [71]. Авторами были выявлены следующие штаммы, удовлетворяющие критериям рекомендации: Lactobacillus rhamnosus GG с минимальной суточной дозой 2109 КОЕ, дацию три звезды, так как она связана со значительным снижением частоты ААД [72–74]. Кроме того, состав с несколькими штаммами Lactobacillus rhamnosus GG, Lactobacillus acidophilus LA-5, Bifidobacterium lactis BB-12 (ldt pdtpls) продемонстрировал значительный эффект в снижении AAД в 2 из выбранных исследований [75]. На основании полученных данных авторы метаанализа пришли к выводу, что имеется достаточно убедительных доказательств, чтобы рекомендовать использование пробиотического штамма Lactobacillus rhamnosus GG для профилактики ААД [71].
Впечатляющие результаты были достигнуты при использовании мультиштаммового пробиотика, содержащего Lactobacillus rhamnosus Rosell + Lactobacillus acidophilus Rosell), при ААД. Проведенные исследования по терапии ААД указанным пробиотиком, содержащим Lactobacillus Rosell-52 и Lactobacillus Rosell-11, продемонстрировали его способность уменьшать или нивелировать диарею и способствовать элиминации клостридиального токсина в кале детей [76].
На отечественном рынке представлен пробиотик Примадофилус® Бифидусс, содержащий наиболее эффективные пробиотические штаммы микроорганизмов, такие как Bifidobacterium longum, Bifidobacterium breve, Lactobacillus rhamnosus и Lactobacillus acidophilus. Представленный состав микрофлоры дает основание рассчитывать на положительный эффект Примадофилус® Бифидус в терапии и профилактике ААД (включая CDI) при его использовании в течение 2–3 нед. с последующими повторными курсами через 2–3 мес. для оптимизации результатов восстановления кишечного микробиома.
Выводы
Ограничение применения антибиотиков является жизненно важной мерой для контроля CDI. Все медицинские учреждения должны внедрить программу управления противомикробными препаратами, которая включает минимизацию частоты, продолжительности и количества антибиотиков, когда это возможно. Ванкомицин и фидаксомицин являются экономически эффективными препаратами для лечения начального эпизода CDI и предотвращения рецидивов. Трансплантацию фекальной микробиоты следует настоятельно рассматривать при лечении рецидивирующей инфекции Clostridioides difficile рCDI (после второго рецидива (третьего эпизода)). Роль безлотоксумаба и других новых методов лечения нуждается в дальнейшем изучении. Сочетание антибактериальных препаратов с пробиотиками, в частности Примадофилус Бифидус, является важным фактором благоприятного течения ААД с минимизацией возможных побочных эффектов. Профилактическое назначение пробиотиков при приеме антибактериальных средств существенно снижает вероятность развития инфекции Clostridioides difficile.
Источники информации
1. Khurana S., Kahl А., Yu К., DuPont A.W. Recent advances in the treatment of Clostridioides difficile infection: the ever-changing guidelines. Fac Rev. 2020;9:13. Published online 2020 Nov 18.
2. Eckert C., Emirian A., Le Monnier A. et al. Prevalence and pathogenicity of binary toxin–positive Clostridium difficile strains that do not produce toxins A and B New microbes and new infections. 2015;3:12–17.
3. Motamedi Н., Fathollahi М., Abiri R. et al. A worldwide systematic review and meta-analysis of bacteria related to antibiotic-associated diarrhea in hospitalized patients. PLoS One. 2021;16(12):e0260667. Published online 2021 Dec 8.
4. Bouza Е., Aguado J.M., Alcal L. et al. Recommendations for the diagnosis and treatment of Clostridioides difficile infection: An official clinical practice guideline of the Spanish Society of Chemotherapy (SEQ), Spanish Society of Internal Medicine (SEMI) and the working group of Postoperative Infection of the Spanish Society of Anesthesia and Reanimation (SEDAR). Rev Esp Quimioter. 2020;33(2):151–175. Published online 2020 Feb 20.
5. Осадчук М.А., Свистунов А.А. Антибиотико-ассоциированная диарея в клинической практике. Вопросы современной педиатрии. 2014;13(1):102–108.
6. Chitnis A.S., Holzbauer S.M., Belflower R.M. et al. Epidemiology of community-associated Clostridium difficile infection, 2009 through 2011. JAMA Intern Med. 2013;173:1359–1367.
7. Gerding D.N., Lessa F.C. The epidemiology of Clostridium difficile infection inside and outside health care institutions. Infect Dis Clin North Am. 2015;29:37–50.
8. Lessa F.C., Mu Y., Bamberg W.M. et al. Burden of Clostridium difficile infection in the United States. N Engl J Med. 2015;372(9):825–834.
9. Loo V.G., Poirier L., Miller M.A. et al. A predominantly clonal multi-institutional outbreak of Clostridium difficile–associated diarrhea with high morbidity and mortality. N Engl J Med. 2005;353:2442–2449.
10. McDonald L.C., Killgore G.E., Thompson A. et al. An epidemic, toxin gene-variant strain of Clostridium difficile. N Engl J Med. 2005;353:2433–2441.
11. Gould C.V., Edwards J.R., Cohen J. et al. Effect of nucleic acid amplification testing on populationbased incidence rates of Clostridium difficile infection. Clin Infect Dis. 2013;57:1304–1307.
12. Moehring R.W., Lofgren E.T., Anderson D.J. Impact of change to molecular testing for Clostridium difficile infection on healthcare facility-associated incidence rates. Infect Control Hosp Epidemiol. 2013;34:1055–1061.
13. Riggs M.M., Sethi A.K., Zabarsky T.F. et al. Asymptomatic carriers are a potential source for transmission of epidemic and nonepidemic Clostridium difficile strains among long-term care facility residents. Clin Infect Dis. 2007;45(8):992–998.
14. Davies K.A., Longshaw C.M., Davis G.L. et al. Underdiagnosis of Clostridium difficile across Europe: the Eu-ropean, multicentre, prospective, biannual, point-prevalence stu-dy of Clostridium difficile infection in hospitalised patients with diarrhoea (EUCLID). Lancet Infect Dis. 2014;14(12):1208–1219.
15. Alcala L., Reigadas E., Marin M. et al. Impact of clinical awareness and diagnostic tests on the underdiagnosis of Clostridium difficile infection. Eur J Clin Microbiol Infect Dis. 2015;34(8):1515–1525.
16. Rodriguez-Pardo D., Almirante B., Bartolome R.M. et al. Epidemiology of Clostridium difficile infection and risk factors for unfavorable clinical outcomes: results of a hospital-based study in Barcelona, Spain. J Clin Microbiol. 2013;51(5):1465–1473.
17. Peng Z., Ling L., Stratton C.W. et al. Advances in the diagnosis and treatment of Clostridium difficile infections. Emerg Microbes Infect. 2018;7(1):15.
18. Zhang S., Palazuelos-Munoz S., Balsells E.M. et al. Cost of hospital management of Clostridium difficile infection in United States-a meta-analysis and modelling study. BMC Infect Dis. 2016;16(1):447.
19. Rupnik M., Wilcox M.H., Gerding D.N. Clostridium difficile infection: new developments in epidemiology and pathogenesis. Nat Rev Microbiol. 2009;7(7):526–536.
20. Khanna S., Pardi D.S., Aronson S.L. et al. The epidemiology of community-acquired Clostridium difficile infection: a population-based study. Am J Gastroenterol. 2012;107(1):89–95.
21. Lee H.Y., Hsiao H.L., Chia C.Y. et al. Risk factors and outcomes of Clostridium difficile infection in hospitalized patients. Biomed J. 2019;42(2):99–106.
22. Ofori E., Ramai D., Dhawan M. et al. Communityacquired Clostridium difficile: epidemiology, ribotype, risk factors, hospital and intensive care unit outcomes, and current and emerging therapies. J Hosp Infect. 2018;99(4):436–442.
23. Alcala-Hernandez L., Mena-Ribas A., Niubo-Bosh J., Marin-Arriaza M. Laboratory diagnosis of Clostridium difficile infection. Enferm Infecc Microbiol Clin. 2016;34(9):595–602.
24. Wilcox M., Dorr M.B., Pedley A. Bezlotoxumab and Recurrent Clostri-dium difficile Infection. N Engl J Med. 2017;376(16):1594–1596.
25. Lim S.K., Stuart R.L., Mackin K.E. et al. Emergence of a ribotype 244 strain of Clostridium difficile associated with severe disease and related to the epidemic ribotype 027 strain. Clin Infect Dis. 2014;58(12):1723–1730.
26. De Almeida M.N., Heffernan H., Dervan A. et al. Severe Clostridium difficile infection in New Zealand associated with an emerging strain, PCR-ribotype 244. N Z Med J. 2013;126(1380):9–14.
27. Hocquart M., Lagier J.C., Cassir N. et al. Early Fecal Microbiota Transplantation Improves Survival in Severe Clostridium difficile Infections. Clin Infect Dis. 2018;66(5):645–650.
28. Boone J.H., DiPersio J.R., Tan M.J. et al. Elevated lactoferrin is associated with moderate to severe Clostridium difficile disease, stool toxin, and 027 infection. Eur J Clin Microbiol Infect Dis. 2013;32(12):1517–1523.
29. McDonald L.C., Gerding D.N., Johnson S. et al. Clinical Practice Guidelines for Clostridium difficile Infection in Adults and Children: 2017 Update by the Infectious Diseases Society of America (IDSA) and Society for Healthcare Epidemiology of America (SHEA). Clin Infect Dis. 2018;66(7):e1–e48.
30. He T., Kaplan S.E., Gomez L.A. et al. Fecal calprotectin concentrations in cancer patients with Clostridium difficile infection. Eur J Clin Microbiol Infect Dis. 2018;37(12):2341–2346.
31. Kirkpatrick I.D.C., Greenberg H.M. Evaluating the CT diagnosis of Clostridium difficile colitis: should CT guide therapy? AJR Am J Roentgenol. 2001;176(3):635–639.
32. Burkart N.E., Kwaan M.R., Shepela C. et al. Indications and Relative Utility of Lower Endoscopy in the Management of Clostridium difficile Infection. Gastroenterol Res Pract. 2011;2011:626582.
33. Johal S.S., Hammond J., Solomon K. et al. Clostridium difficile associated diarrhoea in hospitalised patients: onset in the community and hospital and role of flexible sigmoidoscopy. Gut. 2004;53:673–677.
34. Guh A.Y., Kutty Р.К. Clostridioides difficile Infection. Ann Intern Med. 2018;169(7):ITC49–ITC64.
35. P pin J., Valiquette L., Gagnon S. et al. Outcomes of Clostridium difficile-Associated Disease Treated With Metronidazole or Vancomycin Before and After the Emergence of NAP1/027. Am J Gastroenterol. 2007;102(12):2781–2788.
36. Alasmari F., Seiler S.M., Hink T. et al. Prevalence and risk factors for asymptomatic Clostridium difficile carriage. Clin Infect Dis. 2014;59(2):216–222.
37. Kwon J.H., Reske K.A., Hink T. et al. Evaluation of Correlation between Pretest Probability for Clostridium difficile Infection and Clostridium difficile Enzyme Immunoassay Results. J Clin Microbiol. 2017;55(2):596–605.
38. Buckel W.R., Avdic E., Carroll K.C. et al. Gut check: Clostridium difficile testing and treatment in the molecular testing era. Infect Control Hosp Epidemiol. 2015;36(2):217–221.
39. Dubberke E.R., Han Z., Bobo L. et al. Impact of clinical symptoms on interpretation of diagnostic assays for Clostridium difficile infections. J Clin Microbiol. 2011;49(8):2887–2893.
40. Avila M.B., Avila N.P., Dupont A.W. Recent Advances in the Diagnosis and Treatment of Clostridium Difficile Infection [version 1; peer review: 3 approved]. F1000Res. 2016;5:F1000 Faculty Rev-118.
41. Baur D., Gladstone B.P., Burkert F. et al. Effect of antibiotic stewardship on the incidence of infection and colonisation with antibiotic-resistant bacteria and Clostridium difficile infection: a systematic review and meta-analysis. Lancet Infect Dis.2017;17(9):990–1001.
42. P pin J., Valiquette L., Alary M.E. et al. Clostridium difficile-associated diarrhea in a region of Quebec from 1991 to 2003: a changing pattern of disease severity. CMAJ. 2004;171:466–472.
43. Lamontagne F., Labb A.C., Haeck O. et al. Impact of emergency colectomy on survival of patients with fulminant Clostridium difficile colitis during an epidemic caused by a hypervirulent strain. Ann Surg. 2007;245:267–272.
44. Tariq R., Singh S., Gupta A. et al. Association of Gastric Acid Suppression With Recurrent Clostridium difficile Infection: A Systematic Review and Meta-analysis. JAMA Intern Med. 2017;177(6):784–791.
45. Al-Nassir W.N., Sethi A.K., Li Y. et al. Both oral metronidazole and oral vancomycin promote persistent overgrowth of vancomycin-resistant enterococci during treatment of Clostridium difficile-associated disease. Antimicrob Agents Chemother. 2008;52(7):2403–2406
46. Mc Knorr J.P., Javed I., Sahni N. et al. Metronidazole- Induced Encephalopathy in a Patient with End-Stage Liver Disease. Case Reports Hepatol. 2012;2012:209258.
47. Nathwani D., Cornely O.A., Van Engen A.K. et al. Cost-effectiveness analysis of fidaxomicin versus van-comycin in Clostridium difficile infection. J Antimicrob Chemother. 2014;69(11):2901–2912.
48. Dubberke E.R., Gerding D.N. et al. Efficacy of Bezlotoxumab in Participants Receiving Metronidazole, Vancomycin, or Fidaxomicin for Treatment of Clostridioides (Clostridium) difficile Infection. Open Forum Infect Dis. 2020;7(6):ofaa157. Published online 2020 Jun 2.
49. Clinical Practice Guidelines for Clostridium difficile Infec-tion in Adults and Children: 2017 Update by the Infectious Diseases Society of America (IDSA) and Society for Healthcare Epidemio-logy of America (SHEA). Clin Infect Dis. 2018;66(7):987– 994.
50. Olsen M.A., Yan Y., Reske K.A. et al. Recurrent Clostridium difficile infection is associated with increased mortality. Clin Microbiol Infect. 2015;21(2):164–170.
51. Sim J.H.C., Truong C., Minot S.S. et al. Determining the cause of recurrent Clostridium difficile infection using whole genome sequencing. Diagn Microbiol Infect Dis. 2017;87(1):11–16.
52. Matzke G.R., Halstenson C.E., Olson P.L. et al. Systemic absorption of oral vancomycin in patients with renal insufficiency and antibiotic-associated colitis. Am J Kidney Dis. 1987;9(5):422–425.
53. Azimirad M., Yadegar A., Asadzadeh Aghdaei H., Kelly C.R. Enterotoxigenic Clostridium perfringens Infection as an Adverse Event After Faecal Microbiota Transplantation in Two Patients With Ulcerative Colitis and Recurrent Clostridium difficile Infection: A Neglected Agent in Donor Screening. J Crohns Colitis. 2019;13(7):960–961.
54. Hibbard J., Jiang Z.D., DuPont H.L. Fecal Calprotectin and Fecal Indole Predicts Outcome of Fecal Microbiota Transplantation in Subjects with Recurrent Clostridium difficile Infection. Anaerobe. 2019;56:102–105.
55. Sheldon E., Kitchin N., Peng Y. et al. A phase 1, placebo-controlled, randomized study of the safety, tole-rability, and immunogenicity of a Clostridium difficile vaccine ad-ministered with or without aluminum hydroxide in healthy adults. Vaccine. 2016;34(18):2082–2091.
56. Abou Khalil M., Bhatnagar S.R., Feldman L. et al. Development and validation of a clinical risk calculator for mortality after colectomy for fulminant Clostridium difficile colitis. J Trauma Acute Care Surg. 2019;87(4):856–864.
57. Lamontagne F., Labb A.C., Haeck O. et al. Impact of emergency colectomy on survival of patients with fulminant Clostridium difficile colitis during an epidemic caused by a hypervirulent strain. Ann Surg. 2007;245(2):267–272.
58. Bhangu A., Nepogodiev D., Gupta A. et al. Systematic review and meta-analysis of outcomes following emergency surgery for Clostridium difficile colitis. Br J Surg. 2012;99(11):1501–1513.
59. Keeney K.M., Yurist-Doutsch S., Arrieta M.-C., Finlay B.B. Effects of antibiotics on human microbiota and subsequent disease. Annu. Rev. Microbiol. 2014;68:217–235.
60. Francino M.P. Antibiotics and the human gut microbiome: Dysbioses and accumulation of resistances. Front. Microbiol. 2016;6:1–11.
61. Guh A.Y., Mu Y., Winston L.G. et al. Trends in U.S. Burden of Clostridioides difficile Infection and Outcomes. Published in final edited form as. N Engl J Med. 2020;382(14):1320–1330.
62. Hill C., Guarner F., Reid G. et al. The International Scientific Association for Probiotics and Prebiotics consensus statement on the scope and appropriate use of the term probiotic. Nature Reviews Gastroenterology and Hepatology. 2014;11(8):506–514.
63. Williams N.T. Probiotics. American Journal of Health-System Pharmacy 2010;67:449–458.
64. Collinson S., Deans A., Padua-Zamora А. et al. Probiotics for treating acute infectious diarrhea. Cochrane Database Syst Rev. 2020;2020(12):CD003048. Published online 2020 Dec 8.
65. Pattani R., Palda V.A., Hwang S.W., Shah P.S. Probiotics for the prevention of antibiotic-associated diarrhea and Clostridium difficile infection among hospitalized patients: systematic review and meta-analysis. Open Med. 2013;7:e56–67.
66. Shen N.T., Maw A., Tmanova L.L. et al. Timely Use of Probiotics in Hospitalized Adults Prevents Clostridium difficile Infection: A Systematic Review With Meta-Regression Analysis. Gastroenterology. 2017;152(8):1889–1900.e9.
67. Goodman С., Keating G., Georgousopoulou Е. et al. Probiotics for the prevention of antibioticassociateddiarrhoea: a systematic review and meta-analysis. BMJ Open. 2021;11(8):e043054.
68. Velasco M., Requena T., Delgado-Iribarren A. et al. Probiotic yogurt for the prevention of antibioticassociated diarrhea in adults: a randomized double-blind placebo-controlled trial. J Clin Gastroenterol. 2019;53:717–723.
69. Can M., Beşirbellioglu B.A., Avci I.Y. et al. Prophylactic Saccharomyces boulardii in the prevention of antibiotic-associated diarrhea: a prospective study. Med Sci Monit. 2006;12:19–22.
70. Agamennone V., Krul С.А.М., Rijkers G., Kort R. BMC Gastroenterol. 2018;18:103. Published online 2018 Aug 6.
71. Arvola T., Laiho K., Torkkeli S., Mykka H. Children With Respiratory Infections: A Randomized Study. 1999;104.
72. Szajewska H., Albrecht P., Topczewska-Cabanek A. Randomized, double-blind, placebo-controlled trial: Effect of Lactobacillus GG supplementation on Helicobacter pylori eradication rates and side effects during treatment in children. J Pediatr Gastroenterol Nutr. 2009;431–436.
73. Vanderhoof J.A., Whitney D.B., Antonson D.L. et al. Lactobacillus GG in the prevention of antibiotic- associated diarrhea in children. J. Pediatr. 1999;135:564–568.
74. Fox M.J., Ahuja K.D.K., Robertson I.K. et al. Can probiotic yogurt prevent diarrhoea in children on antibiotics? A double-blind, randomised, placebocontrolled study. BMJ Open. 2015;5:e006474.
75. Ivanko O. Lacidofil in the prevention of Clostridium difficile diarrhea in children. Proceedings of the Institute Rosell Conference, 2005. Italy, September 7 to 8, 2005:22–24.
