Пробиотики в комплексной терапии псевдомембранозного колита
- Аннотация
- Статья
- Ссылки
- English
Заключение. Включение в терапию псевдомембранозного колита комбинации пробиотиков Saccharomyces boulardii CNCM I-745 (Энтерол®) и Bifidobacterium longum 35624® (Симбиозис Альфлорекс) позволило добиться положительной динамики заболевания, предотвратить рецидив клостридиальной инфекции после отмены ванкомицина.
Заключение. Включение в терапию псевдомембранозного колита комбинации пробиотиков Saccharomyces boulardii CNCM I-745 (Энтерол®) и Bifidobacterium longum 35624® (Симбиозис Альфлорекс) позволило добиться положительной динамики заболевания, предотвратить рецидив клостридиальной инфекции после отмены ванкомицина.
![Таблица 1. Антибактериальные препараты, вызывающие развитие ААД и клостридиальной инфекции [по 1]](/upload/resize_cache/iblock/727/195_350_1/Ruchkina1.jpg)
![Таблица 2. Факторы риска развития колитов, вызванных С. difficile [по 1]](/upload/resize_cache/iblock/10b/195_350_1/Ruchkina2.jpg)



Введение
В настоящее время во всех странах продолжает увеличиваться численность пожилых людей, страдающих различными хроническими заболеваниями. Практикующие врачи часто без достаточных оснований назначают антибиотики пациентам с острыми респираторными вирусными инфекциями (ОРВИ), при обострениях хронических заболеваний и т.д. В результате растет заболеваемость антибиотик-ассоциированной диареей (ААД) и клостридиальной инфекцией [1]. Если раньше считалось, что ААД и клостридиальная инфекция развиваются после назначения тетрациклина и линкомицина, то в настоящее время прием любого антибиотика, независимо от способа введения, может привести к росту активности условно-патогенной микрофлоры (табл. 1).
Клиническим проявлением ААД является диарея на фоне проводимой антибактериальной терапии или после ее окончания. Причиной возникновения ААД служит рост условно-патогенной микрофлоры, резистентной к применяемому антибиотику, и/или уменьшение активности симбионтной кишечной микрофлоры [1]. Крайним проявлением нарушения микробиоценоза кишечника при назначении антибиотикотерапии является рост Clostridioides difficile (C. difficile) – анаэробной спорообразующей грамположительной палочки, входящей в состав условно-патогенной микрофлоры человека. C. difficile вырабатывает два белковых экзотоксина: А – энтеротоксин, вызывающий геморрагии и диарею, и В – цитотоксин, повреждающий слизистую оболочку кишечника [2]. Токсины инициируют синтез провоспалительных цитокинов, нарушают формирование актинового цитоскелета клеток с их последующим апоптозом или некрозом. C. difficile вызывает повреждение эпителиального барьера слизистой оболочки толстой кишки с выбросом провоспалительных цитокинов и активацией воспалительных процессов в стенке кишки [1, 2].
Согласно данным страховых компаний, ежегодно в США регистрируется около полумиллиона случаев заболеваний, вызываемых C. difficile, из которых 20 тыс. заканчиваются летальным исходом. В Европе частота заболевания составляет примерно 7–10 случаев на 10 000 койко-дней [1, 3].
В распространении инфекции, связанной с C. difficile, большое значение имеют также факторы риска, способствующие ее активации (табл. 2).
В лечении клостридиальных колитов приоритетное значение отводится курсам ванкомицина и метронидазола. По завершении патогенетической терапии вероятность развития рецидива в последующие восемь недель составляет 12–25%, после первого рецидива возможность дальнейших рецидивов достигает 40–65%. Высокая частота рецидивов клостридиальной инфекции связана с тем, что данные микроорганизмы способны образовывать споры, благодаря которым они сохраняются в неблагоприятных условиях внешней среды. Споры устойчивы к воздействию антибиотиков, могут сохраняться в кишечнике человека длительное время и приводить к рецидиву заболевания после эрадикации вегетативных форм инфекции. У некоторых пациентов возможны рецидивы на протяжении многих лет [1, 4].
Для профилактики ААД, рецидивов клостридиальной инфекции традиционно применяют различные комбинации пробиотических штаммов, в частности Энтерол®, который оказывает антагонистическое действие на С. difficile и относится к самоэлиминирующимся пробиотикам [5, 6].
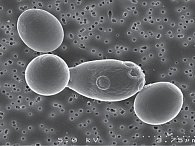
Энтерол® содержит Saccharomyces boulardii CNCM I-745 (S. boulardii CNCM I-745), синтезируемые из шкурки плодов личи. Впервые S. boulardii CNCM I-745 выделены H. Boulard в 1923 г. в Индокитае [1, 6, 7] (рис. 1).
В систематическом обзоре, включающем 27 рандомизированных плацебо-контролируемых исследований с участием 5029 пациентов, продемонстрирована эффективность и безопасность S. boulardii CNCM I-745 в 84% случаев профилактики ААД и клостридиальных колитов [1, 5, 7].
Подробно изучен механизм действия S. boulardii CNCM I-745 на микрофлору кишечника, подтвержденный клиническими исследованиями [7]. Обобщая литературные данные, нами схематично представлено влияние S. boulardii CNCM I-745 на микробиоценоз кишечника (рис. 2).
S. boulardii CNCM I-745 (Энтерол®) расщепляет бактериальные цито- и энтеротоксины, способствует повышению ферментативной функции кишечника, а также обладает естественной устойчивостью к антибиотикам, благодаря чему может эффективно применяться непосредственно при проведении курса антибактериальной терапии. Лиофилизированные S. boulardii CNCM I-745 синтезируют гормоноподобные субстанции спермин и спермидин, стимулирующие восстановление эпителиального кишечного барьера. S. boulardii CNCM I-745 проходят через пищеварительный тракт в неизменном виде, устойчивы к действию соляной кислоты и желчных кислот [6, 7].
По данным ряда публикаций, S. boulardii CNCM I-745 позволяет снизить риск развития ААД в два раза, а вероятность возникновения колитов, связанных с C. difficile, – в три раза [5–7]. S. boulardii CNCM I-745 широко используют для лечения диареи путешественников, инфекционной диареи любой этиологии [8, 9].
Согласно инструкции, после прекращения приема препарата S. boulardii CNCM I-745 полностью элиминируют из желудочно-кишечного тракта в течение двух – пяти дней [6].
Далее приведено клиническое наблюдение, демонстрирующее положительное влияние S. boulardii CNCM I-745 в комплексной терапии клостридиального колита.
Клинический случай
Больной Н., 58 лет, обратился в Московский клинический научный центр (МКНЦ) им. А.С. Логинова ДЗМ с жалобами на водянистый жидкий стул до шести раз в сутки с примесью слизи с императивными позывами, схваткообразные боли в левой подвздошной области при дефекации. Пациент также отмечал повышение температуры тела до фебрильных цифр и потерю в весе до 5 кг за последний месяц.
Из анамнеза известно, что больной лечился у уролога ципрофлоксацином по 1 г/сут по поводу обострения хронического простатита в сочетании с урогенитальной инфекцией. Во время лечения антибиотиком появилась диарея, боль в животе, субфебрильная лихорадка, однако антибактериальная терапия была продолжена: назначен второй курс антибиотика – амоксициллин/клавулановая кислота. В связи с сохраняющимся диарейным синдромом пациент обратился к терапевту. При обследовании в посеве кала обнаружен рост условно-патогенной микрофлоры и снижение бифидо- и лактобактерий. В кале отмечена положительная реакция на скрытую кровь, лейкоциты и эритроциты до 10–15 в поле зрения. В клиническом анализе крови обнаружены признаки анемии, ускорение эритроцитов (СОЭ) и лейкоцитоз. По результатам ультразвукового исследования (УЗИ) органов брюшной полости, установлены перегиб желчного пузыря, признаки диффузных изменений печени и поджелудочной железы, по результатам эзофагогастродуоденоскопии (ЭГДС) – хронический поверхностный гастрит. Быстрый уреазный тест на Нelicobacter рylori (Н. рylori) – отрицательный. Эндоскопические исследования кишечника не проводили. Установлен диагноз: «антибиотик-ассоциированная диарея» и назначено лечение: лоперамид 2 мг в сутки, панкреатин 30 тыс. ЕД/сут, дротаверин 40 мг/сут, бифидумбактерин 15 доз в сутки. В течение последующих трех месяцев улучшения не наступило, и пациент был направлен в МКНЦ им. А.С. Логинова.
При поступлении: состояние средней степени тяжести. Правильного телосложения, удовлетворительного питания: рост 182 см, вес 67 кг, ИМТ = 20,2 кг/м2. Кожные покровы и видимые слизистые обычной окраски. Периферические лимфатические узлы не увеличены. Костно-мышечная система без особенностей. Пастозность стоп и нижней трети голеней. В легких при аускультации дыхание везикулярное, хрипы не выслушиваются, частота дыхания – 17 в минуту. Тоны сердца приглушены, ритмичные, артериальное давление – 130/90 мм рт. ст. Пульс – 86 уд./мин. Язык влажный, у корня обложен белым налетом. Живот не вздут, симметричный, при пальпации мягкий, умеренно болезненный в проекции сигмовидной кишки, симптомов раздражения брюшины нет. Печень у края реберной дуги. Симптом «поколачивания» – отрицательный с обеих сторон.
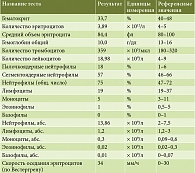
В табл. 3–6 представлены результаты лабораторных исследований.
Из представленных в табл. 4 данных видно, что у больного развилась железодефицитная анемия легкой степени, лейкоцитоз со сдвигом лейкоцитарной формулы влево, тромбоцитоз, гипопротеинемия, гипоальбуминемия, гипокалиемия, гипокальциемия, гипонатриемия, повышен показатель С-реактивного белка (128,80 мг/л).
В клиническом анализе кала обращали на себя внимание примесь лейкоцитов и эритроцитов, положительная реакция на скрытую кровь (табл. 5).
Для выявления С. difficile больному выполнено исследование кала с помощью иммуноферментного анализа (ИФА), при котором обнаружены токсины С. difficile (табл. 6).
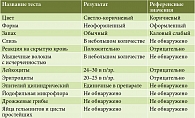
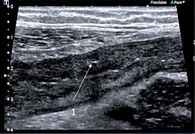
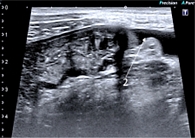
По результатам УЗИ (ультрасонографии): в поперечном отделе стенка толстой кишки толщиной до 5,0–6,0 мм, подслизистый слой выражен. В нисходящем отделе стенка толщиной 5,0–5,8 мм, в проекции сигмовидной кишки стенка наиболее отечная, утолщена до 6,0–7,0 мм. Дифференцировка на слои нечеткая из-за отека. В проекции сигмовидной кишки в слизистом слое гиперэхогенные включения (язвенные дефекты) (рис. 3). Васкуляризация при цветовом доплеровском картировании выражена. Окружающие ткани по ходу сигмовидной кишки повышенной эхогенности за счет воспалительной инфильтрации. Стенка видимого отдела прямой кишки утолщена до 4 мм. В брюшной полости и малом тазу выявлена свободная жидкость в небольшом количестве (рис. 4, 5). Заключение: субтотальный колит с гиперэхогенными включениями в проекции сигмовидной кишки.
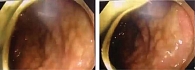
По результатам ЭГДС: хронический гастродуоденит, уреазный тест на Н. pylori – отрицательный. По результатам колоноскопии с илеоскопией: перианальная область без особенностей; тонус анального сфинктера сохранен; баугиниева заслонка губовидной формы, слизистая не изменена; при осмотре 15 см терминального отдела подвздошной кишки – ворсинчатость слизистой оболочки сохранена; в просвете кишки небольшое количество прозрачного кишечного содержимого; слизистая оболочка восходящей ободочной кишки бледно-розовая, гладкая, блестящая, контактно не кровоточит; сосудистый рисунок сохранен; гаустрация сохранена; тонус сохранен, перистальтика прослеживается; слизистая оболочка поперечно-ободочной, нисходящей ободочной, сигмовидной и прямой кишки отечная, бледная, тусклая, сосудистый рисунок очагово смазан; слизистая оболочка сигмовидной кишки с множественными эрозиями до 0,5 см неправильной формы, покрытыми белесовато-желтыми наложениями овальной формы, не смывающимися водой. Заключение: эндоскопическая картина субтотального псевдомембранозного колита (рис. 6).
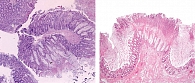
При морфологическом исследовании слизистой оболочки толстой кишки: на поверхностном эпителии определяются фибрино-слизистые наложения со значительными скоплениями микробной флоры и эритроцитами. Собственная пластинка скудная с отеком, зонами фиброза и фибриноидного некроза. Заключение: псевдомембранозный колит (рис. 7).
Таким образом, на основании анамнеза, жалоб больного, клинических, лабораторных и инструментальных данных, гистологического исследования слизистой оболочки толстой кишки установлен диагноз: «Псевдомембранозный колит, ассоциированный с токсинами А и В С. difficile, с субтотальным поражением толстой кишки, среднетяжелого течения. Метаболические нарушения: белково-энергетическая недостаточность второй степени, гипокалиемия, гипокальциемия, гипонатриемия. Железодефицитная анемия легкой степени».
Больному назначена комплексная терапия: ванкомицин перорально 1 г два раза в сутки семь дней и в виде микроклизм по 500 мг два раза в день на 100 мл физиологического раствора; метронидазол (в/в капельно) 1,5 г/сут. Одновременно был назначен Энтерол® по две капсулы два раза в день. Для устранения гипопротеинемии проводили внутривенное вливание смесей аминокислот, альбумина 20% – 100 мл, полиэлектролитных смесей, препаратов железа. Дополнительно назначали полиферментные препараты в мини-микросферах, не содержащие желчных кислот, спазмолитики – дротаверин, а также препараты 5-аминосалициловой кислоты – месалазин 3 г/сут.
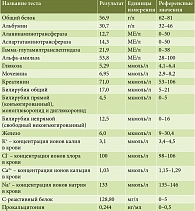
На фоне комплексной терапии состояние больного улучшилось: частота стула уменьшилась до двух-трех раз в сутки, исчезли императивные позывы на дефекацию, прекратилась боль в животе, исчезли отеки стоп и нижней трети голеней. В анализах крови выросли показатели гемоглобина и сывороточного железа, исчезли воспалительные изменения и полиэлектролитные нарушения, нормализовались значения общего белка и альбумина (табл. 7).
Улучшились показатели клинического анализа кала, при повторном исследовании токсины А и В С. difficile в кале не определялись (табл. 8).
При контрольном ультразвуковом исследовании тонкая кишка не утолщена, структура сохранена, при доплерографии – без патологической васкуляризации. Толстая кишка визуализируется на всем протяжении, не расширена. Стенка в проекции правых отделов толщиной до 2,6 мм, явных структурных изменений не выявлено. В поперечном отделе стенка толщиной до 2,5–3,1 мм, подслизистый слой выражен. В нисходящем отделе стенка толщиной 2,0–2,5 мм, в проекции сигмовидной кишки стенка несколько утолщена до 3,5–4,0 мм. Дифференцировка на слои четкая. Гиперэхогенные включения не определяются. Стенка видимого отдела прямой кишки до 3,0–3,2 мм. В брюшной полости и малом тазу свободной жидкости не определяется. Заключение: положительная динамика в течение колита.
При завершении стационарного лечения больному рекомендовано продолжить лечение Энтеролом по две капсулы два раза в день в течение трех недель, а затем – пробиотическим штаммом Bifidobacterium longum 35624® (Симбиозис Альфлорекс) по одной капсуле в сутки на один месяц с целью нормализации работы кишечника. Коротким курсом до двух недель назначались ферментные препараты. Препараты месалазина после стабилизации состояния больного и улучшения лабораторных показателей постепенно отменялись. Через 1,5 месяца амбулаторной терапии у больного сохранялась клиническая ремиссия: частота стула не превышала 1–2 раза в сутки, боль в животе не беспокоила, прибавил в весе 3 кг. В клиническом и биохимическом анализах крови все показатели оставались в пределах референсных значений. При повторном исследовании кала методом ИФА токсины А и В С. difficile не выявлены, но в посеве кала сохранялись сниженные показатели бифидо- и лактобактерий. При УЗИ органов брюшной полости патологии не выявлено. Пациенту рекомендовано продолжить прием Bifidobacterium longum 35624® (Симбиозис Альфлорекс) еще на два месяца с последующим контрольным анализом кала на дисбиоз, при улучшении микробиоценоза кишечника терапия пробиотиком завершалась под контролем гастроэнтеролога.
Заключение
Лечение антибиотиками хронического простатита осложнилось у больного тяжелым псевдомембранозным колитом. Поздняя диагностика воспалительного заболевания толстой кишки привела к развитию метаболических нарушений. В результате патогенетической терапии ванкомицином в сочетании с метронидазолом и небактериальным пробиотиком S. boulardii CNCM I-745 (Энтерол) у пациента достигнута устойчивая клинико-морфологическая ремиссия псевдомембранозного колита. Комбинация Энтерола и Симбиозис Альфлорекс способствовала нормализации работы кишечника и профилактике рецидива клостридиальной инфекции.
Авторы заявляют об отсутствии конфликта интересов
I.N. Ruchkina, PhD, A.E. Bleshchenko, N.G. Samsonova, PhD, S.G. Homeriki, PhD, Prof.
A.S. Loginov Moscow Clinical Scientific Center
Contact person: Irina N. Ruchkina, ruchkinai@mail.ru
The purpose of the presented case is to draw the attention of practitioners to the need to prescribe laboratory and instrumental research methods to identify pseudomembranous colitis and prescribe adequate therapy. Main provisions: a case of pseudomembranous colitis in a patient after a course of ciprofloxacin is described, while Clostridioides difficile was not diagnosed in a timely manner. The absence of pathogenetic therapy led to a severe course of pseudomembranous colitis with the development of metabolic disorders (hypoproteinemia, iron deficiency anemia, polyelectrolyte changes). The patient was treated with vancomycin in combination with metronidazole, correction of protein-electrolyte disorders. Given the severe course of pseudomembranous colitis and the high risk of early recurrence, the patient was prescribed a long course of probiotics – Saccharomyces boulardii CNCM I-745, followed by the appointment of Bifidobacterium longum longum, strain 35624.
Conclusion. The inclusion in the therapy of pseudomembranous colitis of a combination of probiotics: Saccharomyces boulardii (enterol) and Bifidobacterium longum longum 35624 (Symbiosis Alflorex) allowed to achieve positive dynamics of the disease, to prevent recurrence of clostridial infection after withdrawal of vancomycin.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.