Анализ результатов биопсий и ребиопсий предстательной железы в окружном урологическом отделении Западного административного округа г. Москвы за трехлетний период
- Аннотация
- Статья
- Ссылки

Широкое распространение скринингового исследования мужчин для выявления рака предстательной железы путем определения уровня простатспецифического антигена (ПСА) привело к значительному увеличению числа трансректальных биопсий предстательной железы – метода, считающегося «золотым стандартом» диагностики рака простаты. Биопсия простаты, выполненная по надлежащим показаниям и с использованием оптимальной методики, предоставляет врачу необходимую информацию о наличии у пациента предракового поражения (простатическая интраэпителиальная неоплазия (ПИН) высокой степени) либо рака простаты.
Кроме того, по данным биопсии простаты врач может определить локализацию и протяженность опухоли в биоптате, наличие периневральной инвазии или инвазии капсулы предстательной железы, стадию дифференцировки опухолевых клеток (градация по шкале Глисона). Эти показатели в сочетании с другими клиническими данными позволяют установить стадию (T) и степень риска прогрессирования заболевания и/или рецидива после радикальной простатэктомии либо иного терапевтического вмешательства. Без этих сведений невозможно правильно выбрать метод лечения и определить стратегию дальнейшего ведения пациента, и потому интерпретация результатов биопсии простаты – одна из важнейших задач, которые стоят перед специалистом, практикующим в области урологии и онкоурологии.
Забор материала осуществляется в основном вдоль периферических отделов железы, в которых преимущественно выявляются ранние формы РПЖ. При трансректальной биопсии игла идет в косовертикальном направлении сзади кпереди [4], при этом в биоптат попадает большое количество ткани гиперплазированных переходных зон, объем забираемой ткани периферической зоны при ее атрофии существенно меньше. Несмотря на то что этот метод считается «золотым стандартом» диагностики РПЖ, количество повторных биопсий растет. По данным разных авторов, всего 17–33% биопсий оказываются положительными [5].
С чем связана низкая чувствительность «золотого стандарта» диагностики РПЖ? Во многих случаях при анализе патоморфологического исследования биоптата выявляются незлокачественные изменения железистого эпителия, ассоциированные с повышенным риском развития рака простаты у пациента и в связи с этим требующие проведения повторной биопсии. К таким настораживающим находкам относятся атипия c подозрением на аденокарциному или атипичная мелкоацинарная пролиферация (Atypical Small Acinar Proliferation, ASAP) и ПИН. Диагноз ПИН ставится в случае, когда в биоптате обнаруживаются железы, ацинусы и протоки которых выстланы атипичными клетками, однако присутствует интактный базальный слой, что отличает ПИН от аденокарциномы. Считается, что ПИН – это предраковое состояние, которое может иметь высокую или низкую степень неоплазии в зависимости от спектра и выраженности наблюдаемых неопластических изменений.
Исследования прошлых лет показали, что ПИН высокой степени ассоциирована с 27–65%-ным риском выявления рака простаты при ребиопсии [6], однако более современные работы, включившие данные расширенных биопсий, свидетельствуют о том, что риск все же не столь высок и составляет примерно 10–20%. В соответствии с рекомендациями Национальной всеобщей онкологической службы США (National Comprehensive Cancer Network, NCCN), в случае обнаружения ПИН высокой степени после стандартной секстантной биопсии (либо биопсии с количеством взятых проб менее 10) необходимо через 3 месяца провести повторную биопсию по расширенной методике (10 и более биоптатов). Если же с самого начала была проведена расширенная биопсия, больного следует подвергнуть повторной биопсии через 6–12 месяцев с использованием расширенной или сатурационной методики.
Термин «атипическая мелкоацинарная пролиферация» был впервые предложен K. Iczkowski для характеристики желез с признаками архитектурной и клеточной атипии, которые нельзя отнести к реактивной атипии, атипичной аденоматозной гиперплазии, ПИН или аденокарциноме простаты. ASAP не является предраковым состоянием, а выражает лишь неясность диагноза, то есть при ASAP нельзя с уверенностью сказать, соответствует ли наблюдаемая картина аденокарциноме или доброкачественному поражению. В связи с этим при получении диагноза ASAP рекомендуется консультация другого специалиста (желательно экспертного уровня) с пересмотром гистологических стекол, возможно использование иммуногистохимических методов анализа биоптатов.
Показано, что атипия с подозрением на рак ассоциирована примерно с 50%-ной вероятностью диагноза аденокарциномы при повторной биопсии, причем локализация аденокарциномы в большинстве случаев соответствует участку обнаруженной ранее атипии. По мнению P. Humphery, в 18–75% случаев под ASAP скрывается фокус аденокарциномы [7]. Именно поэтому в течение 3 месяцев после первой биопсии рекомендуется провести повторную биопсию по расширенной схеме, причем для повышения диагностической ценности ребиопсии NCCN рекомендует брать дополнительные пробы из участка атипии. Если при повторной биопсии рак не обнаружен, показано тщательное наблюдение с периодическим измерением уровня ПСА, проведением пальцевого ректального исследования и повторной биопсии (известно, впрочем, что проведения двух повторных биопсий после первоначальной достаточно для диагностики подавляющего большинства опухолей простаты).
Материалы и методы
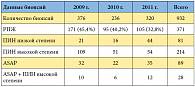
Нами было проведено исследование с целью анализа результатов повторных биопсий предстательной железы, выполненных по поводу наличия ПИН высокой степени и ASAP в первичной биопсии. В исследование были включены 932 мужчины старше 50 лет, которые в 2009–2011 гг. были направлены в окружное урологическое отделение на базе городской поликлиники № 147 Западного округа Москвы для дообследования в связи с подозрением на рак простаты. Пациентам измерялся уровень ПСА, проводилось физикальное обследование, включая пальцевое ректальное и трансректальное ультразвуковое исследования простаты. Пациентам со значением ПСА больше 4 нг/мл выполнялась трансректальная мультифокальная биопсия простаты из 12 точек с последующим гистологическим исследованием, включая определение степени агрессивности рака простаты по шкале Глисона. Возраст больных варьировал от 50 до 79 лет, а средний возраст составил 62 года. По результатам гистологического исследования рак простаты был выявлен у 40% пациентов (n = 371). Средний уровень ПСА среди всех пациентов составил 14,6 нг/мл. У 65% (n = 607) пациентов с выявленным раком простаты значение ПСА находилось в так называемой «серой зоне» (4–10 нг/мл). Среднее значение ПСА «серой зоны» этой группы пациентов составило 6,7 (4,02–9,85) нг/мл. Был проведен анализ взаимосвязи уровня ПСА и индекса Глисона (табл. 1). Распределение пациентов по ПИН низкой и высокой степени и ASAP представлено в таблице 2.
Результаты
При оценке гистологического материала выявлено, что порядка 23% (n = 214) биоптатов содержали ПИН высокой степени в сочетании с различной фоновой патологией (ДГПЖ, хронический простатит). РПЖ был верифицирован в 40% (n = 371) случаев. Сочетание ПИН + РПЖ обнаружено в 4,1% (n = 39) гистологических образцов. Если в возрастной группе 50–59 лет 13,3% (n = 124) биоптатов содержали ПИН, то в возрасте от 70 до 79 лет их доля составила 11,2% (n = 105). При проведении повторных биопсий у 16 пациентов с ПИН высокой степени через 3 месяца РПЖ выявлен в 6 (37,5%) наблюдениях, через 6 месяцев у 28 пациентов число верифицированных РПЖ составило 13 (46,4%), через 12 месяцев у 14 пациентов выявлено еще 4 (28,5%) случая РПЖ.
ASAP был выявлен у 89 пациентов (9,5%). Повторной биопсии через 3 месяца подверглись 68 пациентов. Остальным диагноз РПЖ был подтвержден в результате пересмотра гистологического материала с использованием иммуногистохимических методов анализа. Среди 68 пациентов с ASAP, подвергшихся повторной биопсии через 3 месяца, диагноз РПЖ был выставлен в 26 случаях (38,2%). Среди пациентов с наличием ASAP и ПИН высокой степени из 11 повторных биопсий РПЖ выявлен у 10 пациентов (90,1%).
Выводы
Таким образом, в течение 1 года у 23 (39,6%) из 58 пациентов с ПИН высокой степени при повторной биопсии подтвердился диагноз РПЖ. Выявляемость РПЖ при наличии ASAP в нашем исследовании составила 38,2% и 90,1% при наличии ASAP и сочетания АSAP c ПИН высокой степени в биоптате соответственно. Наше исследование подтвердило, что ПИН высокой степени является предраковым состоянием. Результаты данного исследования свидетельствуют о том, что выявление ПИН высокой степени и ASAP является показанием для ребиопсий предстательной железы.
Авторами было проведено исследование с целью оценки частоты выявления рака предстательной железы при повторной биопсии простаты в окружном урологическом отделении Западного административного округа г. Москвы. Повторная биопсия назначалась при первично диагностированной простатической интраэпителиальной неоплазии высокой степени и атипичной мелкоацинарной пролиферации. Было подтверждено, что оба предраковых состояния являются показанием для проведения ребиопсии предстательной железы.
