Антипролиферативная активность аналогов соматостатина при НЭО. Первый онкологический форум Юга России
- Аннотация
- Статья
- Ссылки

Градация подходов к лекарственной терапии нейроэндокринных опухолей (НЭО) зависит от степени их пролиферативной активности. Индекс пролиферации Ki-67 определяется в ходе иммуногистохимического исследования клеток опухоли и для высокодифференцированных опухолей, которые даже при наличии метастазов прогрессируют очень медленно, составляет 1–20%.
Согласно алгоритму лечения метастатических НЭО, после хирургического вмешательства пациентам показана адъювантная био- и химиотерапия. Методом консервативного лечения наиболее высокодифференцированных опухолей (по оценке Всемирной организации здравоохранения (ВОЗ) – 1, Ki-67 < 2%) считается биотерапия, предусматривающая применение аналогов соматостатина, интерферонов альфа и их комбинации, а также комбинации аналогов соматостатина и новых таргетных препаратов – эверолимуса и сунитиниба. Последний показан при НЭО поджелудочной железы (ПЖ). Эверолимус может применяться в лечении опухоли любой локализации.
При менее высокодифференцированных или умеренно дифференцированных НЭО (ВОЗ – 1–2, Ki-67 – 2–20%) используют схемы, включающие стрептозотоцин. Данный препарат не зарегистрирован в России, но имеется средство из той же группы нитрозопроизводных – Араноза, которое применяется в комбинации с другими препаратами при химиотерапии НЭО. Химиотерапия цитостатическими препаратами назначается и в случае низкодифференцированных НЭО (ВОЗ – 3, Ki-67 > 20%). Основная схема – цисплатин + этопозид или цисплатин + иринотекан, альтернативная – темозоломид + капецитабин + бевацизумаб.
Препаратами выбора при биотерапии НЭО после хирургического вмешательства считаются аналоги соматостатина, представителями которых являются октреотид (Сандостатин® ЛАР) и ланреотид (Соматулин® Аутожель®).
Первоначально Сандостатин применяли для уменьшения клинических симптомов функционирующих НЭО желудочно-кишечного тракта (ЖКТ), например при карциноидном синдроме, коррекции нарушений электролитного баланса, особенно у пациентов с гормональным синдромом НЭО. Кроме того, его назначали пациентам с метастатическими НЭО ЖКТ с большим объемом опухолевой массы, а также в целях предупреждения карциноидного криза (предоперационное назначение). Терапия Сандостатином позволяла значительно улучшать пятилетнюю выживаемость пациентов с распространенными НЭО ЖКТ: если до применения препарата она составляла 18%, то на фоне его применения возрастала до 67%.
Сандостатин характеризуется прямыми и непрямыми антипролиферативными эффектами1. В свое время был проведен ряд исследований эффективности препарата у пациентов с прогрессирующими НЭО ЖКТ. Полученные данные подтвердили его противоопухолевую активность.
Следует отметить, что клинические исследования антипролиферативной активности аналогов соматостатина имели и слабые стороны: исследования были одноцентровыми и несравнительными, с включением небольшого числа пациентов с НЭО ЖКТ различной локализации, как правило получавших предшествующее лечение.
Более весомые доказательства антипролиферативного эффекта Сандостатина ЛАР получены в исследовании PROMID2. В этом рандомизированном двойном слепом плацебоконтролируемом исследовании изучали влияние Сандостатина ЛАР на контроль опухолевого роста у 85 пациентов с метастатическими высокодифференцированными НЭО средней кишки (тонкая кишка, червеобразный отросток и восходящая ободочная кишка) из 18 медицинских центров Германии.
Пациенты были рандомизированы в соотношении 1:1 в две группы. 42 из них составили группу Сандостатина ЛАР 30 мг один раз в 28 дней (внутримышечно), 43 – группу плацебо (внутримышечно). Лечение осуществлялось до прогрессирования, подтвержденного результатами компьютерной томографии/магнитно-резонансной томографии, или до смерти. Данные показали, что по сравнению с плацебо Сандостатин® ЛАР более значимо увеличивает медиану времени до прогрессирования: в группе Cандостатина ЛАР она составила 14,3 месяца, в группе плацебо – 6 месяцев (отношение рисков (ОР) 0,34; 95% доверительный интервал (ДИ) 0,20–0,59; р = 0,000072). Функционально активные и неактивные опухоли реагировали на терапию аналогичным образом. Итак, исследование PROMID подтвердило антипролиферативный эффект Cандостатина ЛАР.
Еще один представитель аналогов соматостатина – Соматулин® Аутожель® (ланреотид). Оценке антипролиферативного влияния ланреотида (Соматулина Аутожель®) на НЭО ПЖ и ЖКТ было посвящено международное рандомизированное двойное слепое плацебоконтролируемое базовое исследование фазы III CLARINET3. Первичной конечной точкой в исследовании являлось сравнение влияния препарата Соматулин® Аутожель® в дозе 120 мг с плацебо на показатель выживаемости без прогрессирования (ВБП) при нефункционирующих энтеропанкреатических НЭО в течение 96 недель после первой инъекции.
В исследовании участвовали 204 пациента, которые были рандомизированы в соотношении 1:1 в группу Соматулина Аутожель® 120 мг (n = 101) (одна глубокая подкожная инъекция в 28 дней) и группу плацебо (глубокая подкожная инъекция) (n = 103).
Критериями включения в базовое исследование фазы III при НЭО ПЖ и ЖКТ стали:
-
возраст 18 лет и старше;
-
спорадические нефункционирующие НЭО (в том числе гастриномы, хорошо контролируемые с помощью ингибиторов протонной помпы, и НЭО из неизвестных источников);
-
метастатические и/или местнораспространенные нерезектабельные НЭО;
-
высоко или умеренно дифференцированные НЭО;
-
опухоли, поддающиеся оценке согласно критериям RECIST 1.0 (централизованная оценка);
-
Ki-67 < 10% или митотический индекс ≤ 2 митозов на 10 полей зрения при большом увеличении микроскопа (×400);
-
оценка сцинтиграфии рецепторов соматостатина по шкале Креннинга ≥ 2-й степени поглощения в течение предшествующих 6 месяцев (от однородного до неоднородного поглощения);
-
оценка общего состояния по шкале ECOG/ВОЗ ≤ 2 (есть симптомы заболевания, но ближе к норме – более 50% дневного времени проводит не в постели, но иногда нуждается в отдыхе).
Первичной конечной точкой была ВБП. Прогрессирование заболевания оценивали централизованно с помощью RECIST 1.0, анализ ВБП проводили в зависимости от источника опухоли, стадии заболевания и объема опухоли.
Вторичными конечными точками являлись, в частности, ВБП на 48-й и 96-й неделе, время до прогрессирования опухоли, качество жизни, уровни хромогранина А, переносимость и общая выживаемость.
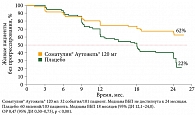
Результаты исследования продемонстрировали достоверное увеличение ВБП в группе Соматулина Аутожель® по сравнению с группой плацебо (ОР 0,47; 95% ДИ 0,30–0,73; р < 0,001) (рис. 1).
Данные показали, что при оценке на 24-м месяце лечения ВБП в группе Соматулина Аутожель® составила 62%, в группе плацебо – 22%. Медиана выживаемости была достигнута только в группе плацебо и составила 18 месяцев (95% ДИ 12,1–24,0).
Статистически достоверная разница более значимого увеличения ВБП на фоне применения Соматулина Аутожель® по сравнению с плацебо была получена и в подгруппе пациентов с НЭО средней кишки и ПЖ.
CLARINET – единственное клиническое исследование НЭО, включавшее широкую выборку НЭО ПЖ и ЖКТ и других локализаций, а также нейроэндокринные гастроэнтеропанкреатические опухоли (ГЭП-НЭО) 1–2-й степени (Ki-67 до 10%). Учитывались такие параметры, как происхождение опухоли, степень ее дифференцировки (Grade) и опухолевое поражение печени (ОПП). В частности, на долю НЭО ПЖ пришлось 46%, НЭО средней кишки – 36%, НЭО задней кишки – 7%. Grade 1 (высокая степень дифференцировки опухоли) имела место в 69% случаев, Grade 2 (умеренная степень) – в 30%. У значительной части больных (34%) ОПП превышало 25%. Исходные характеристики были высоко сопоставимы между двумя группами, за исключением пациентов с ОПП > 25%, доля которых в группе Соматулина Аутожель® была выше (34%), чем в группе плацебо (12%).
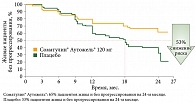
Согласно полученным данным, Соматулин® Аутожель® значительно увеличивает медиану ВБП у пациентов с ГЭП-НЭО, снижает риск прогрессирования заболевания или смерти на 53% по сравнению с плацебо при оценке на 24-м месяце терапии (рис. 2).
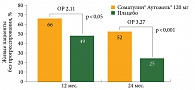
Несмотря на то что снижение риска прогрессирования заболевания или смерти было продемонстрировано на 24-м месяце, достоверная разница наблюдалась уже на 12-м месяце лечения (рис. 3).
Соматулин® Аутожель® на 12-м месяце терапии вдвое снижал риск прогрессирования опухоли или смерти по сравнению с отсроченной терапией и на 2/3 – на 24-м месяце. Преимущество Соматулина Аутожель® продемонстрировано во всех релевантных подгруппах, за исключением малочисленной подгруппы с опухолью задней кишки.
Результаты исследования CLARINET свидетельствуют о целесообразности применения препарата Соматулин® Аутожель® 120 мг в целях опухолевого контроля ГЭП-НЭО и ставят под сомнение наблюдательный подход к лечению, поскольку плацебо можно рассматривать как суррогатный вариант отсроченной терапии.
Исследование CLARINET не выявило нарушений качества жизни в группе активной терапии по сравнению с группой плацебо: оценка качества жизни показала отсутствие значимых различий между подгруппами. Это доказывает положительное соотношение профиля «польза/риск» для Соматулина Аутожель® 120 мг и подтверждает место данного препарата в ряду ранней терапии в алгоритме лечения пациентов с ГЭП-НЭО.
Препарат Соматулин® Аутожель® продемонстрировал хорошую переносимость у участников исследования, аналогичную плацебо: в группе активной терапии любые нежелательные явления фиксировались в 89% случаев, в группе плацебо – в 93%. Наиболее частыми нежелательными явлениями, возникающими на фоне приема препарата, были диарея (26%), абдоминальные боли (14%) и холелитиаз (10%). При этом любые серьезные нежелательные явления в группе Соматулина Аутожель® зафиксированы в 25%, в группе плацебо – в 31% случаев.
Если сравнить исходные характеристики исследований PROMID и CLARINET, более масштабным и доказательным выглядит исследование CLARINET. Например, в международном исследовании CLARINET участвовали 204 пациента из медицинских центров 14 стран, в национальном исследовании PROMID – 85 пациентов из медицинских центров Германии. Исследование CLARINET выгодно отличалось от исследования PROMID главными конечными точками, статусом функционирующей опухоли. Так, в исследование CLARINET включали пациентов только с нефункционирующими опухолями, что позволяло оценить именно противоопухолевый эффект аналога соматостатина, но не противогормональный.
Исследование CLARINET отличается от исследования PROMID широкой выборкой НЭО ПЖ и ЖКТ, а также других локализаций, учетом степени дифференцировки опухоли и ОПП, включением более трети пациентов с опухолями высокой пролиферативной активности, для которых прежде всего важен антипролиферативный эффект аналога соматостатина.
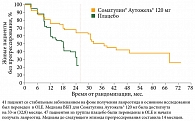
Базовое исследование CLARINET фазы III получило продолжение в открытом продленном исследовании CLARINET (OLE). Пациенты из базового исследования могли войти в одногрупповую продленную фазу. В исследовании OLE участвовали 41 пациент из группы Соматулина Аутожель® и 47 – из группы плацебо. Все участники получали терапию Соматулином Аутожель® 120 мг (одна глубокая подкожная инъекция в 28 дней) до выхода из исследования или его прекращения (ожидаемая максимальная длительность – 5 лет). Цель открытого продленного исследования – изучить долгосрочную безопасность и дополнительно оценить эффективность лечения пациентов с нефункционирующими ГЭП-НЭО.
В ходе исследования OLE продолжительное применение препарата Соматулин® Аутожель® 120 мг обеспечило долгосрочные преимущества в рамках ВБП (рис. 4)4. Медина ВБП составила 32,8 месяца. Тем самым исследование OLE расширило доказательные данные исследования CLARINET без каких-либо новых рисков в отношении безопасности.
Исследование CLARINET OLE подтвердило известный профиль безопасности препарата Соматулин® Аутожель®. Любые серьезные нежелательные явления в группе продолживших терапию препаратом (LAN-LAN) имели место в 22% случаев, в группе начавших терапию Соматулином Аутожель® (PBO-LAN) – в 21%. Связанные с терапией нежелательные явления более чем у 5% пациентов, такие как диарея, в группе LAN-LAN отмечались в 5% случаев, в группе PBO-LAN – в 21%.
Таким образом, препарат Соматулин® Аутожель® 120 мг в исследованиях НЭО ПЖ и ЖКТ демонстрирует:
-
53%-ное снижение риска прогрессирования заболевания и смерти;
-
достоверное увеличение медианы ВБП в сравнении с отсроченной терапией;
-
положительное влияние на медиану ВБП независимо от источника опухоли, степени опухолевого процесса и опухолевой нагрузки печени;
-
стойкое положительное влияние на ВБП при длительной терапии;
-
контроль опухолевого процесса уже к 12-му месяцу без нарушения качества жизни.
Кроме того, ежемесячные глубокие подкожные инъекции готового к использованию препарата в уникальной лекарственной форме обеспечивают доставку полной дозы.
