Бисфосфонаты: мифы и реальность
- Аннотация
- Статья
- Ссылки


Эффективность алендроновой кислоты для предупреждения низкотравматичных переломов была доказана еще 15 лет назад (2, 3). С тех пор появление новых удобных режимов дозирования, а также более дешевых дженериков делает БФ все более и более привлекательными препаратами, как для пациентов, так и для врачей, порождая, вместе с тем, множество спорных мнений и спекуляций. Данный обзор литературы посвящен обсуждению наиболее актуальных вопросов, касающихся эффективности и безопасности БФ для лечения постменопаузального и синильного остеопороза.
Какой препарат для лечения остеопороза самый эффективный?
Азотсодержащие БФ имеют схожую структуру, отличаясь лишь одним из радикалов (рисунок 1), и одинаковый механизм действия: блокирование фермента фарнезилпирофосфатсинтазы.
Это уменьшает способность остеокласта разрушать костную ткань из-за накопления непренилированных мелких белков внутри клетки и нарушения цитоскелета остеокласта (4). Однако степень связи препарата с фарнезилпирофосфатсинтазой и некоторые кинетические характеристики (связь с гидроксиаппатитом, электрический заряд (зета потенциал) у БФ отличаются. Это определяет возможности различных схем дозирования и, по мнению некоторых исследователей, создает предпосылки для отличий в эффективности препаратов и их безопасности (4, 5, 6). Существует ли этому объективное подтверждение? Для доказательства эффективности препаратов проводятся рандомизированные плацебо-контролируемые, двойные-маскированные исследования (РКИ). Такие исследования имеют ряд преимуществ (минимизировано влияние пациента и исследователя), однако выборка должна строго соответствовать критериям отбора пациентов и, следовательно, может сильно отличаться от конкретных больных, приходящих на прием к врачу (7). Так как 30-50% больных не получают лечение (группа плацебо), требованиями этического комитета исключаются тяжелые пациенты с высоким риском перелома. С другой стороны, при планировании клинического испытания заранее рассчитывается необходимое количество пациентов и учитывается наличие у них факторов риска тех или иных переломов, исходя из первичной цели исследования (доказать эффективность препарата для предупреждения переломов позвонков или бедренной кости и внепозвоночных переломов) (7). Так, в исследование ибандроновой кислоты, первичной целью которого было доказать эффективность препарата для предупреждения переломов позвонков, включалось 2946 женщин 55 лет и старше (средний возраст 69 (55-80) лет с остеопенией в шейке бедренной кости (средний Т-критерий в шейке бедра -2,0) и лишь 30% из них получали плацебо (8). Среди доступных в РФ БФ только в исследовании золедроновой кислоты первичной целью было доказать снижение риска переломов бедренной кости. Для этого в исследование было включено 7765 женщин старше 65 лет (средний возраст 73 (65-89) лет), с остеопорозом в бедренной кости по данным остеоденситометрии (Т-критерий в шейке бедра ≤ -2,5), 50% пациенток получали инфузии плацебо (9). Естественно, что в более молодой популяции с остеопенией в шейке бедра и группой плацебо чуть менее 1000 человек вероятность переломов бедра будет несопоставимо ниже по сравнению с популяцией более старшего возраста и остеопорозом в шейке бедра с группой плацебо более 3000 человек. Таким образом, результат исследования всегда должен интерпретироваться, исходя из первичной цели. Мы можем сказать, что золедроновая кислота продемонстрировала эффективность в плане снижения риска переломов бедра. В отношении ибандроната корректно сказать, что проспективных исследований по эффективности ибандроновой кислоты в отношении снижения риска переломов бедра проведено не было, но это вовсе не свидетельствует о неэффективности препарата. Так, в исследовании золедроновой кислоты с участием 2127 пациентов, уже перенесших низкотравматичный перелом бедренной кости (средний возраст 74 года), статистически значимых различий по частоте перелома бедра в группе плацебо и лечения достигнуто не было, по-видимому, из-за недостаточной выборки пациентов (10). Кроме того, у нас нет оснований говорить о преимуществе того или иного препарата, так как они испытывались на совершенно разных популяциях пациентов и клинические исследования преследовали различные цели (7).
Для практического врача важно отличать первичный анализ данных и анализ в субпопуляции, который имеет значительно меньшую ценность и большую вероятность ошибки. Кроме того, необходимо понимать, на какой популяции получены результаты исследования. Особенности выборки и результаты ключевых исследований препаратов, доступных в РФ для лечения остеопороза, приведены в таблице 1.
Нередко, чтобы доказать эффективность препарата для лечения остеопороза, проводится более одного РКИ. Заслуживают упоминания клинические исследования ибандроновой кислоты, в которых для доказательства эффективности новых схем дозирования и/или форм введения препарата использовалось сравнение с формой и дозой с уже доказанной эффективностью в плане снижения риска переломов (Бонвива, 2,5 мг ежедневно) (8). По результатам этих исследований к применению допускались лишь те дозировки (Бонвива, 150 мг 1 раз в месяц внутрь или Бонвива, 3,0 мг внутривенно 1 раз в три месяца), которые по суррогатному маркеру (МПК; минеральная плотность кости) были еще эффективнее, чем форма с ранее доказанной противопереломной эффективностью (13, 14). Подобные исследования имеют дополнительное преимущество: оценка эффективности препарата может проводиться у пациентов с тяжелым остеопорозом (например, в исследование MOBILE включались пациенты с Т-критерием -5,0), так как все больные получают лечение.
Такой подход по этическим соображениям, безусловно, является более предпочтительным с учетом многократно доказанной эффективности азотсодержащих БФ, и хорошо известной статистики о том, что переломы позвонков снижают ожидаемую пятилетнюю выживаемость на 16% (15), а переломы проксимального отдела бедра заканчиваются летально у 20% пациентов в течение первого года после перелома, с ограничением двигательной активности у 80% больных (16). Можно только надеяться, что новые препараты для лечения остеопороза будут испытываться в сравнении с уже существующими методами лечения этого серьезного заболевания. Тем не менее, выводы исследований по эффективности разных форм одинаковой молекулы не могут содержать информацию о снижении риска переломов (обе группы пациентов получают лечение), в отличие от плацебо-контролируемых исследований (в одной группе наблюдается естественное течение заболевания).
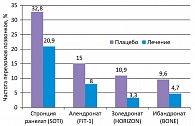
Результаты плацебо-контролируемых исследований представляются в виде снижения относительного риска переломов, что отражает долю пациентов, у которых удалось предупредить низкотравматичный перелом благодаря лечению по сравнению с отсутствием такового. Такой способ представления результатов, хотя и не лишен недостатков, в большей степени позволяет сравнивать результаты различных исследований, так как меньше зависит от частоты переломов (абсолютного риска) в группе плацебо в различных исследованиях (17). Снижение абсолютного риска будет тем больше, чем выше частота переломов в группе плацебо, что, безусловно, должно иметь этические ограничения. Иногда производители препаратов стремятся представить результаты своих исследований в виде величины обратной снижению абсолютного риска – число больных, которых нужно пролечить, чтобы избежать одного перелома (ЧБНЛ, или NNT – number needed to treat = 1/снижение абсолютного риска). ЧБНЛ в первую очередь отражает насколько экономически оправдано лечить конкретную популяцию пациентов, но совершенно некорректно и статистически неприемлемо использовать ЧБНЛ для сравнения эффективности препаратов, исследовавшихся на популяциях с различным абсолютным риском перелома в группе плацебо (7, 17). Частота переломов в группе плацебо по результатам различных исследований представлена на рисунке 2. Невозможность сравнения результатов клинических исследований по ЧБНЛ легко продемонстрировать на примере исследований SOTI (стронция ранелат) (11) и BONE (ибандронат) (8). Итак, если в исследовании BONE (8) в группе плацебо лишь у 9,6% пациентов выявлены новые переломы тел позвонков, то снижение абсолютного риска (АР) будет равно: частота переломов в группе плацебо – частота переломов в группе лечения: 9,6 - 4,9 = 4,7%, ЧБНЛ 1/0,047 = 21. Однако при грубом округлении препарат предупредил перелом у 50% больных (9,6% по сравнению с 4,9%).
С другой стороны, исходя из данных SOTI (стронция ранелат) (11) АР = 32,8 - 20,9 = 11,9, ЧБНЛ 1/0,119 = 9; однако препарат предупредил новые переломы примерно в 35% случаев. Попробуем использовать препарат Х, который был эффективен в 100% среди популяции с абсолютным риском 9,6%.... 9,6 – 0 = 9,6 ЧБНЛ = 1/0,096 = 10. Получается, что лекарство, которое позволило предупредить переломы в 100% случаях, будет казаться «хуже» по сравнению с препаратом, который предотвратил переломы лишь в 35% случаев. И, наоборот, препарат Y с абсолютным риском в группе плацебо 32,8, а в группе лечения 27,9…. Снижение абсолютного риска = 32,8 - 27,9 = 4,7 ЧБНЛ= 1/0,047 = 21, т.е. такое же, как и у препарата с эффективностью 50%, но в данной ситуации препарат Y помог лишь 14% пациентов. Однако какой же препарат предпочтительнее с эффективностью 50% или 14%; 35% или 100%? Вместе с тем, ЧБНЛ очень полезно знать для оценки пользы и риска от конкретного препарата в конкретной популяции пациентов, если рассчитать число больных, которых нужно пролечить, чтобы получить одно серьезное нежелательное явление (NNH – number needed to harm) (7, 17). Таким образом, практический врач может взвесить риск и пользу от конкретного препарата в конкретной популяции пациентов.
В отношении БФ нежелательные явления со стороны верхних отделов желудочно-кишечного тракта (ЖКТ) при приеме препаратов внутрь и гриппоподобные явления мало сопоставимы с последствиями переломов, которых удается избежать и, соответственно, расчет соотношения риск/польза не вполне уместен по данным РКИ или мета-анализов. Однако накопленный опыт применения БФ при широком спектре патологии костной ткани породил другие споры и вопросы в отношении появления редких нежелательных явлений.
Нежелательные явления при приеме БФ
Результаты рки и клиническая практика
К сожалению, в ходе рандомизированных клинических исследований (РКИ) удается выявить только наиболее выраженные и частые побочные эффекты препаратов. Нежелательные явления с частотой менее чем 1 случай на 1000 или даже 10000 человек, как правило, остаются за рамками клинического исследования (18). Редкие нежелательные явления сложно соотнести с приемом препарата, тем более что пациенты чаще всего принимают другие медикаменты и страдают целым рядом сопутствующих заболеваний. Далее обсуждаются реальные и предполагаемые нежелательные явления на фоне приема БФ по результатам РКИ, анализа данных страховых компаний, а также отдельных клинических случаев.
Нежелательные явления со стороны верхних отделов ЖКТ
По данным РКИ III фазы алендроната, ризендроната и ибандроната, увеличение риска язвенного поражения ЖКТ описано не было, однако патология верхних отделов ЖКТ была критерием исключения в этих исследованиях. В ретроспективном исследовании 812 женщин, принимавших алендронат (Ettinger et al.), обнаружили увеличение частоты нежелательных явлений со стороны верхних отделов ЖКТ, связанных с повышенной кислотностью даже среди тех, кто выполнял рекомендации врача по приему препарата (19). По данным популяционных исследований в Дании, риск язвенного поражения желудка и двенадцатиперстной кишки после начала приема алендроната несколько возрастал: до начала лечения отношение шансов 1,12 (95% ДИ 1,08-1,16), в то время как сразу после начала терапии алендронатом – 1,45 (95% ДИ 1,31-1,61). (20). Такие же результаты наблюдались в отношении нежелательных явлений со стороны пищевода: 1,07 (95% ДИ 0,99-1,16) и после начала терапии БФ 1 раз в неделю – 1,86 (95% ДИ 1,49-2,32) (20).
Логично предположить, что более редкое раздражение ЖКТ при приеме БФ внутрь 1 раз в месяц, в частности, ибандроновой кислоты 150 мг 1 раз в месяц, безопаснее для ЖКТ, чем прием 1 раз в неделю. Анализ данных 8608 пациентов, получавших ибандронат 1 раз в месяц, и 8608 больных, которым в это же время были назначены БФ 1 раз в неделю, показал, что риск нежелательных явлений со стороны желудка и двенадцатиперстной кишки, потребовавших госпитализации, в группе ибандроната был на 36% ниже по сравнению с БФ 1 раз в неделю (45 (0,51%) в группе ибандроната против 70 (0,81%) в группе БФ 1 раз в неделю). Следует отметить, что 100% женщин прекратили прием БФ 1 раз в неделю после нежелательного явления, в то время как принимать ибандронат перестали лишь 55,6%. (21). Прием ибандроната 1 раз в месяц позволил уменьшить количество жалоб со стороны ЖКТ даже у тех пациентов, которые уже испытывали нежелательные явления на фоне лечения еженедельными БФ, хотя большинство этих больных все же предпочли внутривенное введение препарата (22). Таким образом, более редкий прием БФ и появление внутривенных форм позволяет значительно уменьшить и даже избежать нежелательных эффектов со стороны ЖКТ.
Особую озабоченность вызвал отчет FDA о 23 случаях рака пищевода, зарегистрированных у пациентов, принимавших алендронат (23). Однако дальнейшие исследования не подтвердили связи этих случаев с приемом БФ. Напротив, два независимых исследования выявили более высокий риск онкологической патологии пищевода среди пациентов сопоставимой группы контроля, а также пациентов, принимавших альтернативные препараты для лечения остеопороза. В частности, 0,27 случая на 1000 человек (24), a в датском исследовании 0,25 на 1000 человек для тех пациентов, которые принимали БФ, в то время как среди больных, не получавших лечения 0,24 на 1000 человек, а среди получавших альтернативное лечение остеопороза 0,48 на 1000 человек (25). Точного объяснения такому «онкопротектированному» эффекту в настоящее время не существует. Более того, из-за возможного развития нежелательных явлений после приема БФ внутрь пациентам чаще проводятся эндоскопические вмешательства, и это может увеличить частоту выявления злокачественных новообразований. Несмотря на это, риск новообразований верхних отделов ЖКТ оказывается ниже. Вместе с тем, при наличии нежелательных явлений со стороны верхних отделов ЖКТ не рекомендуется комбинировать БФ с блокаторами протонной помпы, так как эти препараты сами по себе могут увеличивать риск переломов (26, 27). В данном случае оптимальным решением становится замена на внутривенный БФ.
Реакция (ответ острой фазы) в ответ на введение БФ
Реакция (ответа острой фазы в виде лихорадки, боли в мышцах, повышенной утомляемости, головной боли, боли в костях) чаще развивается при парентеральном введении БФ. Все симптомы разрешаются самостоятельно и бесследно, однако при выраженной реакции или плохой переносимости рекомендуется симптоматическое лечение жаропонижающими средствами (парацетамол или ибупрофен). По данным клинических исследований, острофазовая реакция встречается у 31,6% больных после первой инфузии золедроновой кислоты (9) и у 5,1% пациентов после первой инъекции ибандроновой кислоты (14). Частота и выраженность постдозных реакций уменьшается с каждым последующим приемом препарата. Причина развития реакции острой фазы заключается в механизме действия азотсодержащих БФ. Блокада фарнезилпирофосфатсинтазы приводит к накоплению изопентанилдифосфата, наиболее вероятно, в макрофагах, в которые препарат попадает сразу после введения (4). Вследствие этого активируются g,d-Т-клетки (Vg9Vd2) и, следовательно, повышается уровень цитокинов с развитием симптомов ответа острой фазы (28). Между способностью БФ блокировать фарнезилпирофосфатсинтазу и стимуляцией пролиферацией СD3+ g,d-Т-клеток существует корреляционная зависимость (4, 28). Возможно, именно этим объясняется более частое развитие постдозных реакций после введения золедроновой кислоты (максимальная сила связи с фарнезилпирофосфатсинтазой) по сравнению с внутривенным введением ибандроната.
Нарушения ритма (фибрилляция предсердий)
В исследовании эффективности золедроновой кислоты с участием 7805 человек было обнаружено увеличение случаев фибрилляции предсердий в группе лечения по сравнению с плацебо (9). При вторичном анализе результатов исследований алендроната и ибандроната данных за значимое увеличение риска фибрилляции предсердий не наблюдалось (2 ,3, 8). Более того, в исследовании золедроновой кислоты с включением более пожилых и в целом тяжелых пациентов (после перелома бедренной кости), увеличения частоты аритмий в группе лечения не наблюдалось (10). Следует отметить, что все пациенты до включения в это исследование получали витамин D в дозе от 50000-125000 МЕ (10). Интересно, что и наблюдательные исследования, и анализ баз данных не подтвердили увеличения риска фибрилляций предсердий среди пациентов, получавших лечение БФ (29, 30). Так как потенциальный механизм этого осложнения также остается неясным, можно предположить случайную статистическую ошибку по причине многочисленности сравнений III фазы.
Безопасность со стороны функции почек
Некоторое внимание, особенно в онкологической практике, уделяется возможным случаям нарушения функции почек среди пациентов, получающих внутривенные БФ. Особенность фармакокинетики БФ такова, что примерно 50% препарата из системного кровотока поступает в костную ткань, в то время как остальное выводится почками. Естественно, что при биодоступности, не превышающей 1%, всасывается лишь малая доля БФ, принятого внутрь (алендронат 0,7 мг; ибандронат 1,5 мг), 50% выводится почками (0,35 мг алендроната, 0,75 мг ибандроната), в то время как при внутривенном введении за короткий период времени элиминируется несколько большая доза препарата: 1,5 мг ибандроната, 2,5 мг золедроната. Действительно, ретроспективное исследование у онкологических пациентов (333 пациента: 109 получали ибандронат и 209 золедронат) показало, что, несмотря на исходно более скомпрометированную функцию почек у больных, получавших ибандронат, золедроновая кислота увеличивала риск снижения функции почек в 1,5 раза больше, чем ибандронат (31). Возможно, это связано не только с дозой препарата, но и силой связи фарнезилпирофосфатсинтетазы, играющей роль в построении цитоскелета в подоците (31).
Тем не менее, в рандомизированных контролируемых исследованиях эффективности БФ для лечения остеопороза случаев значимого ухудшения функции почек не наблюдалось. Однако назначение БФ пациентам с заведомо сниженной функцией почек (СКФ ≤ 30 мл/мин для ибандроната и ≤ 35 для золедроната) противопоказано.
Остеонекроз челюсти
Согласно определению Американской ассоциации челюстно-лицевой хирургии, бисфосфонатассоциированный остеонекроз челюсти может быть диагностирован у пациентов с оголенной некротизированной костью в челюстно-лицевой области, незаживающей в течение более чем 8 недель, принимающих БФ или только что закончивших лечение БФ, не получавших лучевого лечения на область челюсти в анамнезе (32). Подобное определение имеет очевидный недостаток – невозможность эпидемиологического исследования проблемы и детального изучения случаев со сходной клинической картиной у пациентов, не получавших БФ. Так в исследовании HORIZON (9) (оценка эффективности золедроновой кислоты), 1 случай остеонекроза был зафиксирован в группе плацебо и 1 в группе лечения, что доказывает отсутствие прямой связи между приемом БФ и развитием остеонекроза. Тем не менее, проанализированные случаи остеонекроза челюсти, развившегося на фоне приема БФ, позволили выделить некоторые факторы риска. Согласно одному из последних консенсусов, наиболее существенными факторами риска являются: тип БФ (большинство зарегистрированных случаев – применение золедроновой кислоты у онкологических больных, а также памидроната), стоматологические хирургические манипуляции, зубные импланты, прием глюкокортикоидов, цитостатиков, циклофосфамидов, талидомида, эритропоэтина, радиотерапия, курение, злоупотребление алкоголем, а также сахарный диабет и ожирение (33). Случаи остеонекроза челюсти у пациентов с остеопорозом чрезвычайно редки, например, по данным Австралии, 0,01-0,04% среди пациентов, получающих алендронат (34), в Германии 0,00038% (3 случая на 780000 пациентов) (35). По данным систематического обзора, составленного на основании описанных в литературе клинических случаев верифицированного остеонекроза челюсти среди больных, принимавших БФ, 94% составляли больные с онкологической патологией, в основном миеломной болезнью и раком молочной железы с метастазами в костную ткань, и лишь 4% пациентов получали лечение по поводу остеопороза. Среди 355 случаев приема БФ и остеонекроза челюсти 35% больных принимали золедронат, 31% памидронат, 28% памидронат и золедронат, 4,2% алендронат, 0,6% алендронат и золедронат, 0,3% (1 человек) ризендронат, 0,3% ибандронат, 0,3% ибандронат и золедронат, 0,3% памидронат, золедронат, алендронат (36). Среди 15 случаев, описанных у больных с остеопорозом, 13 человек получали алендронат, 1 больной принимал ризендронат и 1 алендронат и золедронат (36). Однако важно подчеркнуть, что критерием отбора заведомо был не только факт остеонекроза челюсти, но и прием БФ и, возможно, именно поэтому лидирующие позиции занимают БФ, наиболее широко применяемые при различных заболеваниях. Если же попытаться сопоставить случаи патологии челюсти, потребовавшие хирургического вмешательства (среди таких случаев должны быть наиболее тяжелые формы остеонекроза), и прием БФ, то никакой зависимости или ассоциации этих двух факторов не наблюдается (37). Таким образом, патология челюсти, объединенная под названием «остеонекроз челюсти», еще недостаточно изучена, возможно, гетерогенна и абсолютная связь с БФ не вполне доказана. Возможно, с накоплением опыта в этой области БФ займут место среди препаратов, увеличивающих риск этой патологии. Однако для лучшего понимания проблемы важно было бы глубоко изучить случаи остеонекроза среди пациентов, в том числе не принимающих БФ.
Другие редкие нежелательные явления
Сыпь по типу крапивницы и зуд – возможные реакции на прием БФ и являются одними из 15 основных причин отмены алендроната (38). Нежелательные явления со стороны глаз (увеиты, перисклериты, склериты) – крайне редкое осложнение лечения БФ, требующее отмены препарата и лечения у офтальмолога. Исход указанных глазных реакций благоприятный, но при возобновлении приема БФ, нежелательное явление со стороны глаз рецидивирует (39). На фоне введения БФ возможно развитие гипокальциемии, однако, как правило, у пациентов с гипопаратиреозом, дефицитом витамина D (менее 15 нг/мл) или неправильном назначении препарата (например, больному с уже имеющейся гипокальциемией) (40).
За последние 5 лет появились отчеты о развитии атипичных низкотравматичных переломов бедренных костей у пациентов, принимающих алендронат более 5-6 лет непрерывно, нередко в сочетании с препаратами заместительной гормональной терапии или глюкокортикоидными гормонами (41). Согласно описанию, перелом развивается при минимальной травме, и нередко перелому предшествует боль в бедрах в течение недели или месяца, а по данным рентгенологической картины имеется утолщение кортикального слоя. Однако связь с БФ в данной ситуации остается недоказанной, подобные переломы могут быть отсроченным или необычным проявлением остеопороза, тем более, что такие переломы случаются и у пациентов, никогда не принимавших БФ (42). Кроме того, подобные переломы чрезвычайно редки и несопоставимы с тем количеством переломов, которые удается предупредить благодаря применению БФ.
В таблице 2 сведены реальные и обсуждаемые нежелательные эффекты БФ, а также рекомендации по минимизации рисков (18, 20, 29, 31, 33, 36).
Заключение
Таким образом, БФ являются высокоэффективными препаратами для лечения остеопороза, что было доказано как в рандомизированных плацебо-контролируемых исследованиях, так и в мета-анализе, объединившем основные РКИ различных БФ (43). Интересно, что данные РКИ и реальной клинической практики (при анализе баз данных страховых компаний) совпадали, а по переломам бедра были даже лучше, но только у тех пациентов, которые получили 80% и более от назначенного врачом препарата, что лишний раз подчеркивает важность приверженности больного к лечению (44). Как уже упоминалось, для анализа риск/польза от терапевтического вмешательства оптимально использовать соотношение числа пациентов, которых нужно пролечить, чтобы избежать один перелом, и числа больных, которых мы можем пролечить до развития первого серьезного нежелательного явления. Для получения этих цифр необходимо точно знать частоту нежелательного явления в группе плацебо и, что не менее важно, степень тяжести нежелательного явления должна быть сопоставима с переломом (7, 17). К счастью, нежелательные явления, зарегистрированные в РКИ БФ (известная частота), несопоставимы по своей тяжести с переломами. Тем не менее, внимание врачей и пациентов приковано к редким нежелательным эффектам, прямая связь которых с БФ остается спорной. Интересно, что в плацебо-неконтролируемых исследованиях ибандроновой кислоты указанные нежелательные явления не были зарегистрированы, несмотря на большое количество пациентов (около 7000 человек), получавших именно активное вещество в разных формах и дозах, под жестким контролируемым наблюдением в рамках клинического исследования (13, 14, 44). С другой стороны, и в описанных клинических случаях нежелательных явлений ибандронат встречается значительно реже любого другого БФ. Вместе с тем, для врача и пациента очень важно оценивать пользу от лечения и разумно реагировать на недоказанные предположения и гипотезы. В частности, необоснованные негативные отзывы средств массовой информации о БФ, приводящие к сокращению назначений БФ на 29633 выписанных рецептов, влечет за собой 70 новых переломов бедра, 60 других переломов и 14 летальных исходов за 9 месяцев, которые можно было бы предупредить (45).
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.