COVID-19 и сахарный диабет: что мы знаем об этом
- Аннотация
- Статья
- Ссылки
- English
Известно, что коронавирусы имеют одноцепочечный РНК-геном, кодирующий четыре-пять структурных белков SARS-CoV. Подобный ему SARS-CoV-2 (ранее известный как 2019-nCoV) начинает жизненный цикл со связывания своей вирусной частицы через двухкомпонентный белок (гликопротеин), что кодируется S-сегментом генома вируса, с рецептором ангиотензинпревращающего фермента 2 (АПФ-2) на клетке-мишени. Поскольку АПФ-2 имеет сродство с S-гликопротеинами некоторых коронавирусов, включая SARS-CoV и SARS-CoV-2, именно через него вирус проникает в клетку. Более того, считают, что SARS-CoV-2 может подавлять АПФ-2. Это приводит к избыточному накоплению ангиотензина 2 и брадикинина и, как следствие, развитию острого респираторного дистресс-синдрома, отека легких и миокардита, тяжелых системных микроциркуляторных нарушений.
Пожилой возраст, сахарный диабет, артериальная гипертензия и ожирение являются факторами риска развития осложнений у пациентов с COVID-19. В то же время сам по себе диабет ассоциируется с различными осложнениями, прежде всего микрососудистыми.
Учитывая современную ситуацию, перед диабетологами как никогда остро стоит задача своевременного выявления факторов риска развития этих осложнений диабета, их профилактики и оценки эффективности проводимой терапии.
Известно, что коронавирусы имеют одноцепочечный РНК-геном, кодирующий четыре-пять структурных белков SARS-CoV. Подобный ему SARS-CoV-2 (ранее известный как 2019-nCoV) начинает жизненный цикл со связывания своей вирусной частицы через двухкомпонентный белок (гликопротеин), что кодируется S-сегментом генома вируса, с рецептором ангиотензинпревращающего фермента 2 (АПФ-2) на клетке-мишени. Поскольку АПФ-2 имеет сродство с S-гликопротеинами некоторых коронавирусов, включая SARS-CoV и SARS-CoV-2, именно через него вирус проникает в клетку. Более того, считают, что SARS-CoV-2 может подавлять АПФ-2. Это приводит к избыточному накоплению ангиотензина 2 и брадикинина и, как следствие, развитию острого респираторного дистресс-синдрома, отека легких и миокардита, тяжелых системных микроциркуляторных нарушений.
Пожилой возраст, сахарный диабет, артериальная гипертензия и ожирение являются факторами риска развития осложнений у пациентов с COVID-19. В то же время сам по себе диабет ассоциируется с различными осложнениями, прежде всего микрососудистыми.
Учитывая современную ситуацию, перед диабетологами как никогда остро стоит задача своевременного выявления факторов риска развития этих осложнений диабета, их профилактики и оценки эффективности проводимой терапии.

Введение
COVID-19 приобрела характер пандемии [1]. В настоящее время инфекцией охвачено более двухсот стран.
Коронавирусы (от лат. Coronaviridae) – семейство вирусов, включающее 40 видов РНК-содержащих вирусов, которые поражают человека и животных. Свое название вирус получил по шиповидным отросткам, напоминающим солнечную корону [2].
Впервые коронавирус был выделен в 1965 г. у пациента с острым ринитом. В 2002–2003 гг. в Китае появился вирус SARS-CoV. В 2012 г. – MERS-CoV [3]. В декабре 2019 г. в Китае началась вспышка пневмонии, вызванной вирусом 2019-nCoV (SARS-CoV-2) [4]. Помимо зоонозных SARS- и MERS-CoV (возбудители паразитируют в организме, который является естественным резервуаром для них) установлено четыре коронавируса человека (HCoV).
Согласно результатам исследования, недавно проведенного в Исландии, лиц с высоким риском заражения (прежде всего речь идет о тех, кто тесно контактировал с инфицированными или недавно посещал районы с высоким индексом заражения) и уже получивших положительный результат на SARS-CoV-2 примерно 13%. Для сравнения – в общей популяции всего 0,8% зараженных. Следует отметить, что случаев заражения среди детей до десяти лет и женщин меньше, чем среди подростков и мужчин [5].
Сахарный диабет (СД) идентифицирован как наиболее распространенный фактор риска заражения SARS-CoV-2 [6]. Кроме того, согласно данным, полученным из Италии и США, более тяжелое течение COVID-19 отмечено у страдающих хроническими заболеваниями. Одним из таких заболеваний является СД.
Этиология COVID-19
Коронавирусы подразделяются на четыре рода: α-коронавирусы, β-коронавирусы, γ-коронавирусы и δ-коронавирусы [7].
К α-коронавирусам относятся HCoV-NL63 и HCoV-229E, к β-коронавирусам – HCoV-OC43, HCoV-HKU1, SARS-CoV, MERS-CoV, 2019-nCoV [7, 8].
Новый 2019-CoV (SARS-CoV-2) относится к царству Riboviria, типу Incertae Sedis, порядку Nidovirales, семейству Coronaviridae, роду Betacoronavirus, подроду Sarbecovirus [9].
Геном 2019-nCoV очень схож с геномом уже известных коронавирусов. Его РНК больше всего напоминает РНК вируса, обнаруженного пару лет назад у летучих мышей Rhinolophus affinis в провинции Юньнань и сходного с вирусом атипичной пневмонии, – совпадение 96,2% нуклеотидов. Геном 2019-nCoV на 79,5% совпадает с РНК вируса атипичной пневмонии SARS-CoV. Он сохранил без изменений один из пяти его участков. В нем присутствует тот же рецептор – ангиотензинпревращающий фермент 2 (АПФ-2).
Патогенез и факторы, влияющие на тяжесть течения
Коронавирусы имеют одноцепочечный геном РНК, кодирующий от четырех до пяти структурных белков, включая белок внешней оболочки (N), белок матрицы (M), белок малой оболочки (E), спайк (S) гликопротеин, что обеспечивает их связывание и проникновение в клетку [10, 11].
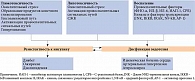
S-протеин характеризуется наличием рецептор-связывающего домена (RBD) S1-субъединицы, которая способствует его связыванию с рецептором АПФ-2 хозяина, и S2-субъединицы, отвечающей за проникновение через клеточную мембрану [12–14]. RBD MERS-CoV прикрепляется к клеткам хозяина через дипептидилпептидазу 4, а не через АПФ-2 [15]. Установлено, что определенные структурные изменения RBD уникальны для SARS-CoV-2. Это позволило увеличить аффинность SARS-CoV-2 с рецептором АПФ-2 по сравнению с SARS-CoV [16]. Комплекс из двух молекул АПФ-2, двух транспортеров аминокислот (B0AT1) и двух фрагментов вирусного белка-«шипа» (RBD) и его расположение в клеточной мембране представлены на рис. 1 [17].
При инфицировании SARS-CoV-2 развивается комплексный ответ врожденной и адаптивной иммунной системы, включающий три фазы: фазу виремии, острую фазу и фазу восстановления [18].
Врожденный иммунитет распознает ассоциированные с вирусным патогеном молекулярные паттерны рецепторами распознавания образов (Toll-подобными рецепторами), что приводит к экспрессии интерферона 1 и воспалительных факторов, которые усиливают защитный механизм макрофагов и естественных клеток-киллеров [19]. Дендритные клетки – тканевые фагоциты, которые через антигенную презентацию активируют Т- и В-лимфоциты [19]. Адаптивная иммунная система контролирует персистирующую фазу инфекции и отвечает за продукцию нейтрализующих моноклональных антител к вирусной оболочке (гликопротеины CD4+-Т-клеток), а также за уничтожение инфицированных вирусом клеток цитотоксическими CD8+-Т-клетками [10]. В острой фазе инфекции SARS-CoV и SARS-CoV-2 внедряются в CD4+- и CD8+-Т-лимфоциты, что приводит к их апоптозу и, следовательно, лимфоцитопении [12, 18]. Течение инфекции утяжеляется.
Вирус попадает в организм через эпителий верхних дыхательных путей, эпителиоциты желудка и кишечника. Начальным этапом заражения считается проникновение SARS-CoV-2 в клетки-мишени АПФ-2 [1].
Рецепторы АПФ-2 представлены на клетках дыхательного тракта, почек, пищевода, мочевого пузыря, подвздошной кишки, сердца, центральной нервной системы. Однако основной и быстро достижимой мишенью являются альвеолярные клетки 2 типа легких, что и определяет развитие пневмонии. Обсуждается также роль CD147 в инвазии клеток SARS-CoV-2 [1].
Диссеминация SARS-CoV-2 из системного кровотока или через пластинку решетчатой кости (lamina cribrosa) может привести к поражению головного мозга. Изменение обоняния (гипосмия) на ранней стадии заболевания может свидетельствовать как о поражении центральной нервной системы, так и об отеке слизистой оболочки носоглотки [1].
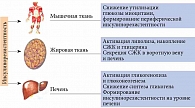
Инсулинорезистентность, признанная одной из главных причин развития эндотелиальной дисфункции (рис. 2), сердечно-сосудистых заболеваний и их осложнений [20, 21], может утяжелять течение COVID-19.
Инсулинорезистентность – нарушение биологического ответа (метаболического и молекулярно-генетического) на экзогенный и эндогенный инсулин. Она ассоциируется с изменением метаболизма углеводов, жиров и белков, а также синтеза ДНК, регуляции транскрипции генов, процессов дифференцировки и роста клеток и тканей организма.
В инициации инсулинорезистентности большое значение отводится пострецепторным нарушениям передачи сигнала инсулина, обусловленным, вероятно, повышением уровня фактора некроза опухоли α (ФНО-α), неэстерифицированных жирных кислот. Свой вклад вносят малоподвижный образ жизни, высококалорийная диета, возраст, курение, избыточный вес/ожирение и др. [22]. Причинами инсулинорезистентности клеток поперечнополосатых мышц могут быть дефекты транспорта глюкозы, обусловленные патологией глюкозного транспортера 4 (рис. 3) [23].
Способы распространения вируса
Передача инфекции осуществляется воздушно-капельным, воздушно-пылевым и контактным путями. Ведущим признан воздушно-капельный путь: при кашле, чихании и разговоре на близком (менее 2 м) расстоянии [1].
Контактный путь подразумевает передачу инфекции не только через непосредственный контакт с инфицированным, но и через пищевые продукты, поверхности и предметы, контаминированные вирусом [1]. Необходимо помнить, что при комнатной температуре SARS-CoV-2 способен сохранять жизнеспособность на объектах окружающей среды в течение трех дней [1].
Среди возможных механизмов передачи вируса РНК SARS-CoV-2 указывается такой, как исследование образцов фекалий больных [1].
Группы риска: что их объединяет
Наиболее уязвимыми для COVID-19 являются больные ожирением, СД и метаболическим синдромом.
Жировая ткань продуцирует порядка 50 гормонов. Апелин является одним из недавно открытых адипокинов, участие которого в патогенезе заболеваний, в том числе хронических бронхолегочных, не до конца изучено [24]. Необходимо отметить, что патогенетическая роль апелинергической сигнализации изучалась преимущественно при сердечно-сосудистой патологии (артериальной гипертензии, атеросклерозе, ишемической болезни сердца, хронической сердечной недостаточности), а также при ожирении и метаболическом синдроме [24].
Большая роль в формировании микро- и макрососудистых осложнений, одним из звеньев которых является эндотелийзависимая вазодилатация, отводится оксидативному стрессу, который приводит к ускоренной инактивации оксида азота (NO) супероксидным анион-радикалом, в результате чего образуется пероксинитрит, который в свою очередь может вступать в реакцию с тирозиновыми остатками белков с образованием нитротирозина и тиолами альбумина или глутатиона, образуя S-нитрозотиолы. Таким образом, взаимодействие с тиолами может предотвращать токсичные эффекты пероксинитрита, однако снижается биодоступность оксида азота при его неизменном синтезе [25].
Корреляционный анализ свидетельствует, что у пациентов с артериальной гипертензией прослеживается достоверная связь между активностью апелина и компонентами вазоактивного пула оксида азота. Выявлены корреляции уровня апелина с уровнем S-нитрозотиола (R = 0,26; p < 0,05), индуцибельной синтазы NO (iNOS) (R = 0,39; p < 0,05), эндотелиальной синтазы NO (eNOS) (R = -0,27; p < 0,05), индексом Caro (R = -0,29; p < 0,05). Установлена также положительная корреляция апелина с гликированным гемоглобином (R = 0,53; p < 0,05) [25].
Апелин способствует усвоению глюкозы через АМФ-протеинкиназный путь и eNOS. Он также угнетает липолиз за счет регулирования фосфорилирования гормончувствительной липазы, уменьшая высвобождение свободных жирных кислот (СЖК) в кровоток и способствуя повышению чувствительности клеток к инсулину [25]. Апелин взаимодействует с рецепторами ангиотензина 2, приводит к ингибированию зависимой от фактора некроза опухоли α инсулинорезистентности [26]. Исследование эффектов апелина на инсулинзависимое поглощение глюкозы на модели культивированных адипоцитов подтвердило представленные выше данные. Апелин уменьшает продукцию провоспалительных цитокинов (интерлейкина 6 (ИЛ-6)), реактивных форм кислорода и моноцитарного хемоаттрактантного белка 1 [27].
Снижение уровня апелина отмечается не только при артериальной гипертензии, но и при ожирении. У пациентов с артериальной гипертензией значительная дисгликемия, гиперинсулинемия, гиперцитокинемия сопровождались снижением активности апелина в отличие от пациентов без нарушений углеводного обмена [26].
Итак, активность апелина зависит от выраженности дисгликемии и инсулинорезистентности. У 89% больных СД нарушена функция эндотелия – снижена активность eNOS и повышена активность iNOS. Значительное повышение S-нитрозотиола свидетельствует о высокой степени депонирования и снижении биодоступности оксида азота.
Установлено участие апелина в развитии воспалительного процесса. Так, фактор некроза опухоли α – наиболее значимый гуморальный медиатор воспаления – может напрямую регулировать экспрессию апелина в адипоцитах [28]. Имеются также данные о регуляции экспрессии апелина интерлейкином 6. Положительный эффект апелина на течение воспалительного процесса в легких заключается в снижении миграции нейтрофилов и макрофагов, уменьшении толщины альвеолярной перегородки, восстановлении альвеолярно-капиллярной проницаемости и уменьшении внесосудистого отложения фибрина [29]. Возможно, данный феномен связан как с ангиогенной ролью апелина, так и с его протективным эффектом при ишемии, что позволило предположить вовлеченность апелинергической системы в ранний адаптационный физиологический/патофизиологический ответ на снижение как локального, так и общего уровня кислорода [30]. Выявленная связь между гипоксией и экспрессией апелина указывает на необходимость изучения патогенетической (саногенетической) роли этого адипокина в развитии ряда заболеваний бронхолегочной системы, сопровождающихся хронической или острой гипоксией. Получены данные о повышении апелина в плазме крови у пациентов с обструктивным апноэ и о его снижении при создании постоянного положительного давления в дыхательных путях.
Сахарный диабет и COVID-19
В связи с большой скоростью распространения [31], диапазоном клинических проявлений, заболеваемостью и смертностью, связанными с COVID-19, особый интерес вызывают факторы, которые предрасполагают к тяжелому течению заболевания. Проведенные исследования свидетельствуют, что не только пожилой возраст способствует тяжелому течению COVID-19, но и некоторые хронические заболевания, такие как артериальная гипертензия, сердечно-сосудистая патология и сахарный диабет [32–37]. F. Zhou и соавт., а также W. Guo и соавт. сообщили не только о связи между тяжелым течением COVID-19 и СД [36, 37], но и высказали предположение, что AПФ-2 может быть причиной данной ситуации.
Пока неизвестно, являются ли пациенты с СД более восприимчивыми к COVID-19. Однако они относятся к группе повышенного риска осложнений, вызванных COVID-19. Согласно заключению экспертов Международной федерации диабета, на это могут быть две причины. Первая – нарушение иммунной системы, что затрудняет борьбу с вирусом и ведет к более длительному выздоровлению. Вторая – вирус может развиваться более стремительно в условиях повышенной глюкозы в крови.
Клинические наблюдения в Китае
Первый случай пневмонии неизвестной этиологии был зафиксирован в конце декабря 2019 г. в Китае в Ухане [38]. Последовавший за этим анализ ситуации выявил новый β-коронавирус SARS-CoV-2 – седьмой член семейства коронавирусов, способный к заражению людей и проявляющийся в виде тяжелого острого респираторного синдрома [39].
В ходе одноцентрового обсервационного исследования у пациентов с тяжелым течением COVID-19 установлена высокая распространенность хронических заболеваний. На долю СД у не переживших новую инфекцию приходилось до 22% [32]. Согласно результатам другого крупного обсервационного исследования, тяжелое течение COVID-19 отмечалось у 16,2% пациентов с СД 2 типа. По данному показателю СД уступал лишь артериальной гипертензии – 23,7% случаев [33]. Метаанализ, который включал эти и другие исследования, показал, что заболеваемость СД была в два раза выше у лиц с тяжелым течением COVID-19 [35].
Последующие исследования продемонстрировали связь между СД и плохим прогнозом, повышенной смертностью.
Недавно проведенное ретроспективное когортное исследование в отношении 174 пациентов, госпитализированных в уханьскую больницу с COVID-19, показало, что 21,2% из них страдали СД [37]. Кроме того, СД был идентифицирован как фактор риска тяжелого течения заболевания (исходя из рентгенографических и лабораторных (биомаркеры воспаления) данных, степени органной недостаточности).
Согласно данным краткого отчета Китайского центра по контролю заболеваний, уровень смертности среди больных СД был выше, чем общий уровень смертности, – 7,3 против 2,3% [40].
Результаты многоцентрового ретроспективного когортного исследования COVID-19 также подтвердили статистически значимую связь между СД и повышенной смертностью [36].
Клинические наблюдения в Италии
Ситуация в Италии характеризовалась большим количеством случаев тяжелого течения COVID-19 и перегрузкой системы здравоохранения, в связи с чем летальность достигла 7,2% [41]. Неоспорим вклад такого свойственного для Италии фактора, как значительная доля пожилого населения. Однако не менее важное место отводилось хроническим сердечно-сосудистым и метаболическим заболеваниям. Согласно результатам ретроспективного исследования, 49% поступавших в реанимацию с COVID-19 страдали артериальной гипертензией, 21% – сердечно-сосудистыми заболеваниями, 17% – СД [42]. Большинство из них были пожилыми мужчинами. Эндотрахеальная интубация и искусственная вентиляция легких потребовались 88% пациентов, неинвазивная вентиляция – 11%. Необходимость в искусственной вентиляции легких у пациентов из Ломбардии была значительно выше, чем у пациентов из штата Вашингтон (США) – 71% [43], Уханя (Китай) – 42 и 47% [13, 44]. Примечательно, что половина из них лечилась с помощью экстракорпоральной мембранной оксигенации [38].
В Университетской больнице Падуи из 146 госпитализированных с инфекцией, вызванной SARS-CoV-2, 13 страдали СД. Необходимо отметить, что средний возраст больных составил 65,3 года.
По состоянию на 17 марта 2020 г., средний возраст итальянских пациентов, умерших в результате заражения SARS-CoV-2, составил 80,5 года, 70% из них были мужчины [45, 46].
Эксперты Итальянского национального института здравоохранения сообщили, что доля больных СД среди умерших при инфицировании SARS-CoV-2 достигла 35,5% [47].
На основании полученных данных было высказано предположение, что сахарный диабет не увеличивает риск инфицирования SARS-CoV-2, но ухудшает его течение, а также может быть значимым фактором риска смерти [47, 48].
Клинические наблюдения в США
Первые случаи COVID-19 в США были подтверждены 19 января 2020 г. в округе Снохомиш штата Вашингтон [49, 50]. По состоянию на 27 марта 2020 г. в Вашингтоне зарегистрировано 3700 случаев заболевания COVID-19 и 175 смертей [51]. Встречаемость СД у поступивших в отделения интенсивной терапии в Сиэтле в двух проанализированных сериях случаев составила 58,0 и 33,3% соответственно [43, 52].
Центр по контролю заболеваний США на 28 марта 2020 г. обнародовал предварительные данные: СД выявлен у 10,9% пациентов с SARS-CoV-2. Из них 32% нуждались в госпитализации в отделение интенсивной терапии [53].
Терапия коронавирусной инфекции
Анализ литературы по лечению пациентов с атипичной пневмонией, связанной с SARS-CoV и MERS-CoV, позволяет выделить несколько этиотропных препаратов: хлорохин, гидроксихлорохин, лопинавир плюс ритонавир, азитромицин (в комбинации с гидроксилорохином), препараты интерферонов [1].
Однако имеющиеся на сегодняшний день данные не позволяют сделать однозначный вывод об их эффективности или неэффективности. Применение данных препаратов допустимо только по решению врачебной комиссии и в установленном порядке [1]. Потенциальная польза должна превышать потенциальный риск.
Лечение коморбидных заболеваний, состояний и осложнений проводится в соответствии с клиническими рекомендациями, стандартами медицинской помощи по данным заболеваниям и состояниям, осложнениям [1].
Следствием тяжелого жизнеугрожающего синдрома высвобождения цитокинов может стать развитие синдрома диссеминированного внутрисосудистого свертывания, который сопряжен с высоким риском венозной тромбоэмболии и летальных исходов. Клинические наблюдения показали, что назначение низкомолекулярных гепаринов, при их отсутствии – гепарина, обеспечивает радикальную выживаемость больных [1].
Гепарин оказывает как прямое, так и непрямое противовоспалительное воздействие. Ликвидируя микротромбозы, он нормализует микроциркуляцию в легком. Таким образом обеспечивается адъювантный эффект противовоспалительной терапии [1].
При госпитализации пациентов с подозрением на COVID-19 или подтвержденным COVID-19 рекомендуется определить уровень D-димера в крови, протромбиновое время, уровень фибриногена, сделать развернутый анализ крови, включая уровень тромбоцитов [1].
Назначение низкомолекулярных гепаринов (как минимум в профилактических дозах) показано всем госпитализированным пациентам. В случае недоступности низкомолекулярных гепаринов возможно использование нефракционированного гепарина [6].
Противопоказаниями для применения низкомолекулярных гепаринов/нефракционированного гепарина в профилактических дозах служат продолжающееся кровотечение, уровень тромбоцитов в крови ниже 25 × 109/л, выраженная почечная недостаточность (для низкомолекулярных гепаринов). Повышенное протромбиновое время и активированное частичное тромбопластиновое время не относятся к противопоказаниям [1].
Возможна также терапия препаратами, улучшающими эндотелиальную дисфункцию (комплексные препараты, созданные на основе технологически обработанных антител в сверхвысоких разведениях к β-субъединице рецептора инсулина и антител к эндотелиальной NO-синтазе (анти-eNOS)).
Гипогликемизирующая терапия у больных сахарным диабетом 2 типа с СOVID-19
При глюкозе плазмы натощак менее 13 ммоль/л, отсутствии признаков дегидратации, гипертермии ниже 38,5 °C следует продолжить прежнюю терапию [54]. Предпочтение необходимо отдавать метформину, метформину пролонгированного действия, ингибиторам дипептидилпептидазы 4 (кроме саксаглиптина), препаратам сульфонилмочевины с низким риском гипогликемии (например, гликлазиду МВ), агонистам рецепторов глюкагоноподобного пептида 1 (арГПП-1) (в отсутствие тошноты и рвоты), ингибиторам натрий-глюкозного котранспортера 2 (иНГЛТ-2) (под строгим контролем кетонов мочи).
Контроль глюкозы плазмы натощак следует проводить пять-шесть раз в день.
Контроль питьевого режима – не менее 100 мл жидкости каждый час.
Рекомендуется также дробное потребление углеводов небольшими порциями.
При глюкозе плазмы натощак более 13 ммоль/л, признаках дегидратации, гипертермии выше 38,5 °C показан перевод на базис-болюсную инсулинотерапию с распределением дозы инсулина короткого действия, инсулина ультракороткого действия и базального инсулина (50%/50%) [54]. Препараты метформина, арГПП-1, иНГЛТ-2, препараты сульфонилмочевины следует отменить.
Базальный инсулин – старт с 10 ЕД/сут или 0,1–0,2 ЕД/кг.
Инсулин короткого или ультракороткого действия – в дозе 4 ЕД или 10% от дозы базального инсулина перед основными приемами пищи.
Титрация дозы базального инсулина проводится по 2 ЕД один раз в три дня в зависимости от уровня глюкозы плазмы натощак. Дозы инсулина короткого или ультракороткого действия зависят не только от уровня глюкозы плазмы натощак, но и от планируемого количества углеводов.
Контроль глюкозы плазмы натощак осуществляется семь-восемь раз в день.
Коррекция инсулинотерапии у больных сахарным диабетом 1 типа без кетоацидоза
При возникновении сопутствующего инфекционного заболевания у больных СД 1 типа рекомендован контроль глюкозы плазмы натощак (семь-восемь раз в день), а также кетоновых тел в моче [54]. Если кетоновые тела в моче отсутствуют, необходимо увеличить дозу инсулина короткого или ультракороткого действия при плановых инъекциях перед едой на 5–10% от обычной суммарной суточной дозы всех инсулинов, а также при внеплановых инъекциях. Инъекции инсулина короткого действия необходимо делать не чаще одного раза в три-четыре часа, инсулина ультракороткого действия – не чаще одного раза в два-три часа. При этом сначала следует оценить действие предыдущей дозы.
При диабетическом кетоацидозе необходима госпитализация в стационар.
Заключение
На сегодняшний день COVID-19 стал главной мировой проблемой. Карантин, изоляция, социальное дистанцирование и строгие ограничения на внутренние и международные поездки и перелеты являются наиболее эффективной профилактической стратегией наряду с самогигиеной.
В сложившейся ситуации пациенты с СД могут испытывать трудности в приобретении необходимых препаратов, предметов медицинского обеспечения, а также расходных медицинских изделий, таких как инсулин, спиртовые салфетки, тест-полоски для глюкозы и т.д. Это может привести к неадекватному контролю как основного заболевания, так и сопутствующих (артериальной гипертензии, дислипидемии). Их декомпенсация может способствовать более тяжелому течению COVID-19 [55].
В связи с вышесказанным возрастает необходимость в телемедицинских технологиях, включая телефонные и видеоконсультации, для оказания специализированной помощи пациентам [56–58]. Многопрофильные группы специалистов должны помогать больным СД, а также членам их семей и опекунам пользоваться преимуществами новых коммуникационных платформ социальных сетей.
M.V. Shinkin, L.A. Zvenigorodskaya, MD, PhD, Prof., A.M. Mkrtumyan, MD, PhD, Prof.
A.S. Loginov Moscow Clinical Scientific and Practical Center
A.I. Yevdokimov Moscow State University of Medicine and Dentistry
Contact person: Mikhail V. Shinkin, jendis@yandex.ru
The COVID-19 pandemic caused by the new coronavirus (CoV), SARS-CoV-2, is characterized by significant morbidity and mortality.
Coronaviruses have a single-stranded RNA genome, which encodes 4–5 structural SARS-CoV proteins, and the similar SARS-CoV-2 (2019-nCoV) begins its life cycle by binding its viral particle via a two-component protein (glycoprotein), which is encoded by the S-segment of the virus genome with ACE2 receptor on the target cell.
ACE2 has been found to have affinity for the S-glycoproteins of several corona-viruses, including the SARS-CoV and SARS-CoV-2 viruses, and is thus the point of entry of the virus into the cell. Moreover, it is suggested that SARS-CoV-2 infection can, by suppressing ACE2, lead to toxic excessive accumulation of angiotensin 2 and bradykinin, which causes acute respiratory distress syndrome, pulmonary edema and myocarditis, and severe systemic microcirculatory disorders.
Old age, diabetes, hypertension, and obesity are the risk factors for complications development in patients with COVID-19. At the same time, diabetes itself is associated with various complications, primarily microvascular.
Takin in account the current situation, diabetologists are more than ever faced with the task of timely identification of risk factors for the development of these complications of diabetes, their prevention and evaluation of the therapy effectiveness.
