Диагностика и медикаментозная терапия нейрогенных расстройств мочеиспускания
- Аннотация
- Статья
- Ссылки
В последние годы опубликованы данные о роли денервации и реиннервации поперечно-полосатых мышечных структур и, в частности, наружных сфинктеров уретры и ануса в развитии недержания мочи. По результатам исследований предложена также унифицированная нейрогенная теория данного заболевания [12]. По некоторым данным, у 20–50% больных недержанием мочи выявляются скрытые денервационные нарушения промежности [16]. В числе прочих возможными причинами хронической тазовой боли и абактериального простатита могут быть повреждения сакрального отдела спинного мозга и пудентального нерва [6, 11, 17].
В последние годы опубликованы данные о роли денервации и реиннервации поперечно-полосатых мышечных структур и, в частности, наружных сфинктеров уретры и ануса в развитии недержания мочи. По результатам исследований предложена также унифицированная нейрогенная теория данного заболевания [12]. По некоторым данным, у 20–50% больных недержанием мочи выявляются скрытые денервационные нарушения промежности [16]. В числе прочих возможными причинами хронической тазовой боли и абактериального простатита могут быть повреждения сакрального отдела спинного мозга и пудентального нерва [6, 11, 17].

Введение
Недержание мочи, хроническая задержка мочеиспускания, постоянная ирритативная симптоматика в значительной степени ухудшают результаты оперативного лечения пациентов с заболеваниями простаты. Частота возникновения недержания мочи после ТУР гиперплазированной простаты, по данным разных авторов, составляет 10–26%, при радикальной позадилонной простатэктомиии – от 18 до 47%. Причинами нарушений мочеиспускания после радикальной простатэктомии могут быть погрешности операции, стриктуры пузырно-уретрального анастомоза, повреждения сфинктера уретры, а также дорсолатеральных сосудисто-нервных пучков [18, 19].
Игольчатая электромиография (ЭМГ) является методом объективного исследования биоэлектрической активности мышц тазового дна. Игольчатая ЭМГ позволяет судить о регенераторных возможностях мышц промежности, в значительной степени определяющих эффективность консервативной терапии, а также выявить органические невропатии, которые могут являться причинами неэффективности хирургического лечения таких заболеваний, как стрессовое недержание мочи.
В отличие от крупных соматических мышц, двигательные элементы тазового дна имеют сравнительно малые размеры и труднодоступны для изучения. На сегодняшний день имеются только единичные сообщения об исследованиях функционального состояния мышц тазового дна, при этом представленные результаты неоднозначны. Не до конца отработана нормативная база для изучения мышц промежности, нет достаточного числа примеров типичных нарушений, позволяющих провести статистическую обработку данных о патологических состояниях мышц при различных расстройствах мочеиспускания.
Время центрального моторного проведения (ВЦМП) – устойчивый и воспроизводимый нейрофизиологический параметр, являющийся показателем проводящей способности кортикоспинального тракта. Расчет ВЦМП производится путем оценки временной разницы вызванных моторных ответов (ВМО) при транскраниальной (ТМС) и сегментарной магнитной стимуляции (СМС). Наименее изучены вопросы проводимости по кортикоспинальному тракту для мышц тазового дна, что не позволяет разработать эффективные лечебные мероприятия в подобных ситуациях.
С появлением в последнее время большого количества новых фармакологических препаратов и альтернативных методов лечения симптомов нижних мочевых путей открываются определенные перспективы в терапии нейрогенных расстройств мочеиспускания. Многие лекарственные средства, помимо воздействия на периферические органы-мишени, обладают также центральными эффектами, не всегда предсказуемыми и желаемыми при лечении пациентов данной категории. Во многих ситуациях терапия нейрогенных расстройств мочеиспускания требует комплексного подхода и динамической замены препаратов в соответствии с особенностями течения заболевания.
Новые методы энергетического воздействия (магнитная и электрическая стимуляция центров мочеиспускания), направленные на стимуляцию центров мочеиспускания, мышц промежности и мочевого пузыря, находятся в стадии разработки, а показания к их использованию требуют дополнительного уточнения. Изучение особенностей иннервации мышц тазового дна, проводящей способности кортикоспинального тракта, роли скрытых денервационных процессов в патогенезе нейрогенных расстройств мочеиспускания, а также возможности лекарственной терапии при подобных заболеваниях определили интерес к настоящему исследованию.
Материал и методы
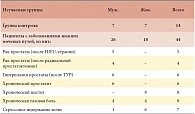
С целью получения объективной картины нейрогенных расстройств мышц промежности и разработки нормативной базы нами обследовано 14 здоровых добровольцев, не имеющих заболеваний нижних мочевых путей нейрогенного или воспалительного характера, ранее не подвергавшихся оперативному лечению, а также 44 пациента с заболеваниями нижних мочевых путей, сопровождающиеся расстройствами мочеиспускания. Изучаемые группы были сравнимы по возрасту (средний возраст 37,6 ± 9,5 лет) и половому распределению (табл. 1). Кроме того, нами обследовано 15 пациентов, которые в сроки от 3 до 12 месяцев перенесли операции по поводу заболеваний простаты: ТУР гиперплазированной простаты (n = 6), радикальную позадилонную простатэктомию (n = 4) , ТУР HIFU при раке простаты (n = 5). Все обследованные пациенты были не удовлетворены результатами проведенного лечения в связи с имеющимися нарушениями мочеиспускания, снижающими качество жизни.
У всех женщин, участвующих в исследовании, отсутствовали травматические повреждения гениталий, воспалительные заболевания мочевых путей и полового тракта, а степень опущения стенок влагалища была не выше первой. У мужчин с синдромом хронической тазовой боли исключены воспалительные заболевания простаты и нижних мочевых путей. Пациенты, перенесшие лечение по поводу рака простаты, не имели клинического или биохимического рецидива заболевания. Обследование пациентов включало сбор анамнеза, изучение дневника мочеиспускания, физикальное обследование, а также оценка кожной чувствительности и сакральных рефлексов. Степень нарушения мочеиспускания и качество жизни оценивалось с помощью опросников IPSS QOL. Проходимость уретры оценивалась с помощью лучевых, эндоскопических, уродинамических исследований.
Игольчатая ЭМГ мышц промежности, формирующих диафрагму таза и участвующих в образовании замыкательного аппарата уретры, проводилась на миографе Keypoint Workstation (Дания). Были использованы игольчатые электроды той же фирмы с длиной стальной канюли 20 мм и внешним диаметром 0,45 мм. Пропускная способность частот усилителя находилась в интервале от 2 Гц до 10 кГц. Регистрировались величины параметров потенциалов действия мышечных единиц (ПДЕ) – средняя длительность и амплитуда ПДЕ, число полифазных потенциалов, а также наличие/отсутствие спонтанной (денервационной) активности мышечных волокон (потенциалов фибрилляций и положительных острых волн). Было изучено функциональное состояние наружного сфинктера ануса, m. levator ani (m. puborectalis, m. pubococcygeus, m. iliococcygeus), m. bulbospongiosus, наружного сфинктера уретры, m. ischiocavernosus. ЭМГ проводилась с двух сторон, для оценки симметричности денервационных изменений. Проводимость кортикоспинального тракта оценивалась путем ТМС с регистрацией ВМО мышц конечностей и промежности.
Результаты
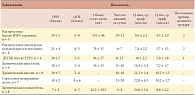
В контрольной группе (n = 14) данные основных изучаемых ЭМГ-показателей – латентность коркового и сегментарного ВМО, ВЦМП, средней амплитуды и длительности ПДЕ – находились в пределах нормы. Различий по стороне исследования и по половой принадлежности не отмечено: нормативные показатели не отличаются в мышечных элементах справа и слева (обычно процессы денервации бывают несимметричными с преобладанием стороны поражения). Большинство ПДЕ имеют простую форму и представлены трехфазными колебаниями. Полифазия не превышала 5–6%. Результаты исследований для разных мышц были сопоставимы. В таблице 2 приведены изученные параметры для m. puborectalis. Характеристики мочеиспускания в группе пациентов с заболеваниями нижних мочевых путей (n = 44) представлены на табл. 3. У 5 пациентов мочевой пузырь постоянно дренируется. Необходимо отметить, что у пациентов с отсутствием самостоятельного мочеиспускания при эндоскопических и лучевых исследованиях нарушения проходимости уретры не выявлено.
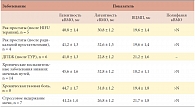
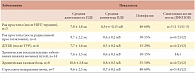
Анализ результатов ЭМГ у обследованных пациентов показал увеличение средней длительности и снижение амплитуды ПДЕ, а также выраженную полифазию, значительно превосходящую нормативные показатели. У пациентов с хроническими воспалительными заболеваниями нижних мочевых путей отмечены аналогичные изменения иннервации мышц тазового дна и проводимости кортикоспинального тракта. Наличие высокочастотных, полифазных ПДЕ является признаком реиннервации. Появление потенциалов фибрилляции и положительных острых волн (ПФ, ПОВ) свидетельствует о спонтанной активности мышечных волокон, то есть денервации. При ТМС отмечены нарушения проведения по кортикоспинальному тракту. Латентность коркового и сегментарного ВМО увеличена более чем на 10%, ВЦМП удлинено у всех пациентов более чем на 20% при сниженной амплитуде ПДЕ. Результаты нейрофизиологического исследования приведены в таблице 4, 5.
Наиболее значимым показателем при ЭМГ-исследовании оказалась спонтанная активность мышечных волокон и полифазия потенциалов двигательных единиц, свидетельствующие о текущем денервационном процессе. Так, у пациентов, обследованных через 3-6 месяцев после оперативного лечения по поводу опухолевых заболеваний простаты, наличие денервационных изменений можно связать как с неполным восстановлением иннервации после операции, так и воздействием HIFU-терапии на нервно-мышечную передачу. Наименьшие показатели спонтанной активности отмечены у лиц с ДГПЖ, что говорит об отработанности оперативного вмешательства и малой выраженности травматических осложнений.
У пациентов с хронической тазовой болью в большинстве случаев обнаружены изменения ПДЕ и состояния мышечных волокон по невритическому типу, о чем свидетельствует повышение средних значений амплитуды и длительности на фоне текущего денервационно-реиннервационного процесса (ПФ и ПОВ). Дополнительное обследование периферических нервов показало, что в 40% случаев у пациентов с хронической тазовой болью выявляется скрытая полиневропатия в нервах конечностей. Необходимо отметить, что во время предварительного отбора пациенты с вероятным наличием невропатии на фоне метаболических заболеваний (диабет, алкоголизм и др.) были исключены из исследования. Полученные данные послужили поводом для углубленного неврологического обследования, при котором в 6 случаях выявлены органические заболевания поясничного отдела позвоночника, требующие специализированного лечения.
Результаты, полученные у больных недержанием мочи, приближались к таковым у больных с хронической тазовой болью – в большинстве случаев имелись признаки текущего денервационно-реиннервационного процесса. Наименьшие ЭМГ-изменения отмечены у пациентов с хроническими воспалительными изменениями нижних мочевых путей. В исследованных мышцах тазового дна не было выявлено денервационных изменений и существенной перестройки ПДЕ, что свидетельствует об отсутствии значимых изменений на уровне периферических нервов и мышц, а значит, в развитии выявленных нарушений мочеиспускания отсутствует нервно-мышечная составляющая.
В комплексной терапии расстройств мочеиспускания у пациентов вышеуказанных групп при выявлении существенных расстройств иннервации мышц тазового дна и проводимости по кортико-спинальному тракту мы применяли препараты, улучшающие питание нервной ткани. Чаще всего назначались препараты тиоктовой (α-липоевой) кислоты, например Берлитион® 300 в дозировке 600 мг/сутки. Тиоктовая кислота, являясь эндогенным антиоксидантом, помимо позитивного влияния на нервную ткань, стимулирует липидный и углеводный обмен, оказывает гепатопротекторное, гиполипидемическое, гипохолестеринемическое и гипогликемическое действие. Препарат назначался однократно внутривенно в течение 1 месяца, затем перорально в течение 3–4 месяцев.
При выявлении преобладающих нарушений нервно-мышечной передачи назначались препараты, улучшающие проведение нервных импульсов, повышающие тонус поперечно-полосатых мышц – калимин, нейромидин в суточной дозировке 40–60 мг. Продолжительность терапии составляла не менее 2 месяцев. На фоне проводимого лечения у пациентов, перенесших оперативные вмешательства по поводу заболеваний простаты, значительно улучшились параметры мочеиспускания, качество жизни больных, уменьшился объем остаточной мочи. У 3 пациентов самостоятельное мочеиспускание восстановилось, что позволило избавить больных от дренажей. У пациентов с хронической тазовой болью выраженность болевых ощущений заметно снизилась.
Заключение
В последние годы опубликованы данные о роли денервации и реиннервации поперечно-полосатых мышечных структур и, в частности, наружных сфинктеров уретры и ануса в развитии недержания мочи. По результатам исследований предложена также унифицированная нейрогенная теория данного заболевания [12]. По некоторым данным, у 20–50% больных недержанием мочи выявляются скрытые денервационные нарушения промежности [16]. В числе прочих возможными причинами хронической тазовой боли и абактериального простатита могут быть повреждения сакрального отдела спинного мозга и пудентального нерва [6, 11, 17].
