количество статей
6855
Загрузка...
Пожалуйста, авторизуйтесь:
Исследования
Гомоцистеин, фолаты и исходы беременности
"ЭФФЕКТИВНАЯ ФАРМАКОТЕРАПИЯ. Акушерство и гинекология" № 2
- Аннотация
- Статья
- Ссылки
- English
Авторами было проведено исследование с целью оценки взаимосвязи между концентрациями фолата/гомоцистеина в крови матери и/или в пуповинной крови и нежелательными исходами беременности. Исследуемую популяцию составила случайная выборка женщин с одноплодной беременностью (n = 227). Измеряли общий уровень гомоцистеина и фолиевой кислоты в крови матери и пуповинной крови при родах. Наблюдалась тенденция к существенному снижению концентрации фолатов в крови беременных, родивших преждевременно, по сравнению с группой женщин, рожавших в срок (медиана (95% доверительный интервал) 14,4 (3,6–73) и 25 (7,3–105,5) соответственно, р < 0,01). У женщин с преэклампсией по сравнению с нормотензивной группой был существенно выше уровень общего гомоцистеина крови (7,9 (1,7–28,2) и 5,9 (1,8–14,6) мкмоль/мл соответственно, р < 0,05) и пуповинной крови (5,8 (2,6–14,4) и 4,2 (0,7–7,9) нг/мл соответственно, р < 0,05). Низкая концентрация фолатов в сыворотке крови беременных коррелирует с преждевременными родами, а высокая концентрация гомоцистеина в плазме беременных – с преэклампсией.
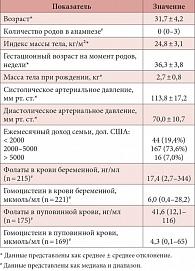
Таблица 1. Значения клинических и биохимических показателей (n = 227)

Таблица 2. Концентрации общего гомоцистеина и фолатов в соответствии с исходами беременности (преждевременные роды, преэклампсия, диабет беременных)

Таблица 3. Концентрации общего гомоцистеина и фолатов в соответствии с исходами беременности (предлежание плаценты, отслойка плаценты, низкая масса тела плода)

Таблица 4. Параметры, коррелирующие с преждевременными родами и преэклампсией в модели множественной логистической регрессии
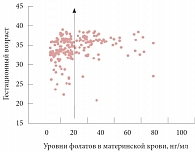
Уровни фолатов в материнской крови, нг/мл
Введение
Роль фолиевой кислоты при беременности впервые рассмотрели C.V. Moore и соавт. (1945), описав случай лечения злокачественной анемии у беременной с помощью фолиевой кислоты [1]. В 1964 г. B.M. Hibbard связал дефицит фолиевой кислоты с анемией, самопроизвольными абортами и отслойкой плаценты. Позднее он предположил, что выкидыш и нарушения развития плода могут быть вызваны экспериментально путем индуцирования дефицита фолиевой кислоты [2]. Годом позже E.D. Hibbard и R.W. Smithells высказали мнение о наличии причинно-следственной связи между нарушением метаболизма фолатов и нарушением развития плода [3]. В 1990-е гг. значение фолиевой кислоты в предотвращении дефектов развития нервной трубки было подтверждено двумя независимыми рандомизированными контролируемыми исследованиями [4, 5]. Фолиевая кислота служит донором моноуглеродной группы для реакций метилирования и синтеза нуклеиновых кислот, тем самым кислота вносит вклад в созревание яйцеклетки и формирование плаценты [6]. Гомоцистеин – тиолсодержащая аминокислота – также считается фактором риска развития сосудистых заболеваний плаценты [7, 8]. Фолиевая кислота необходима для реметилирования гомоцистеина в метионин, который является важным эпигенетическим фактором активации гена [9]. Именно поэтому в настоящее время внимание исследователей привлекает вопрос взаимосвязи уровня фолиевой кислоты и/или гомоцистеина и развития патологий беременности (преэклампсия, отслойка плаценты, преждевременные роды, низкая масса тела плода для данного гестационного возраста). Однако в отличие от данных о взаимосвязи уровня фолатов с развитием дефектов нервной трубки, результаты исследований взаимосвязи уровня фолиевой кислоты и/или гомоцистеина с патологией беременности противоречивы [10–13]. Нами было проведено исследование для установления связи между концентрациями фолата/гомоцистеина в крови беременных и/или в пуповинной крови и нежелательными исходами беременности.
Материалы и методы
Участницы
Проведено межгрупповое исследование для оценки связи между уровнем фолатов и гомоцистеина в крови беременной/плода и исходами беременности. В исследование были включены женщины с одноплодной беременностью, поступившие в период с 1 июня 2009 г. по 13 июня 2010 г. в отделение высокоспециализированной медицинской помощи клиники «Анам» Корейского университета и согласившиеся на исследование (n = 227). Женщины с многоплодной беременностью и пренатально диагностированными нарушениями развития в исследование не включались. Исследование было одобрено Экспертным советом медицинского центра при Корейском университете.
При поступлении в родовую палату производился забор образцов крови, женщины заполняли анкету по анамнезу, включая информацию о приеме препаратов фолиевой кислоты; после рождения ребенка, но до рождения плаценты забирали образцы пуповинной крови. Часть образцов были непригодны для исследования из-за гемолиза, несколько образцов пуповинной крови не были забраны из-за неотложного клинического состояния. Концентрация общего фолата и гомоцистеина в крови беременных женщин была измерена в 215 и 221 случаях и в пуповинной крови – в 175 и 169 случаях соответственно.
Конечные точки исследования
Для оценки взаимосвязи между уровнем фолата/гомоцистеина и исходами беременности сопоставляли уровни фолата и гомоцистеина в зависимости от исходов беременности, таких как преждевременные роды, преэклампсия, диабет беременных, низкая масса плода для данного гестационного возраста, отслойка плаценты и предлежание плаценты.
Преждевременные роды определяли как роды, наступившие до 37-й недели гестации, преэклампсию – как наличие гипертонии после 20-й недели гестации и протеинурии (≥ 300 мг/24 ч). Диабет беременных диагностировали по результатам теста на толерантность к глюкозе (при пероральном приеме 100 г глюкозы) в соответствии с критериями Американской диабетической ассоциации (American Diabetes Association – ADA). Низкую массу тела плода определяли как массу тела ниже 10-го процентиля для гестационного возраста.
Всего было зарегистрировано 97 случаев преждевременных родов, 18 случаев преэклампсии, 19 случаев низкой массы плода для данного гестационного возраста, 13 случаев предлежания плаценты, 10 случаев отслойки плаценты и 30 случаев низкой массы тела.
Образцы крови женщин отбирали при поступлении в родовую палату. Концентрацию общего гомоцистеина плазмы измеряли с помощью автоматизированного ферментативного метода с использованием гомоцистеинметилтрансферазы, оксидазы D-аминокислот (TOSHIBA 200FR-NEO автоанализатор; Toshiba Medical Systems Co. Ltd., Токио, Япония). Уровень фолата измеряли радиоиммунологическим методом с использованием йода-125 (Cobra II 5010; Packard, Meriden, Коннектикут, США).
Анализ данных
Для сравнения групп использованы Т-критерий Стьюдента, U-критерий Манна – Уитни и критерий хи-квадрат (Пирсона). Проведен множественный регрессионный анализ с учетом других искажающих факторов, таких как возраст беременной, количество родов в анамнезе, индекс массы тела беременной, социально-экономический статус и дополнительный прием фолиевой кислоты. Статистический анализ проведен с помощью программы Stats-Direct, версия 2.7.8 (StatsDirect Ltd., Чешир, Великобритания), в качестве уровня значимости во всех тестах использовано значение р < 0,05.
Результаты
Средний возраст включенных в исследование беременных женщин составил 31,7 лет, а средний индекс массы тела – 24,8 кг/м². Медианы (диапазон) концентраций фолатов и гомоцистеина у беременных женщин составили 17,4 (2,7–344) нг/мл и 6,0 (0,4–28,2) мкмоль/мл соответственно. Медианы (диапазон) концентраций фолатов и гомоцистеина в пуповинной крови составили 41,6 (12,1–116) нг/мл и 4,3 (0,1–65) мкмоль/мл соответственно (табл. 1).
Концентрация фолатов в крови женщин с преждевременными родами была существенно выше по сравнению с группой женщин, родивших в срок (медиана (95% доверительный интервал (ДИ)) 14,4 (3,6–73) и 25 (7,3–105,5) соответственно, р < 0,01). У женщин с преэклампсией по сравнению с нормотензивной группой был существенно выше уровень общего гомоцистеина крови (7,9 (1,7–28,2) и 5,9 (1,8–14,6) мкмоль/мл соответственно, р < 0,05) и пуповинной крови (5,8 (2,6–14,4) и 4,2 (0,7–7,9) нг/мл соответственно, р < 0,05). Остальные исходы беременности не зависели от концентраций общего гомоцистеина или фолатов (табл. 2 и 3). При анализе с использованием порогового значения 20 нг/мл фолата сыворотки риск преждевременных родов значимо возрастал в группе с низким содержанием фолатов (< 20 нг/мл) по сравнению с более высоким уровнем фолатов (≥ 20 нг/мл) (отношение шансов (ОШ) 3,3; 95% ДИ 1,8–59, р < 0,01) (рисунок).
Нами проведен множественный регрессионный анализ с учетом других искажающих факторов, таких как возраст беременной, количество родов в анамнезе, индекс массы тела беременной, доход семьи и прием препаратов фолиевой кислоты. При наличии данных о концентрации фолатов/гомоцистеина в крови беременной/пуповинной крови они также включались в модель. На основании данного исследования риск преждевременных родов снижался с увеличением концентрации фолатов в крови беременной женщины (коэффициент корреляции (β) = -0,019; ОШ 0,98; 95% ДИ 0,96–0,99, р = 0,02). Риск преэклампсии положительно коррелировал с концентрацией гомоцистеина в крови беременной женщины (β = 0,149; ОШ 1,16; 95% ДИ 1,02–1,31, р = 0,01) (табл. 4).
Обсуждение
Фолат синтезируется растениями и микроорганизмами в форме полиглутамата. Обычно фолаты редуцируются до тетрагидрофолата или дигидрофолата и имеют моноуглеродную группу (метил-, метилен-, метинил-, формил- или формиминогруппу) в положении 5 или 10 или в обоих. Фолаты участвуют в различных реакциях переноса моноуглеродных групп, включая биосинтез пурина и тимидилата, метаболизм аминокислот и окисление формиатов [14]. Биосинтез пурина и тимидилата – фундаментальный обязательный процесс в синтезе ДНК и РНК. Гомоцистеин метаболизируется до метионина, этот процесс зависит от фолатного статуса и 5,10-метилентетрагидрофолатредуктазы (methylenetetrahydrofolate reductase – MTHFR).
Известно, что прием препаратов фолиевой кислоты до зачатия может предотвратить развитие дефектов нервной трубки [4, 5]. Однако необходимость приема фолиевой кислоты после первого триместра беременности все еще обсуждается, особенно в отношении развития осложнений беременности. В акушерстве проводились исследования взаимосвязи фолиевой кислоты и гомоцистеина с различными исходами беременности (преэклампсия, отслойка плаценты, ранний выкидыш, преждевременные роды, низкая масса плода и мертворождение [15–19]). Противоречивые результаты исследований могут ввести в заблуждение не только акушеров, но и беременных женщин. Мы попытались уточнить взаимосвязь между фолатным статусом при беременности и исходами беременности путем оценки уровня фолатов и гомоцистеина в крови беременных и в пуповинной крови.
В настоящем исследовании концентрация фолатов в крови беременных была существенно ниже в группе женщин, родивших преждевременно, что согласуется с данными других авторов. T.O. Scholl и соавт. (1996) установили влияние приема препаратов фолиевой кислоты на концентрации фолатов в сыворотке и на исходы беременности [18]. В частности, у беременных женщин с низким средним суточным приемом фолатов (≤ 240 мкг/сут) риск преждевременных родов увеличивался вдвое. Более низкие концентрации фолатов в сыворотке на 28-й неделе гестации также были связаны с более высоким риском преждевременных родов и более низкой массой тела ребенка при рождении. A.M. Siega-Riz и соавт. (2004) сообщали, что низкие уровни фолатов во втором триместре беременности связаны с более высоким риском преждевременных родов [20].
В исследовании, включившем 34 480 женщин с одноплодной беременностью из группы низкого риска осложнений, показано, что прием фолатов в период планирования беременности коррелирует со снижением частоты ранних преждевременных родов на 50–70% [10]. Однако не было выявлено связи между приемом фолатов и другими осложнениями, в том числе преэклампсией, низкой массой тела плода и отслойкой плаценты. В другом когортном исследовании изучалась эффективность продолжительного приема препаратов фолиевой кислоты после первого триместра беременности [11]. Было установлено, что прием фолиевой кислоты в третьем триместре беременности связан с увеличением срока вынашивания на 0,6 недели и существенным сокращением доли преждевременных родов. S.C. Hong и соавт. (2011) провели исследование в одном центре высококвалифицированной медицинской помощи. Ученые установили, что риск преждевременных родов значимо увеличивался в группе женщин с низким уровнем фолатов (< 20 нг/мл) по сравнению с группой женщин с более высоким уровнем фолатов, хотя эти данные не были значимыми [21].
Уровни гомоцистеина, тиолсодержащей аминокислоты, отражают статус фолиевой кислоты [22]. R.P. Steegers-Theunissen и соавт. (1991) [23] предположили, что нарушение метаболизма гомоцистеина может приводить к дефектам нервной трубки, наблюдая, что концентрации гомоцистеина были выше у матерей, родивших детей с дефектами нервной трубки [24]. Связь гомоцистеина с другими исходами беременности (низкая масса тела ребенка при рождении, невынашивание беременности, отслойка плаценты и преэклампсия) также была изучена в ряде исследований [15–17, 25, 26].
В популяционном исследовании в Норвегии повышенные концентрации общего гомоцистеина были связаны с высокой частотой осложнений беременности, включая преэклампсию, отслойку плаценты, преждевременные роды и низкую массу тела ребенка при рождении. Однако временной интервал между исходами и измерением уровня гомоцистеина был более 10 лет.
В данном исследовании показано, что концентрации гомоцистеина в крови беременных связаны с риском преэклампсии, и эти результаты согласуются с данными других работ [25, 27, 28]. При преэклампсии также увеличивалась концентрация общего гомоцистеина в пуповинной крови, хотя и статистически не значимо при множественном регрессионном анализе. Установлена связь высоких уровней гомоцистеина с другими окклюзионными сосудистыми заболеваниями, а повышенная концентрация гомоцистеина может вносить вклад в развитие преэклампсии с тем же патогенезом. В нашем исследовании наблюдалась положительная корреляция между концентрациями фолатов в крови беременной и в пуповинной крови (r = 0,32, р < 0,05) и слабая отрицательная корреляция между концентрациями фолатов и гомоцистеина в пуповинной крови (r = -0,18, р < 0,05). Это позволяет предположить, что уровни фолатов и гомоцистеина у плода могут находиться под воздействием уровня фолатов в крови беременной и патологических состояний беременной.
Есть данные о том, что концентрации гомоцистеина в плазме увеличиваются с возрастом, демонстрируя небольшие сезонные различия [29, 30], и зависят от курения и употребления кофе [31]. Во время беременности концентрация гомоцистеина снижается более чем на 30% в первом триместре и достигает наименьшего значения во втором триместре [29, 32, 33]. К возможным причинам такого снижения концентраций относят влияние гормонов беременности, метаболизм гомоцистеина у плода и увеличение объема плазмы при беременности. В связи с низкой частотой курения в обследуемой популяции в наше исследование не вошли курящие женщины. В данном исследовании измерения концентраций фолатов и гомоцистеина в крови беременных проведены в ходе второго и третьего триместров беременности. Для исключения потенциальной систематической ошибки при оценке взаимосвязи гомоцистеина и исходов беременности в будущих исследованиях измерения могут проводиться в определенные периоды времени, предпочтительнее в период до беременности.
Из-за возрастающей потребности в фолиевой кислоте при беременности без приема соответствующих препаратов уровень сывороточной фолиевой кислоты постепенно снижается. Таким образом, слишком короткий интервал между беременностями для восстановления фолатного статуса может стать фактором риска неблагоприятного исхода беременности или осложнений. В настоящем исследовании мы не учитывали интервал между беременностями, и это могло послужить возможным искажающим фактором.
Существует несколько гипотез, объясняющих профилактическое действие фолатов в отношении преждевременных родов. Одно из объяснений заключается в том, что недостаточное употребление фолатов связано с низким социально-экономическим статусом. Кроме того, низкая концентрация фолатов ведет к гипергомоцистеинемии, что в свою очередь может вызывать эндотелиальные дисфункции плаценты [7, 8]. В пользу этой гипотезы говорят данные о том, что гипергомоцистеинемия является фактором, вызывающим устойчивость к токолитической терапии [34]. Наконец, фолиевая кислота может участвовать в стимуляции иммунной функции или супрессии воспалительных процессов, что может объяснять связь между фолиевой кислотой и преждевременными родами [35, 36].
Проведенное нами исследование имеет ряд недостатков. Во-первых, это поперечное исследование беременных женщин: причинно-следственная связь остается не ясной. Для оценки причинно-следственной связи измерения показателей должны были быть запланированы на период до зачатия или на ранних сроках беременности. Во-вторых, в исследование вошло много пациенток с высоким риском осложненного течения беременности, наблюдающиеся в центре высокоспециализированной медицинской помощи. Исследуемая группа не отражает общую популяцию. В-третьих, были исследованы не все данные из-за гемолиза образцов или неполного забора крови ввиду неотложной ситуации. Однако достоинством данного исследования является то, что это первое исследование по сопоставлению уровней фолатов/гомоцистеина в крови беременной и плода и различных исходов беременности в одном центре высокоспециализированной медицинской помощи.
Хотя предполагается, что польза приема препаратов фолиевой кислоты доказана, результаты клинических исследований недостаточно однозначны. Путем измерения концентраций фолатов и гомоцистеина в крови беременных женщин и в пуповинной крови нами была продемонстрирована связь статуса фолатов и гомоцистеина с исходами беременности; в частности, связь низкой концентрации фолатов с преждевременными родами и повышение концентрации гомоцистеина в крови беременных с преэклампсией. Эти результаты подтверждают, что длительный прием фолатов при беременности оказывает положительное влияние на исход беременности. Надеемся, что эти результаты будут способствовать лучшему пониманию роли фолиевой кислоты при беременности.
Благодарности
Данное исследование выполнено в рамках гранта № К1031741 Медицинского колледжа при Корейском университете и гранта (А090858) Проекта исследования и развития здравоохранения Министерства здравоохранения и социального обеспечения Республики Корея. Ни одна фармацевтическая компания не участвовала в исследовании.
Заявление о наличии конфликта интересов. У авторов нет конфликта интересов. Только авторы несут ответственность за содержание и написание статьи.
1. Moore C.V., Bierbaum O.S., Welch A.D. et al. The activity of synthetic Lactobacillus casei factor (folic acid) as an anti-pernicious anemia substance. Observations on four patients: two with Addisonian pernicious anemia, one with non-tropical sprue and one with pernicious anemia of pregnancy // J. Lab. Clin. Med. 1945. Vol. 30. P. 1056–1069.
2. Hibbard B.M. The role of folic acid in pregnancy; with particular reference to anaemia, abruption and abortion // J. Obstet. Gynaecol. Br. Commonw. 1964. Vol. 71. P. 529–542.
3. Hibbard E.D., Smithells R.W. Folic acid metabolism and human embryopathy // Lancet. 1965. Vol. 285. № 7398. P. 1254.
4. Prevention of neural tube defects: results of the Medical Research Council Vitamin Study / MRC Vitamin Study Research Group // Lancet. 1991. Vol. 338. № 8760. P. 131–137.
5. Czeizel A.E., Dudas I. Prevention of the first occurrence of neural-tube defects by periconceptional vitamin supplementation // N. Engl. J. Med. 1992. Vol. 327. № 26. P. 1832–1835.
6. Jongbloet P.H., Verbeek A.L., Den Heijer M. et al. Methylenetetrahydrofolate reductase (MTHFR) gene polymorphisms resulting in suboptimal oocyte maturation: a discussion of folate status, neural tube defects, schizophrenia, and vasculopathy // J. Exp. Clin. Assist. Reprod. 2008. Vol. 5. P. 5.
7. Van der Molen E.F., Verbruggen B., Novakova I. et al. Hyperhomocysteinemia and other thrombotic risk factors in women with placental vasculopathy // BJOG. 2000. Vol. 107. № 6. P. 785–791.
8. Roberts J.M., Taylor R.N., Goldfien A. Clinical and biochemical evidence of endothelial cell dysfunction in the pregnancy syndrome preeclampsia // Am. J. Hypertens. 1991. Vol. 4. № 8. P. 700–708.
9. Molloy A.M., Daly S., Mills J.L. et al. Thermolabile variant of 5,10-methylenetetrahydrofolate reductase associated with low red-cell folates: implications for folate intake recommendations // Lancet. 1997. Vol. 349. № 9065. P. 1591–1593.
10. Bukowski R., Malone F.D., Porter F.T. et al. Preconceptional folate supplementation and the risk of spontaneous preterm birth: a cohort study // PLoS Med. 2009. Vol. 6. № 5. ID e1000061.
11. Czeizel A.E., Puhó E.H., Langmar Z. et al. Possible association of folic acid supplementation during pregnancy with reduction of preterm birth: a population-based study // Eur. J. Obstet. Gynecol. Reprod. Biol. 2010. Vol. 148. № 2. P. 135–140.
12. De Weerd S., Steegers-Theunissen R.P., de Boo T.M. et al. Maternal periconceptional biochemical and hematological parameters, vitamin profiles and pregnancy outcome // Eur. J. Clin. Nutr. 2003. Vol. 57. № 9. P. 1128–1134.
13. Charles D.H., Ness A.R., Campbell D. et al. Folic acid supplements in pregnancy and birth outcome: re-analysis of a large randomised controlled trial and update of Cochrane review // Paediatr. Perinat. Epidemiol. 2005. Vol. 19. № 2. P. 112–124.
14. Tamura T., Picciano M.F. Folate and human reproduction // Am. J. Clin. Nutr. 2006. Vol. 83. № 5. P. 993–1016.
15. Burke G., Robinson K., Refsum H. et al. Intrauterine growth retardation, perinatal death, and maternal homocysteine levels // N. Engl. J. Med. 1992. Vol. 326. № 1. P. 69–70.
16. Steegers-Theunissen R.P., Boers G.H., Blom H.J. et al. Hyperhomocysteinaemia and recurrent spontaneous abortion or abruption placentae // Lancet. 1992. Vol. 339. № 8801. P. 1122–1123.
17. Wouters M.G., Boers G.H., Blom H.J. et al. Hyperhomocysteinemia: a risk factor in women with unexplained recurrent early pregnancy loss // Fertil. Steril. 1993. Vol. 60. № 5. P. 820–825.
18. Scholl T.O., Hediger M.L., Schall J.I. et al. Dietary and serum folate: their influence on the outcome of pregnancy // Am. J. Clin. Nutr. 1996. Vol. 63. № 4. P. 520–525.
19. Vollset S.E., Refsum H., Irgens L.M. et al. Plasma total homocysteine, pregnancy complications, and adverse pregnancy outcomes: the Hordaland Homocysteine Study // Am. J. Clin. Nutr. 2000. Vol. 71. № 4. P. 962–968.
20. Siega-Riz A.M., Savitz D.A., Zeisel S.H. et al. Second trimester folate status and preterm birth // Am. J. Obstet. Gynecol. 2004. Vol. 191. № 6. P. 1851–1857.
21. Hong S.C., Ha E.H., Han J.Y. et al. The relationship between folic acid supplementation and serum folate level in early pregnancy and pregnancy outcomes: MOCEH (Mothers and Children’s Environmental Health) study // J. Popul. Ther. Clin. Pharmacol. 2011. Vol. 18. № 2. P. e344.
22. Miller J.W., Nadeau M.R., Smith D. et al. Vitamin B-6 defieciency vs folate deficiency: comparison of responses to methionine loading in rats // Am. J. Clin. Nutr. 1994. Vol. 59. № 5. P. 1033–1039.
23. Steegers-Theunissen R.P., Boers G.H., Trijbels F.J. et al. Neural-tube defects and derangement of homocysteine metabolism // N. Engl. J. Med. 1991. Vol. 324. № 3. P. 199–200.
24. Mills J.L., McPartlin J.M., Kirke P.N. et al. Homocysteine metabolism in pregnancies complicated by neural-tube defects // Lancet. 1995. Vol. 345. № 8943. P. 149–151.
25. Dekker G.A., De Vries J.I., Doelitzsch P.M. et al. Underlying disorders associated with severe early-onset preeclampsia // Am. J. Obstet. Gynecol. 1995. Vol. 173. № 4. P. 1042–1048.
26. Goddijn-Wessel T.A., Wouters M.G., Van de Molen E.F. et al. Hyperhomocysteinemia: a risk factor for placental abruption or infarction // Eur. J. Obstet. Gynecol. Reprod. Biol. 1996. Vol. 66. № 1. P. 23–29.
27. Powers R.W., Evans R.W., Majors A.K. et al. Plasma homocysteine concentration is increased in preeclampsia and is associated with evidence of endothelial activation // Am. J. Obstet. Gynecol. 1998. Vol. 179. № 9. P. 1605–1611.
28. Rajkovic A., Mahomed K., Malinow M.R. et al. Plasma homocyst(e)ine concentrations in eclamptic and preeclamptic African women postpartum // Obstet. Gynecol. 1999. Vol. 94. № 3. P. 355–360.
29. Andersson A., Hultberg B., Brattstrom L. et al. Decreased serum homocysteine in pregnancy // Eur. J. Clin. Chem. Clin. Biochem. 1992. Vol. 30. № 6. P. 377–379.
30. Clarke R., Woodhouse P., Ulvik A. et al. Variability and determinants of total homocysteine concentrations in plasma in an elderly population // Clin. Chem. 1998. Vol. 44. № 1. P. 102–107.
31. Nygard O., Refsum H., Ueland P.M. et al. Coffee consumption and plasma total homocysteine: The Hordaland Homocysteine Study // Am. J. Clin. Nutr. 1997. Vol. 65. № 1. P. 136–143.
32. Bonnette R.E., Caudill M.A., Boddie A.M. et al. Plasma homocyst(e)ine concentrations in pregnant and nonpregnant women with controlled folate intake // Obstet. Gynecol. 1998. Vol. 92. № 2. P. 167–170.
33. Walker M.C., Smith G.N., Perkins S.L. et al. Changes in homocysteine levels during normal pregnancy // Am. J. Obstet. Gynecol. 1999. Vol. 180. № 3. Pt. 1. P. 660–664.
34. Celik H., Ayar A., Tug N. Hyperhomocysteinemia may be a resistance factor in tocolytic treatment with beta mimetics // Med. Hypotheses. 2003. Vol. 61. № 5–6. P. 580–582.
35. Christian P., Jiang T., Khatry S.K. et al. Antenatal supplementation with micronutrients and biochemical indicators of status and subclinical infection in rural Nepal // Am. J. Clin. Nutr. 2006. Vol. 83. № 4. P. 788–794.
36. Troen A.M., Mitchell B., Sorensen B. et al. Unmetabolized folic acid in plasma is associated with reduced natural killer cell cytotoxicity among postmenopausal women // J. Nutr. 2006. Vol. 136. № 1. P. 189–194.
Homocysteine, folate and pregnancy outcomes
M.W. Kim, S.-C. Hong, J.S. Choi, J.-Y. Han, M.-J. Oh, H.J. Kim, A. Nava-campo, G. Koren
Korea University College of Medicine, Department of Obstetrics and Gynecology, Seoul, South Korea
Kwandong University College of Medicine, Department of Obstetrics and Gynecology of Cheil Hospital and Women,s Healthcare Center, Seoul, South Korea
Hospital for Sick Children, Division of Clinical Pharmacology and Toxicology, Toronto, Canada
University of Toronto, Department of Pharmacology and Toxicology, Faculty of Medicine, Toronto, Canada
Contact person: Seong-Chul Hong, novak082@naver.com
The purpose of this study is to evaluate the relationship between maternal and/or cord blood folate/homocysteine concentrations and adverse pregnancy outcomes. The study population included a random sample of singleton pregnant women in whom we measured total homocysteine and folic acid in maternal or cord blood at deliveries. A total of 227 pregnant women were enrolled. The concentration of folate in maternal blood tended to be significantly lower in pre-term birth than in full-term delivery group (median (95% CI), 14,4 (3,6–73) vs 25 (7,3–105,5) p < 0,01). The total homocysteine in maternal and cord blood was significantly higher in the pre-eclampsia than in the normotensive group (7,9 (1,7–28,2) vs 5,9 (1,8–14,6) μmol/ml, p < 0,05; and 5,8 (2,6–14,4) vs 4,2 (0,7–7,9) ng/ml, p < 0,05, respectively). Lower maternal serum folate concentration is associated with pre-term delivery and higher maternal plasma homocysteine concentration with pre-eclampsia.
Новости на тему
СТАТЬИ по теме
18.09.2024
Отправить статью по электронной почте
Ваш адрес электронной почты:
Адрес электронной почты получателя:
Разделите несколько адресов электронной почты запятой
Сообщение(не обязательно)
Не более 1500 символов
Анти спам:
Для предотвращения спама, пожалуйста, введите в поле слово, которое видите ниже.
Обновить код
* адреса предоставленные Вами будут использоваться только для отправки электронной почты.
