Ингибиторы ДПП-4: перспектива лечения больных сахарным диабетом типа 2
- Аннотация
- Статья
- Ссылки
Увеличенную потребность в инсулине, вызванную резистентностью периферических тканей, организм компенсирует гиперсекрецией бета-клеток и увеличением их массы, однако, когда секреторная способность становится недостаточной вследствие снижения функции и массы бета-клеток, развивается гипергликемия. Причины прогрессирующей потери бета-клеток при диабете 2 типа недостаточно ясны, но установлено, что в этом процессе важную роль играет окислительный стресс вследствие утраты механизмов антиоксидантной защиты в результате глюкозной и жировой токсичности. В настоящее время установлено, что ранняя относительная функциональная недостаточность бета-клеток поджелудочной железы развивается еще до появления клинических симптомов сахарного диабета 2 типа. Несмотря на наличие множества лекарственных препаратов для терапии СД типа 2, полноценный контроль метаболических нарушений и сохранение функциональной активности β-клеток поджелудочной железы остается недостижимой целью лечения. К счастью, последние исследования свидетельствуют о том, что масса бета-клеток обладает определенной пластичностью, что дает возможность воздействовать на прогрессирование дисфункции бета-клеток и на течение диабета 2 типа в целом. Масса бета-клеток является важнейшим фактором, определяющим количество инсулина, которое может вырабатывать организм. Открытия последних лет изменили наши взгляды на то, как регулируется масса бета-клеток в норме и патологии.
Первое упоминание об участии неких факторов, секретируемых желудочно-кишечным трактом, в регуляции эндокринной секреторной активности относятся к 1906 г. В последующем эти факторы стали называть инкретинами. Взаимосвязь между гастроинтестинальным трактом и эндокринным отделом поджелудочной железы была подтверждена лишь в 1960 г., когда стало возможным определение инсулина в плазме. Исследования секреторного ответа поджелудочной железы путем проведения перорального или внутривенного теста с нагрузкой глюкозой показали, что при одинаковом повышении уровня гликемии секреция инсулина значительно выше при пероральном приеме глюкозы. Эти результаты свидетельствовали о том, что не только взаимодействие глюкозы с b-клеткой островков Лангерганса, но и интестинальные факторы участвуют в стимуляции секреции инсулина (1). В последующем были выделены два пептида, имеющих непосредственное отношение к инкреторному эффекту, получившие следующие названия: глюзозависимый инсулинотропный полипетид (ГИП) и глюкагоно-подобный петид-1 (ГПП-1). Оба пептида выделяются в ответ на пищевую нагрузку и потенцируют глюкозозависимый инсулиновый секреторный ответ. В последующем было показано, что ГПП-1 обладает не только биологической активностью в отношении секреции инсулина b-клетками, но и в определенной степени обусловливает трофическое воздействие, благодаря которому осуществляется их воспроизводство.
ГИП секретируется в виде одной биологически активной формы К-клетками, находящимися преимущественно в верхних отделах тонкого кишечника (двенадцатиперстная кишка и проксимальный отдел тонкого кишечника) в ответ на пероральный прием углеводов и жиров. ГПП-1, ГПП-2 вырабатываются L-клетками эндокринной части преимущественно дистального отдела кишечника. ГПП-1 экспрессируется также a-клетками поджелудочной железы, нейронами определенных отделов головного мозга (гипоталамус, гипофиз, ретикулярное ядро). Несмотря на дистальную локализацию L-клеток в гастроинтестинальном тракте, высвобождение ГПП-1 в циркулирующий кровоток осуществляется в течение нескольких минут от момента приема пищи, что свидетельствует о наличии непрямой нейроэндокринной регуляции секреторного ответа, а не непосредственного влияния нутриентов на L-клетки дистального отдела тонкого кишечника.
Концентрация ГПП-1 и ГИП в плазме в состоянии натощак крайне низки, в то время как после еды их концентрация в крови значительно повышается. Cекреция ГПП-1 в течение дня коррелирует с высвобождением инсулина (4). Действие ГПП-1 является исключительно глюкозозависимым, то есть определяется концентрацией глюкозы. Минимальным пороговым значением гликемии, при котором отсутствует действие ГПП-1 на секрецию инсулина, являются значения около 4,5 ммоль/л. Это означает, что воздействие ГПП-1 на секрецию инсулина не сопряжено с риском развития гипогликемического состояния, поскольку при значениях гликемии, близких к нормальным значениям, оно прекращается. Наряду с непосредственным влиянием на секрецию инсулина, ГПП-1 стимулирует транскрипцию гена инсулина и все этапы биосинтеза инсулина, обеспечивая, таким образом, восполнение запасов инсулина в процессе секреции, когда происходит истощение его запасов (5). ГПП-1 обладает ингибиторным влиянием в отношении секреции глюкагона. Этот эффект инкретина скорее всего опосредован повышением секреции инсулина и соматостатина. При этом следует также учесть прямое воздействие ГПП-1 на секреторную функцию a-клеток, на которых обнаружены рецепторы к ГПП-1. Это влияние ГПП-1 на секрецию глюкагона имеет большое значение в регуляции углеводного обмена. Важно отметить, что ингибирование секреции глюкагона также является глюкозозависимым. Это означает, что назначение ГПП-1 не влияет на контринсулярный ответ a-клеток во время гипогликемии (7).
ГПП-1 оказывает ингибиторное воздействие на секреторную и моторную функцию желудочно-кишечного тракта, особенно это касается времени опорожнения желудка (8). Физиологическая роль ГПП-1 в данном случае сводится к адаптации абсорбционной способности кишечника в отношении продвижения пищевых масс и соответствия этому секреторной активности желудочно-кишечного тракта. В патологических условиях, как имеет место при сахарном диабете, замедление опорожнения желудка представляет интерес с точки зрения замедления постпрандиальных колебаний уровня гликемии.
Другим важным свойством ГПП-1 является влияние на снижение потребления пищи за счет более быстрого достижения чувства насыщения. Здесь задействованы центральные механизмы действия глюкагоноподобного пептида 1. У здоровых лиц внутривенное назначение ГПП-1 приводило к повышенному чувству насыщения и снижению потребления пищевых продуктов (9). Подобный эффект наблюдался и у лиц с избыточным весом и сахарным диабетом (10, 11).
ГПП-1 и ГИП подвергаются деградации ферментом дипептидил-пептидазой IV (ДПП-4), экспрессируемого в эндотелиальных клетках капилляров. Ингибирование фермента ДПП-4 является новой терапевтической тактикой в лечении пациентов с сахарным диабетом 2 типа, связанной с усилением эффектов инкретинов.
Трофическое влияние ГПП-1 на поджелудочную железу
Назначение ГПП-1 в течение длительного периода времени экспериментальным животным с нормальной и нарушенной толерантностью к глюкозе приводило к увеличению массы b-клеток (12). ГПП-1 способствует репликации b-клеток у мышей и стимулирует синтез ДНК in vitro. Он также способствует дифференцировке клеток эпителия протоков поджелудочной железы, являющихся предшественниками b-клеток. Недавние исследования показали замедление апоптоза под влиянием ГПП-1 в отношении выделенной свежей культуры b-клеток человека in vitro (13). Имеющиеся данные позволяют рассматривать использование ГПП-1 в перспективе как потенциально возможный вариант сохранения функции b-клеток у больных СД 2 типа.
Инкретины при сахарном диабете типа 2
Изучению секреторной активности инкретинов посвящены многочисленные исследования. Показано, что уровень ГИП у больных СД находится в пределах нормальных значений как натощак, так и после приема пищи, но при этом у больных СД типа 2 имеет место снижение ответа на ГИП. Уровень ГПП-1 плазмы снижен как у пациентов с СД, так и у лиц с нарушенной толерантностью к глюкозе по сравнению с когортой обследованных, не имеющих нарушений углеводного обмена (14).
Таким образом, исходя из имеющихся на сегодняшний день данных исследований о состоянии секреторной функции инкретинов у больных СД типа 2, можно заключить, что у лиц с нарушением углеводного обмена имеет место снижение секреции ГПП-1 при сохраненной секреции и нарушенном ответе на ГИП; ГПП-1 оказывает глюкозозависимое подавляющее влияние на секрецию глюкагона в ответ на прием пищи.
Перспективы лечения больных СД типа 2
Наличие у ГПП-1 глюкорегуляторных свойств, включающих глюкозозависимое усиление секреции инсулина b-клетками, глюкозозависимое угнетение секреции глюкагона, замедление опорожнения желудка и снижение потребления пищи за счет повышения чувства насыщения после еды, позволяет рассматривать данное направление медикаментозной терапии СД типа 2 как наиболее перспективное. Следует подчеркнуть, что даже при условии жесткого контроля гликемии отсутствует опасность развития тяжелых гипогликемий, учитывая тот факт, что необходимым условием стимуляции секреции инсулина b-клетками является наличие минимального уровня глюкозы (не менее 4,5 ммоль/л). И, наконец, можно предположить, что благодаря трофическому влиянию ГПП-1 в отношении b-клеток, ингибирование ДПП-4 может предотвратить прогрессирующее снижение их активности, а значит прогрессирования заболевания.
ГПП-1 как пептид не может быть назначен перорально, поскольку немедленно подвергается денатурации желудочным соком. При подкожном или внутривенном назначении ГПП-1 подвергается быстрой деградации ферментом дипептидил-пептидазой IV (ДПП-4). В связи с этим в настоящее время разработаны два основных направления возмещения утраченной или сниженной секреции ГПП-1 у больных СД:
-
использование ингибиторов ДПП-4;
-
применение миметиков или аналогов ГПП-1, резистентных к воздействию ДПП-4.
В ходе клинических исследований получены данные об эффективности и безопасности как препаратов, относящихся к ингибиторам ДПП-4 – ситаглиптин (Янувия), так и инкретин-миметиков и аналогов ГПП-1 (экзенатид, лираглютид). Следует отметить, что действие инкретинов обладает глюкозозависимым влиянием в отношении секреции инсулина b-клетками и глюкагона a-клетками. Это означает, что стимуляция высвобождения инсулина из b-клетки и ингибирование высвобождения глюкагона a-клетками происходит только в условиях гипергликемии и прекращается при нормогликемии. Таким образом, риск возникновения гипогликемического состояния при использовании инкретин-миметиков, его аналогов и ингибиторов ДПП-4 минимальный.
Влияние ситаглиптина на массу и функцию β-клеток в исследованиях in vitro и in vivo
Имеются экспериментальные данные, свидетельствующие о том, что ситаглиптин обладает протективным влиянием в отношении культуры β-клеток, достигаемым путем снижения степени развития апоптоза и потенциирования пролиферации новых β-клеток (17, 18, 20).
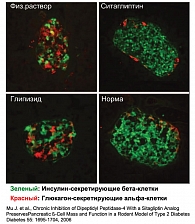
Так, было проведено исследование селективного ингибитора ДПП-4 (ситаглиптина), аналогичного ситаглиптину по влиянию на уровень гликемии, а также функцию и массу β-клеток у мышей со стрептозацин-индуцированным диабетом. В этом исследовании было показано снижение показателей гликемии под влиянием ингибитора ДПП-4 у экспериментальных животных. Нормализация показателей гликемии была связана с дозозависимым увеличением массы β-клеток, увеличением соотношения инсулинсекретирующих β-клеток к общему числу β-клеток и восстановлением нормальной архитектуры островков Лангерганса.
Терапевтический потенциал ингибиторов ДПП-4 оценивали в сравнении с препаратом, стимулирующим высвобождение инсулина, глипизидом, на той же биологической модели. Глипизид – препарат группы производных сульфонилмочевины, назначаемый в медицинской практике для лечения пациентов с сахарным диабетом 2 типа. В исследовании глипизид был одинаково эффективен в сравнении с ситаглиптином в отношении снижения уровня глюкозы у мышей со стрептозацин-индуцированным диабетом, но постепенно эффективность глипизида снижалась. При длительном использовании наблюдалось снижение эффективности препарата сульфонилмочевины в результате постепенного уменьшения и истощения инсулинпродуцирующих β-клеток. В экспериментах на изолированных клеточных культурах было показано, что ситаглиптин был эффективен в отношении восстановления массы и инсулин-секретирующей способности β-клеток.
Контроль гликемии и улучшение функции β-клеток при применении Янувии в стартовой моно- и комбинированной терапии
Исходная комбинированная терапия Янувией и метформином приводит к значимому улучшению показателей функции бета-клеток и концентрации глюкозы в крови, по сравнению с монотерапией метформином или Янувией как через год, так и через 2 года после лечения. Исследование началось с 24-недельной плацебо контролируемой фазы (n = 1,091), затем следовал 30-недельный период с двойным заслеплением и активным контролем (n = 762). Средний уровень HbA1c в обеих группах составил 8,8 и 8,7%, соответственно. 587 пациентов продолжили участие в исследовании в течение 2 лет.
По результатам исследований, стартовая комбинированная терапия ситаглиптином и метформином приводит к значимому улучшению показателей функции бета-клеток и концентрации глюкозы в крови, по сравнению с монотерапией метформином или ситаглиптином как через год, так и через 2 года после лечения.
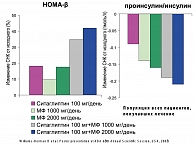
Для оценки функции бета-клеток в cлучайной выборке пациентов проводили постпрандиальный тест с частым забором образцов крови исходно и на 54 неделе (n = 203) и/или на 104 неделе (n = 125). Пациенты принимали стандартную пищевую нагрузку, а затем сдавали кровь в различные моменты времени по отношению к началу приема пищи. Как через год, так и через 2 года у пациентов, принимавших ЯНУВИЮ и метформин, отмечалось выраженное улучшение функции бета-клеток, измеряемой индексом HOMA-β и соотношения проинсулин/инсулин.
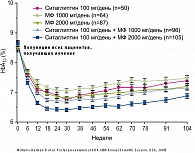
Для оценки сахароснижающего действия комбинации определялось изменение уровня HbA1c, по сравнению с исходным значением через год и через 2 года. Среднее снижение уровня HbA1c по сравнению с исходным значением у пациентов, принимавших ситаглиптин 50 мг в комбинации с метформином 1000 мг два раза в сутки, составило 1,8% (через год, n = 153) и 1,7% (через 2 года, n = 105).
Между группой терапии ситаглиптин/метформином и группой сравнения не было выявлено различий по суммарной частоте нежелательных явлений (7,3% против 7,3%), тяжелых нежелательных явлений (0,5% против 0,8%) и прекращения приема лекарственных препаратов из-за нежелательных явлений (3,4% против 4,0%).
Заключение
ГПП-1 и ГИП являются инкреторными гормонами, обладающими широким спектром действий в отношении регуляции углеводного обмена.
Секреция ГПП-1 и ГИП активируется в ответ на прием пищи, что способствует усилению секреции инсулина.
Наличие зависимости действия инкретинов на секреторный ответ b- и a-клеток и уровня гликемии определяет низкий риск развития гипогликемических состояний и сохранение контринсулярной функции организма.
Данные клинических исследований позволяют рассматривать ингибиторы ДПП-4 как новый класс лекарственных средств, которые можно применять как в виде монотерапии, так и в комбинации с другими сахароснижающими препаратами.
Широкий спектр разнонаправленных действий и трофическое влияние ингибиторов ДПП-4 (Янувия) в отношении b-клеток поджелудочной железы представляет интерес в отношении исследования возможности их использования у лиц с нарушением толерантности к глюкозе и высоким риском развития СД типа 2.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.