Когнитивные нарушения и расстройства сна
- Аннотация
- Статья
- Ссылки
- English
![Таблица. Заболеваемость деменцией на фоне длительной терапии Танаканом по сравнению с плацебо [21]](/upload/resize_cache/iblock/343/195_350_1/tanakan_tab.jpg)
![Рис. 1. Динамика изменений по краткой шкале оценки психического статуса в различных терапевтических группах по данным исследования Paquid [20]](/upload/resize_cache/iblock/3e0/195_350_1/tanakan_pic1.jpg)
![Рис. 2. Концентрация мелатонина в плазме крови при приеме Циркадина в сравнении с физиологической концентрацией эндогенного мелатонина в плазме крови [30]](/upload/resize_cache/iblock/e46/195_350_1/tanakan_pic2.jpg)


Под когнитивными понимают функции головного мозга, которые обеспечивают человеку процесс познания себя и окружающей реальности и дают возможность взаимодействовать с окружающими объектами посредством вербальной и невербальной коммуникации. Согласно теории А.Р. Лурия [1], когнитивные функции подразделяются на три блока, которые, действуя совместно, позволяют максимально эффективно организовать познавательный процесс.
Первый блок организации психических функций (блок активации) включает в себя ствол головного мозга, ряд подкорковых образований (таламус, базальные ганглии), гиппокамп, переднюю цингулярную извилину, медиобазальные отделы лобной коры. Основная задача этого блока – создание и поддержание необходимой активности и скорости усвоения и переработки информации, ее хранение и своевременное извлечение (память). Познавательный процесс – это активная мыслительная деятельность, в значительной степени определяемая сохранностью сознания и мотивированностью человека.
Из сказанного следует, что для сохранности когнитивных функций важен не только достаточный уровень бодрствования, но и качество предыдущего сна. Кроме того, когнитивные нарушения зависят от состояния лимбической системы, наличия и выраженности сопутствующих депрессивных или тревожных расстройств.
Второй блок организации психической деятельности включает отделы коры височных, теменных и затылочных долей головного мозга. Это зоны первичного восприятия и обработки поступающей информации, ее начального синтеза.
Окончательный синтез полученной информации происходит в зоне коры на стыке теменных, височных и затылочных отделов головного мозга (так называемая ТРО-зона) и в лобных долях головного мозга (третий функциональный блок). В этих зонах творчества и принятия решения создаются и усваиваются новые программы деятельности человека, осуществляется контроль над их исполнением. Эти же зоны мозга в значительной степени обеспечивают уровень необходимой мотивации и контроль личного и социального поведения [1, 2].
Качество познавательного процесса тесно связано с качеством сна. Проведенные нейрофизиологические эксперименты показали, что сон – активный процесс. Во сне происходит упорядочивание и укрепление (консолидация) знаний, полученных в течение дня. Показано, что здоровые люди, лишенные сна на 36 часов, запоминали информацию достоверно хуже, чем участники аналогичной по возрасту контрольной группы, которым позволяли спать [3].
Согласно сравнительному анализу данных, полученных в исследовании M.P Walker и соавт. [4], качество запоминания заученного материала зависит от качества сна. Исследуемые заучивали информацию и воспроизводили ее дважды – вечером перед сном и на следующее утро. После сна точность и объем воспроизводимой информации достоверно увеличивались.
Результаты последующих экспериментов показали, что важен сам факт сна. Время сна (днем или ночью) имеет значение, но не первостепенное. Участники исследования, которым позволяли днем спать, демонстрировали достоверно лучшее запоминание и воспроизведение материала, заученного до сна, чем участники контрольной группы, которые не спали днем [2].
Сегодня взаимосвязь между инсомнией и когнитивными нарушениями очевидна. Многочисленные исследования когнитивных функций у пациентов с инсомнией выявили интересные закономерности. Например, снижение длительности или качества сна может приводить к развитию или усугублению имеющихся структурных церебральных дефектов. Магнитно-резонансная спектроскопия, выполненная пациентам с синдромом обструктивного апноэ сна, показала, что для них органическое поражение головного мозга типично – отмечается поражение как белого вещества передних отделов головного мозга [5], так и серого вещества, преимущественно коры лобных и височных отделов головного мозга [6].
Известно, что при нейродегенеративных заболеваниях (болезнь Альцгеймера, лобно-височная дегенерация, деменция с тельцами Леви) определенную роль играет сопутствующая церебральная ишемия. Исходя из современных представлений, только в 10% случаев болезни Альцгеймера имеет место генетическая предрасположенность, в 90% выраженность генетического дефекта такова, что может никогда не привести к развитию заболевания. Однако при сердечно-сосудистом заболевании и сопутствующей церебральной ишемии нейродегенеративный процесс протекает быстрее и в конечном итоге приводит к декомпенсации и развитию клинических проявлений заболевания. Очевидно, что синдром обструктивного апноэ сна также негативно влияет на скорость развития церебральных нейродегенераций и когнитивных симптомов при этих заболеваниях. Тем не менее исследования показали, что снижение количества и качества сна может стать одной из причин развития болезни Альцгеймера и сходных состояний даже без сопутствующей церебральной ишемии. Так, все пациенты с инсомнией, независимо от ее природы, были в большей степени склонны к развитию когнитивных расстройств в рамках церебральных дегенераций [7–9]. Полученные данные позволили предположить, что недостаточность сна – важный патогенетический фактор развития нейродегенеративных когнитивных расстройств.
W.P. Chang и соавт. [7] установили, что риск развития деменции прямо связан с предшествующими нарушениями сна. В ходе исследования, проведенного ранее, M. Jelicic и соавт. [9] получили сходные результаты. По мнению исследователей, нарушения сна служат предиктором когнитивного снижения и возникают задолго до развития у пациентов собственно когнитивных расстройств.
Наконец, эпохальным стало открытие L. Xie и соавт. [10]. Исследователи установили, что клиренс патологического амилоидного белка – соединения, лежащего в основе патогенеза болезни Альцгеймера, – различен во время сна и во время бодрствования: во время сна скорость элиминации патологического амилоидного белка возрастает более чем на 60%. Эти результаты многие ученые назвали величайшим научным достижением XXI века, которое позволит не только иначе взглянуть на причины развития болезни Альцгеймера и других нейродегенераций, но и приблизиться к познанию механизмов старения, а также пересмотреть функциональную значимость сна. В соответствии с этим исследованием сон – важнейший процесс, не только способствующий оптимальной организации информации, полученной в течение дня, но и усиливающий выведение вредных и ненужных белков, то есть прямо замедляющий процесс старения человека [11].
В развитии когнитивных нарушений важны наличие и выраженность сопутствующей сердечно-сосудистой патологии, степень физической и интеллектуальной нагрузки человека, диетические предпочтения. Так, множество проведенных эпидемиологических исследований показали, что когнитивные нарушения развиваются достоверно чаще и протекают тяжелее у тех, чей образ жизни не связан с активной познавательной деятельностью (низкий уровень образования, неинтеллектуальный труд и т.д.). В связи с этим была создана теория когнитивного резерва, которая сводится к следующему. В течение жизни мы, используя интеллект, создаем в головном мозге дополнительные межнейрональные связи. Тем самым в ежедневный познавательный процесс вовлекается все большее число нейронов коры и подкорковых образований головного мозга. При развитии заболевания компенсаторные возможности головного мозга оказываются выше.
Когнитивный резерв чрезвычайно значителен. Так, при болезни Альцгеймера первые клинические проявления развиваются, только когда большинство клеток головного мозга уже погибло (в среднем через 10–15 лет от дебюта заболевания). Причем первые клинические проявления этого заболевания – легкая забывчивость – часто даже не идентифицируют при проведении нейропсихологического исследования.
При сосудистом поражении головного мозга отмечается та же закономерность. Для развития когнитивных нарушений необходимо поражение большого объема белого или серого вещества головного мозга (например, вследствие инсульта или череды инсультов) либо поражение так называемых стратегических зон – отделов головного мозга, имеющих значение для когнитивного функционирования (таламус, гиппокамп, базальные ганглии, ствол головного мозга, лобные доли). В таком случае на первый план выходят снижение скорости психических процессов, уровня внимания, регуляции психической деятельности, колебания уровня активности, мотивации, нарушение контроля за личным поведением и, конечно же, нарушение цикла «сон – бодрствование».
Интересна взаимосвязь между уже развившимися когнитивными нарушениями и расстройствами сна. У пациентов с когнитивными нарушениями разной степени выраженности (легкие и умеренные, деменция) нарушения сна наблюдаются чаще, чем в среднем в популяции. Инсомния у пациентов с болезнью Альцгеймера отмечалась более чем в 35% случаев, у пациентов с умеренными когнитивными расстройствами – в 60% случаев [12–14]. Очевидна взаимосвязь нарушений сна и сосудистых заболеваний головного мозга: частота инсомнии у пациентов с острыми и хроническими сосудистыми церебральными заболеваниями достоверно выше, чем в популяции. Следует учитывать и обратное негативное влияние инсомнии на развитие сосудистых когнитивных расстройств: у пациентов с нарушением сна артериальная гипертензия, сахарный диабет и гиперхолестеринемия протекают тяжелее и труднее поддаются лечению.
Когнитивные нарушения сами по себе способны приводить к развитию нарушений сна. Крайне частым проявлением болезни Альцгеймера и ряда других деменций на начальных стадиях развития считается депрессия. Единого мнения о причине развития эмоциональных нарушений в этом случае нет. Предполагается как эмоциональная реакция на хроническую, прогрессирующую и стойкую утрату памяти, так и патоморфологическая и нейрохимическая общность данных состояний. Очевидно, что депрессия при болезни Альцгеймера будет негативно влиять на сон пациентов – сочетание депрессии и инсомнии усилит выраженность когнитивных расстройств.
Распространенная проблема современного общества – обилие информации и сжатые сроки для ее обработки. Слишком быстрый ритм жизни часто приводит к развитию тревожных расстройств и, как следствие, нарушению сна и когнитивных функций [15]. Пациенты жалуются на нарушения памяти, замедление скорости психических процессов, невозможность в заданные сроки справиться с поставленной задачей. Подобное состояние обычно рассматривается в рамках так называемого синдрома менеджера. По выраженности когнитивные нарушения в большинстве случаев соответствуют субъективным или легким когнитивным: нейропсихологическое исследование не выявляет нарушений либо они минимальны; пациенты живут привычной для них жизнью и не отказываются от каких-либо дел или хобби в связи с когнитивными расстройствами (например, несмотря на ощущение неспособности справиться с рабочей нагрузкой, продолжают работать в той же должности и в целом справляются).
У пациентов с деменцией, особенно сосудистой, смешанной и лобной, снижение мотивации и активности в повседневной жизни – типичный симптом. Такие пациенты днем мало двигаются, много лежат и спят, что в свою очередь приводит к развитию инсомнии, обусловленной нарушением гигиены сна [12].
У пациентов с умеренными или тяжелыми когнитивными нарушениями вследствие сосудистого поражения головного мозга, а также у пациентов с деменцией с тельцами Леви отмечается эпизодическое, обусловленное сердечно-сосудистой декомпенсацией или (при деменции с тельцами Леви) спонтанное снижение уровня психической активности, сочетающееся со значительным нарастанием выраженности когнитивных расстройств. Как правило, вместе со снижением уровня направленной активации у пациентов нарушается цикл «сон – бодрствование»: отмечаются сонливость днем и бессонница ночью; пик неправильного поведения, спутанности, дезориентации, нередко галлюцинаций, приходится на ночное время.
При нарушениях когнитивных функций любой степени выраженности распространено такое состояние, как агнозия сна: пациент ощущает себя неспящим, хотя на самом деле спит. Агнозия сна – симптом, обычно встречающийся в норме при напряженном ожидании событий. Появление и нарастание выраженности когнитивных нарушений приводит к нарастанию частоты встречаемости этого симптома [12, 14].
Таким образом, высокая коморбидность когнитивных нарушений и расстройств сна диктует обязательное и необходимое выявление инсомнии у пациентов любого возраста, а также ее коррекцию для дальнейшей профилактики когнитивных нарушений. Необходимо также своевременно выявлять и лечить сопутствующие тревожно-депрессивные расстройства, которые могут негативно влиять как на сон, так и на когнитивные функции. У пациентов среднего возраста, особенно с когнитивными нарушениями, тщательный анализ состояния сна, тревоги и депрессии приобретает еще большую актуальность с учетом прямого влияния инсомнии и тревожно-депрессивных состояний на дальнейшее развитие когнитивных расстройств.
Лечение когнитивных расстройств, в частности легких, умеренных и субъективных, – задача не простая [16–19]. Препараты базисной симптоматической терапии (ингибиторы ацетилхолинэстеразы и антагонисты NMDA-рецепторов) с доказанной эффективностью в отношении деменции не показали эффективности у пациентов с менее выраженными когнитивными нарушениями [12, 16]. Вместе с тем сложно переоценить роль раннего начала терапии когнитивных расстройств.
Согласно современным представлениям, лечение прежде всего должно быть направлено на профилактику последующего развития когнитивных нарушений. Надо информировать пациента о необходимости достаточной интеллектуальной нагрузки. Чрезвычайно важна и двигательная активность. Данные большинства проведенных к настоящему моменту эпидемиологических исследований показали, что ежедневные, преимущественно аэробные, физические нагрузки достоверно уменьшают риск развития когнитивных расстройств. Снижение массы тела, отказ от курения, изменение привычек питания в пользу так называемой средиземноморской диеты (отказ от мяса и животных жиров в пользу рыбы, фруктов, овощей и оливкового масла) – основные составляющие здорового образа жизни, а значит, длительной сохранности когнитивных функций.
При развитии когнитивных нарушений, не достигающих степени деменции, основная роль отводится когнитивно-моторному тренингу. Проведенные исследования показывают высокую эффективность этого метода в лечении умеренных когнитивных нарушений как нейродегенеративной, так и сосудистой природы. Обязательны своевременное выявление и лечение сопутствующей сердечно-сосудистой патологии.
Медикаментозная коррекция недементных когнитивных расстройств практически не разработана – на данный момент почти нет двойных слепых рандомизированных плацебоконтролируемых исследований, подтверждающих эффективность того или иного препарата у пациентов с легкими и умеренными когнитивными расстройствами. В связи с этим представляют интерес результаты исследований препарата Танакан (EGb 761®) [15, 16, 18–20, 21].
Танакан (EGb 761®) – стандартизованный экстракт листьев реликтового дерева гинкго билоба (Ginkgo biloba), содержащего флавоновые гликозиды, терпеновые вещества и гинкголиды. Препарат оказывает сложное полимодальное положительное действие на состояние клеток головного мозга и церебральную циркуляцию. Как показали результаты исследований, компоненты препарата положительно воздействуют на церебральную микроциркуляцию, не вызывая симптома обкрадывания. Важным действием препарата является его влияние на агрегацию тромбоцитов. Наиболее изучен выраженный антиоксидантный эффект Танакана, реализуемый вследствие снижения скорости перекисного окисления липидов. Этот эффект представляется важным для замедления прогрессирования как сосудистых, так и нейродегенеративных когнитивных расстройств: активация перекисного окисления лежит в основе указанных групп заболеваний. Препарат оказывает нейропротективное действие за счет образования новых синаптических межнейрональных связей. Важны также активирующий эффект препарата и его влияние на многие церебральные медиаторные системы. Данный эффект не только лежит в основе положительного влияния Танакана на когнитивные функции, но и определяет его противотревожное и антидепрессивное действие.
Проведенные исследования убедительно доказали эффективность Танакана в лечении недементных когнитивных нарушений у пациентов как молодого, так и среднего возраста. В крупнейшем исследовании GuildAge, которое длилось семь лет, участвовали 2584 пациента и 686 врачей из 25 медицинских центров Франции [21]. Критериями включения были пожилой возраст (не менее 70 лет), наличие жалоб на нарушения памяти и отсутствие деменции на момент включения в исследование, а также отсутствие выраженной тревоги и депрессии. Средний возраст пациентов составил 76,3 года. Пациенты были рандомизированы в две параллельные группы, сопоставимые по половозрастным признакам и уровню образования: 1406 пациентов получали Танакан и 1414 – плацебо. Длительность лечения составила пять лет. Каждые три месяца состояние пациентов отслеживал врач общей практики. Каждый год участники исследования проходили нейропсихологическое тестирование в специализированном центре памяти. В качестве основного параметра эффективности в исследовании GuidAge фигурировала заболеваемость деменцией за весь период наблюдения.
Показано, что при длительном применении (более четырех лет) у пациентов, принимавших Танакан, риск развития деменции достоверно снижался (по сравнению с группой плацебо). У пациентов мужского пола достоверно меньший риск развития деменции на фоне приеме Танакана отмечался и при меньших сроках терапии (один год и более). Более высокая эффективность лечения, в том числе снижение риска прогрессирования когнитивных нарушений, имела место у пациентов с артериальной гипертензией и ожирением, принимавших Танакан (таблица). Препарат продемонстрировал несомненное нейропротективное действие при длительном применении, особенно у пациентов с сосудистыми когнитивными нарушениями или сосудистыми факторами риска, потенцирующими развитие когнитивных нарушений другой природы.
Второе исследование эффективности Танакана – Paquid длилось свыше 20 лет. На сегодняшний день это одно из самых долгих исследований с участием пациентов с когнитивными нарушениями [20].
В исследование Paquid было включено 3777 пациентов старше 65 лет. Оценка когнитивных функций выполнялась на момент включения, а также через 1, 3, 5, 8, 10, 13, 15, 17 и 20 лет наблюдения. Анализировались скорость прогрессирования когнитивных нарушений и процент исхода в деменцию у пациентов, принимавших Танакан, и пациентов контрольных групп. Пациенты контрольных групп принимали пирацетам или не получали лекарственных средств, потенциально влияющих на когнитивные нарушения.
Доказано, что, хотя в целом когнитивные функции с возрастом имели тенденцию к снижению, скорость когнитивного снижения достоверно зависела от вида получаемой терапии. Пациенты, принимавшие Танакан, демонстрировали статистически достоверно меньшую скорость прогрессии когнитивных расстройств (рис. 1) [20].
Важнейшим является действие Танакана на состояние когнитивных функций у молодых пациентов. Выраженность когнитивных нарушений, равно как и выраженность тревожно-депрессивных расстройств у пациентов с легкими когнитивными нарушениями вследствие синдрома менеджера, достоверно уменьшалась на фоне приема Танакана [15].
Очевидно, что лечение тревоги и депрессии должно благотворно влиять на сон. Рассмотрим другие, наиболее часто применяемые лекарственные и нелекарственные методы коррекции нарушений сна.
Необходимо соблюдать гигиену сна – комплекс правил, позволяющих пациенту быстрее заснуть. Так, желательно вставать и ложиться в одно и то же время, не заниматься активными физическими и умственными нагрузками перед сном, не употреблять вечером чай, кофе, не курить, не переедать. Место для сна должно быть максимально удобным, тихим, мало освещенным и предназначенным исключительно для сна. К факторам, нарушающим сон, относятся, в частности, привычка пребывать в постели без сна, чтение и прием пищи в постели. Часто соблюдение простых правил позволяет пациентам если не полностью избавиться от нарушений сна, то хотя бы уменьшить их выраженность.
Медикаментозное лечение инсомнии предполагает применение препаратов разных лекарственных групп. Как правило, это препараты, не являющиеся снотворными (транквилизаторы, Валокордин и Корвалол, антигистаминные препараты и т.д.).
К препаратам первого выбора в лечении инсомнии относятся так называемые Z-препараты (золпидем, зопиклон, залеплон) [13, 17, 22, 23]. К сожалению, они часто не могут применяться у пациентов с когнитивными нарушениями, поскольку способны усиливать выраженность когнитивных расстройств. Применение же препаратов из групп транквилизаторов, антигистаминных и прочих лекарственных средств, одновременно оказывающих и снотворное, и седативное действие, у пациентов с когнитивными нарушениями категорически противопоказано. Использование таких лекарственных средств может привести к значительному усугублению когнитивных нарушений из-за снижения уровня активации, внимания и скорости психических процессов.
В отношении пациентов с когнитивными нарушениями любой степени выраженности препаратами выбора для лечения инсомнии могут быть мелатонинергические препараты.
Говоря об этой группе лекарственных средств, нельзя не упомянуть о взаимосвязи мелатонина, нарушений сна и состояния когнитивных функций. На сегодняшний день необходимая и достаточная концентрация эндогенного мелатонина, по данным ряда исследований [23–25], определяет как наступление, так и качество сна. Максимальная концентрация мелатонина достигается в середине ночи, к утру его уровень снижается. В дневное время мелатонин вырабатывается в очень небольших количествах.
Описан анксиолитический эффект мелатонина, предположительно осуществляемый через модуляцию активности ГАМКергической церебральной системы [26, 27]. Обсуждается положительное влияние на когнитивные функции. Нормализация концентрации уровня мелатонина у пациентов с сосудистыми когнитивными нарушениями разной степени выраженности приводит к уменьшению выраженности нарушений памяти [23, 25]. Предполагается также позитивное влияние мелатонина на процессы старения. Мелатонин повышает выработку ряда нейротрофических факторов, например фактора роста нервов (nerve growth factor) и церебрального нейротрофического фактора (brain-derived neurotrophic factor) [25]. Более того, данные о применении мелатонина у пациентов с болезнью Альцгеймера позволили предположить наличие его положительного влияния на скорость амилоидогенеза, то есть на само развитие заболевания [28, 29].
Препаратом мелатонина с функцией постепенно высвобождения является Циркадин. На фоне его применения кривая концентрации мелатонина максимально соответствует физиологической кривой выработки мелатонина в зависимости от времени суток (рис. 2) [30]. Препарат содержит 2 мг активного мелатонина и принимается за один-два часа до сна. Обычно длительность лечения составляет 21 или 42 дня с последующим перерывом и повтором курса лечения при необходимости. Циркадин достоверно улучшает качество сна, а также качество жизни пациентов, при этом не оказывает влияния на качество дневного бодрствования и не вызывает дневную сонливость. Физиологически оправдано назначение Циркадина на более длительный период. Препарат не вызывает синдрома отмены, его прием может быть прекращен сразу после лечебного курса любой продолжительности [30, 31].
В клинике нервных болезней им. А.Я. Кожевникова было проведено исследование качества сна и эффективности препаратов, назначаемых в качестве снотворных средств у пациентов с когнитивными нарушениями. В исследовании участвовали 42 пациента с умеренными когнитивными нарушениями и 36 пациентов с деменцией, предъявлявших жалобы на нарушения сна и принимавшие по этому поводу лекарственные препараты. Группу с умеренными когнитивными нарушениями составили 28 женщин и 14 мужчин, средний возраст – 64,3 ± 7,7 года. Группу деменции составили 21 женщина и 15 мужчин, средний возраст – 66,4 ± 5,9 года. Диагноз умеренных когнитивных расстройств ставили в соответствии с критериями R.C. Peterson [32], диагноз деменции – в соответствии с критериями Международной классификации болезней 10-го пересмотра и руководства по диагностике и статистике психических расстройств (Diagnostic and Statistical Manual of Mental Disorders).
Анализ когнитивных нарушений показал, что у пациентов с умеренными когнитивными нарушениями преобладал неамнестический тип умеренных когнитивных расстройств, у пациентов группы деменции – болезнь Альцгеймера и смешанная деменция (рис. 3).
Жалобы на нарушения сна предъявляли 60% пациентов с умеренными когнитивными расстройствами и 43% пациента с деменцией. Нарушения сна, согласно дизайну исследования, отмечались у всех пациентов исследуемых групп.
Анализ препаратов, принимаемых для уменьшения выраженности нарушений сна, показал следующее. В группе с умеренными когнитивными расстройствами наиболее часто применяемым препаратом был Валокордин (80%), в 52,5% случаев пациенты использовали Феназепам и лишь в 33,3% случаев – Z-препараты (зопиклон, золпидем и залеплон). На фоне указанной терапии положительный эффект в виде некоторого уменьшения выраженности инсомнии отмечался у 32% пациентов, в то время как о наличии дневной сонливости сообщали 80% пациентов.
У пациентов с деменцией частота и вид принимаемых снотворных препаратов были аналогичны таковым группы с умеренными когнитивными расстройствами: в 88,8% случаев применяли Валокордин, в 78% случаев – Феназепам и лишь в 24,5% – Z-препараты. У всех пациентов этой группы снотворные препараты вызывали дневную сонливость и апатию. У 36,5% пациентов прием Валокордина и/или Феназепама вызвал хотя бы однократную утреннюю спутанность мыслей, появление ярких сновидений, иллюзий и галлюцинаций. У 12% пациентов выраженность психических расстройств стала основанием для госпитализации. У всех пациентов, принимавших Феназепам, и у 39,8% пациентов, получавших Z-препараты, родственники отмечали нарастание выраженности когнитивных расстройств, снижение повседневной активности и качества жизни.
Впоследствии всем исследуемым пациентам был назначен Циркадин в дозе 2 мг однократно, за час до сна, курс – 42 дня. Анализ качества сна проводили методом анкетирования.
Показано, что на фоне терапии Циркадином выраженность нарушений сна достоверно снизилась как у пациентов с умеренными когнитивными расстройствами, так и у пациентов с деменцией. Различия показателей носили характер статистической достоверности при сравнении выраженности нарушений сна на первый и 21-й день, на первый и 42-й день (p < 0,05). При сравнении выраженности нарушений сна на 21-й и 42-й день различия имели тенденцию к статистической достоверности (0 < p < 1) (рис. 4).
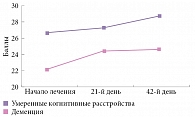
Все пациенты на момент включения в исследование получали симптоматическую лекарственную терапию когнитивных нарушений. В течение всего периода исследования терапия оставалась неизменной. Однако анализ выраженности когнитивных нарушений у пациентов исследуемых групп на 21-й и 42-й день терапии Циркадином показал, что выраженность когнитивных расстройств уменьшилась как у пациентов группы с умеренными когнитивными расстройствами, так и у пациентов с деменцией. Указанная положительная динамика носила характер статистической достоверности на 21-е сутки лечения (рис. 5). Уровень когнитивных нарушений на 21-й и 42-й день статистически достоверно не отличался.
Таким образом, на основании современных знаний о физиологии головного мозга человека можно утверждать наличие взаимосвязи сна, эмоционального фона и качества познавательного процесса. Подобная закономерность типична для любого возраста и сохраняется не только у здоровых людей на протяжении всей жизни, но и у пациентов с заболеваниями, затрагивающими сферу сна, познания или эмоций.
I.S. Preobrazhenskaya
I.M. Sechenov First Moscow State Medical University
Contact person: Irina Sergeyevna Preobrazhenskaya, irinasp2@yandex.ru
The main aspects of developing cognitive impairments as well as opportunities of their prophylaxis and treatment at early stage are outlined in the paper. Modern understanding regarding medicated and non-medicated correction of cognitive impairments is presented. Potential relationships between cognitive impairments and insomnia are discussed with providing recommendations on treating sleep disorders in patients with lowered cognitive function.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.