Нейроморфологические изменения структур головного мозга у женщин с ишемическим инсультом: клиническая значимость для прогнозирования исходов
- Аннотация
- Статья
- Ссылки
- English
Материал и методы. Представлены результаты анализа 48 протоколов танатологического исследования пациенток с диагностированным острым нарушением мозгового кровообращения, а также клинические случаи, при которых соотносились данные объективной оценки неврологического и функционального статусов и результаты томографических (рентгеновского компьютерного и магнитно-резонансного (МР)) исследований головного мозга у женщин. Исследования проводились в Башкирском государственном медицинском университете и Республиканском патологоанатомическом центре г. Самарканда (Республика Узбекистан) в период с 2021 по 2023 г. При патоморфологическом исследовании использовались общепринятые методы, с макро- и микроскопическим изучением структур головного мозга и его артериальной системы на всех структурно-функциональных уровнях, включая магистральные артерии головы – внутренние сонные и позвоночные артерии, интракраниальные артерии – сосуды виллизиева круга и их ветви, а также внутримозговые артерии и сосуды микроциркуляторного русла. При нейровизуализационных исследованиях в дополнение к традиционным методикам применялась МР-трактография.
Результаты. Установлено, что при ишемии мозговой артерии в ткани головного мозга в ранние сроки после ишемии первоначально развиваются дисциркуляторные и отечные явления, затем начинают преобладать деструктивно-некротические изменения как в нервных, так и в глиальных клетках. В ответ на деструктивные изменения вокруг очага острой ишемии развиваются воспалительно-регенераторные реакции в виде расширения сосудов, миграции из крови лейкоцитов в очаг деструкции, формирования воспалительно-клеточного демаркационного вала вокруг некроза. Полученные данные сопоставлялись с данными литературы.
Заключение. Установлены морфологические диагностические особенности ишемических инсультов у женщин.
Материал и методы. Представлены результаты анализа 48 протоколов танатологического исследования пациенток с диагностированным острым нарушением мозгового кровообращения, а также клинические случаи, при которых соотносились данные объективной оценки неврологического и функционального статусов и результаты томографических (рентгеновского компьютерного и магнитно-резонансного (МР)) исследований головного мозга у женщин. Исследования проводились в Башкирском государственном медицинском университете и Республиканском патологоанатомическом центре г. Самарканда (Республика Узбекистан) в период с 2021 по 2023 г. При патоморфологическом исследовании использовались общепринятые методы, с макро- и микроскопическим изучением структур головного мозга и его артериальной системы на всех структурно-функциональных уровнях, включая магистральные артерии головы – внутренние сонные и позвоночные артерии, интракраниальные артерии – сосуды виллизиева круга и их ветви, а также внутримозговые артерии и сосуды микроциркуляторного русла. При нейровизуализационных исследованиях в дополнение к традиционным методикам применялась МР-трактография.
Результаты. Установлено, что при ишемии мозговой артерии в ткани головного мозга в ранние сроки после ишемии первоначально развиваются дисциркуляторные и отечные явления, затем начинают преобладать деструктивно-некротические изменения как в нервных, так и в глиальных клетках. В ответ на деструктивные изменения вокруг очага острой ишемии развиваются воспалительно-регенераторные реакции в виде расширения сосудов, миграции из крови лейкоцитов в очаг деструкции, формирования воспалительно-клеточного демаркационного вала вокруг некроза. Полученные данные сопоставлялись с данными литературы.
Заключение. Установлены морфологические диагностические особенности ишемических инсультов у женщин.
Введение
В настоящее время церебральный инсульт является одной из самых серьезных медицинских и социальных проблем в мире [1, 2]. По данным Всемирной организации здравоохранения (2013), от церебрального инсульта или других форм цереброваскулярной болезни в мире ежегодно умирает около 6,2 млн человек (10,8% от общего числа смертей). Летальность от цереброваскулярных заболеваний занимает второе место, уступая лишь летальности от заболеваний сердца [3, 4], – 8% среди мужчин и 16% – среди женщин [4, 5]. От инсульта за год умирает около 6,2 млн человек – около 11% всех смертей. Порядка 24 млн человек в мире перенесли инсульт в 2020 г. Приблизительно 50 млн ранее перенесли инсульт и оставались в живых в 2021 г. [6, 7].
Инсульт – причина стойкой утраты трудоспособности. Болезнь может возникать у людей любого возраста. В Западной Европе на лечение и реабилитацию больного, перенесшего церебральный инсульт, расходуется в среднем 33 тыс. евро в год [8, 9]. У женщин нарушение мозгового кровообращения часто развивается в возрасте от 18 до 65 лет. В отличие от мужчин женщины подвержены более выраженным гормональным изменениям, а из лиц, перенесших инсульт, 55% – женщины, что, возможно, отчасти связано и с тем, что их продолжительность жизни в среднем на пять лет больше [2, 8]. Дисбаланс гормонов также может быть причиной того, что инсульт тяжелее протекает у женщин и требует больше времени для восстановления. Однако при анализе данных литературы нами замечено, что долгое время в публикациях описывались исследования (в частности, по профилактике инсультов), среди участников которых преобладали мужчины. Так, в 1970 г. доля женщин в превентивных работах составила всего 9%. В настоящее время собирается больше гендерно-чувствительных данных, многие вопросы по-прежнему требуют более широкого освещения [6, 10].
Сказанное свидетельствует о необходимости проведения комплексного клинико-морфологического исследования с детальным изучением структурных изменений головного мозга и всех отделов его сосудистой системы с целью уточнения основных факторов возникновения одиночных и множественных инсультов различного объема в зависимости от локализации.
Материал и методы
Проанализированы результаты патоморфологического исследования. Проведен ретроспективный анализ 48 протоколов патологоанатомического исследования женщин с диагностированным острым нарушением мозгового кровообращения (ОНМК). Представляем клинические примеры и результаты прижизненного нейровизуализационного исследования женщин, проживающих в г. Уфе. Исследования проводились в Республиканском патологоанатомическом центре г. Самарканда и Башкирском государственном медицинском университете (БГМУ) в период с 2021 по 2023 г. Применялись общепринятые методы исследования: проводились клиническое исследование согласно клиническим рекомендациям, компьютерная и магнитно-резонансная томография, макро- и микроскопическое изучение мозга и его артериальной системы на всех структурно-функциональных уровнях, включая магистральные артерии головы – внутренние сонные и позвоночные артерии, интракраниальные артерии – сосуды виллизиева круга и их ветви, а также внутримозговые артерии и сосуды микроциркуляторного русла. При исследовании мозга определялись величина и локализация интрацеребральных гематом, наличие прорыва крови в желудочковую систему, выраженность отека мозга, дислокации и сдавления его ствола. Учитывались визуализируемые изменения мозга (мелкие кровоизлияния, очаги периваскулярного отека, спонгиоформное состояние белого вещества). Микроскопическое исследование мозга выполнялось в гистологических препаратах, заключенных в парафин (окрашивание гематоксилином и эозином, методом ван Гизона определялись коллагеновые волокна и миоциты в сосудах, методом Вейгерта выявлялись эластические волокна в сосудах). Особое внимание обращалось на сосуды микроциркуляторного русла в пределах гематом, в перифокальной зоне, а также на отдалении от гематом.
Результаты
У всех субъектов исследования диагностировано ОНМК по ишемическому типу. Среди описываемых в патоморфологическом фрагменте данной работы 48 умерших почти 1/3 (14 (29,2%) пациенток) были трудоспособного возраста (33–65 лет).
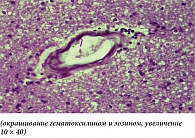
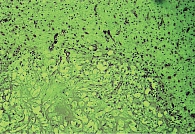
При патологанатомическом исследовании выявлены патоморфологические изменения, характерные для большинства субъектов. Так, результаты микроскопического исследования головного мозга при ишемии мозговой артерии показали наличие на ранних сроках ишемии во всех отделах головного мозга распространенных дисциркуляторных изменений в виде паралитического расширения сосудов, особенно сосудов микроциркуляторного барьера. При этом более выраженное расширение кровеносных сосудов отмечалось в области ядерных структур промежуточного мозга и глубоких слоях коры головного мозга. Стенки артерий часто были утолщены за счет отека и разрыхления эндотелия и базальной мембраны с образованием светлой отечной зоны в периваскулярной зоне (рис. 1).
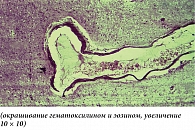
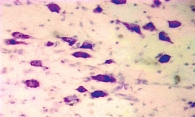
На поздних сроках ишемии в ткани головного мозга наблюдались более отчетливые распространенные дисциркуляторные и отечные явления, особенно выраженные в ядерных структурах промежуточного мозга и коре головного мозга. Большинство сосудов визуализировалось в состоянии паралитического расширения, но в просвете вместо кровяных элементов определялись розовая масса (рис. 2) и периферически расположенные лейкоциты. В коре головного мозга нервные клетки утрачивали свое типичное расположение, их границы были нечеткими, в окружности как нервных, так и глиальных клеток определялся выраженный перицеллюлярный отек. В отдельных нервных клетках имели место признаки аутолитического некроза в виде вакуолизации цитоплазмы, распада мембран, исчезновения тигрового вещества, лизиса или пикноза ядер (рис. 3).
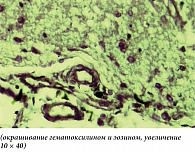
При острой ишемии в ткани головного мозга, включая промежуточный мозг, уже преобладали деструктивно-некротические и реактивные изменения над дисциркуляторными нарушениями. Непосредственно в зонах ишемии визуализировались нервные клетки в состоянии полного аутолитического распада с образованием вместо них крупных вакуолизированных полостей. Там, где мозговое вещество и цитоплазма нервных клеток полностью распались, микроскопически регистрировались лишь ядерные структуры в виде клеточных теней. В областях мозга, непосредственно прилежащих к зонам ишемии, также отмечался периваскулярный и перицеллюлярный отек (рис. 4). В местах, где нервные клетки утратили нормальную ориентацию, были видны распад тигрового вещества и некоторое сморщивание ядер. Со стороны глиальных клеток отмечалась некоторая активность в виде гиперхромазии ядер и увеличения их количества. Сосуды были резко расширены, полнокровны, в просвете наблюдалось увеличенное количество лейкоцитов с периферическим расположением и миграцией через стенку в периваскулярное пространство.
При длительной ишемии в ишемизированной зоне головного мозга развивались полный некроз нервных клеток и выраженная инфильтрация полинуклеарными лейкоцитами и макрофагами. При этом сосуды были паралитически расширены, стенки их разорваны, в просвете визуализировались розовая белковая масса и полинуклеарные лейкоциты. Вся некротизированная нервная ткань была диффузно инфильтрирована лейкоцитами, глиальными клетками и отдельными макрофагами, причем среди этих воспалительных клеток преобладали деструктивные и погибающие формы с формированием небольших очагов распада и деструктивных очагов (рис. 5). В окружающих зонах ишемии в ткани мозга сохранялись дисциркуляторные, реактивные и отечные явления в виде выраженного периваскулярного и перицеллюлярного отека. Вокруг сосудов определялись очаги воспалительной клеточной инфильтрации из полинуклеарных лейкоцитов и макрофагов. В самой нервной ткани отмечался выраженный очаговый и местами распространенный глиоз.
Результаты морфологического изучения гематоэнцефалического барьера (ГЭБ) при острой ишемии головного мозга показали, что основные патоморфологические изменения, свидетельствовавшие о перестройке структурных элементов ГЭБ, происходили в стенках сосудов микроциркуляторного русла. На острую ишемию первоначально отвечали артериолы в виде выраженной вазоконстрикции с нарастанием капиллярного кровотока, которые морфологически проявились сужением просвета артериол, утолщением и уплотнением структурных элементов всех слоев стенки (рис. 6).
Прекапилляры и капилляры ткани мозга были расширены, заполнены кровяными элементами, в том числе определялись лейкоциты. Стенка эндотелиальных, перицитарных клеток была растянута, базальная мембрана истончена. Особенно расширенными были посткапиллярные венулы и вены ткани мозга с вакуолизацией адвентиции и периваскулярного пространства (рис. 7), что свидетельствовало о замедлении кровотока в венозном отделе ангиоархитектоники мозговой ткани при острой ишемии.
На дальнейших сроках острой ишемии во всех отделах сосудов микроциркуляторного русла головного мозга отмечались выраженный перицеллюлярный отек или расширение пространства Вирхова – Робина. Это указывало на то, что вследствие ишемии в зонах микроциркуляторного русла высвобождались биологические активные вещества, способствовавшие расширению сосудов, повышению проницаемости и выходу жидкой части и плазменных белков крови в окружающую ткань (начало нарушения проходимости ГЭБ). Под влиянием биологических факторов воспаления в нервной ткани происходили повреждение и активация перицитарных клеток стенок сосудов и микроглии, локализованной вокруг сосудов (рис. 8).
При морфологическом исследовании ткани головного мозга у женщин, умерших от церебрального инсульта, выявлены признаки пролиферации клеток и миграции микроглии и макрофагов, что свидетельствовало о процессе рассасывания поврежденной некротической ткани в очаге острой ишемии. В связи с этим во всех отделах периишемических зон мозговой ткани зафиксировано развитие распространенных периваскулярных и внутримозговых воспалительных инфильтратов из гематогенных и гистиогенных клеток, а также из макрофагов микроглиального происхождения. Эти изменения завершались с развитием вторичных осложнений в виде периваскулярного склероза и диффузного и очагового глиоза нервной ткани.
При длительной ишемии в поврежденном полушарии головного мозга и промежуточном мозге четко определялись три отдельные зоны поражения. В центре ишемизированной мозговой ткани визуализировалось огромное поле, состоявшее из бесклеточной гомогенной некротической массы (рис. 9).
Вторая зона, состоящая из густо расположенной клеточной инфильтрации, плотно окружала центральную некротическую зону. Клеточная инфильтрация была образована вокруг некроза в виде демаркационной линии из воспалительных клеток, в составе которых преобладали полинуклеарные лейкоциты и макрофаги. Третья зона была представлена окружающей нервной тканью с выраженными дисциркуляторными и реактивными изменениями. Некоторые из значительно расширенных и полнокровных сосудов образовывали кавернозные полости. Их стенка была истончена, местами разорвана, эндотелиальные клетки гипертрофированы. Концентрация лейкоцитов и моноцитов крови вокруг стенки сосудов свидетельствовала об усилении их миграции в очаг ишемии и некроза. Сама нервная ткань была отечна и бледно окрашена, в ее клеточном составе преобладали глиальные клетки и полинуклеарные лейкоциты.
Патоморфологические изменения, обнаруженные post mortem, характеризовали состояние тканей головного мозга, которое частично можно визуализировать прижизненно с использованием компьютерной и магнитно-резонансной томографии головного мозга.
Представляем клинические случаи двух пациенток, перенесших острый ишемический инсульт и проходящих в настоящее время медицинскую реабилитацию.
Клинический случай 1
Пациентка Б., 83 года, госпитализирована в отделение медицинской реабилитации с жалобами на слабость и снижение чувствительности в левых конечностях, нарушение речи, самообслуживания и передвижения, повышение артериального давления через 138 дней после развития острого ишемического инсульта, по поводу которого получала консервативное лечение в условиях первого этапа медицинской реабилитации в специализированном стационаре.
Ведущие неврологические синдромы – левосторонний центральный гемипарез: глубокий в проксимальных отделах (сила мышц – 1 балл) до степени плегии в дистальных отделах руки (сила мышц – 0 баллов) и умеренный в ноге (сила мышц – 3 балла). Умеренно выраженная гемигипестезия слева по проводниковому типу. Дизартрия. Тазовые функции пациентка не контролирует. Самостоятельно сидит без опоры, пересаживается в кресло, походка паретическая с дополнительной опорой и поддержкой – может передвигаться по палате.
Клинически по шкале Ривермид – 7 баллов из 15, по шкале Рэнкин – 4 балла из 5.
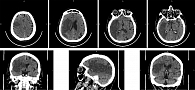
Данные компьютерной томографии: обширная гиподенсивная зона в паренхиме лобно-височно-теменно-затылочной области справа. Дислокация срединных структур влево. Признаки дисциркуляторной энцефалопатии, церебрального атеросклероза (рис. 10).
Выявленные при компьютерно-томографическом исследовании морфологические изменения соотносятся с патоморфологической картиной, описанной выше и типичной для постинсультных пациенток.
Клинический случай 2
Этот пример демонстрирует возможности магнитно-резонансной томографии и трактографии в прижизненной визуализации структуры головного мозга в остром периоде ишемического инсульта, произошедшего после эндоваскулярного вмешательства (аортокоронарного шунтирования).
У пациентки Д., 67 лет, после проведения планового аортокоронарного шунтирования 9 октября 2023 г. (начало операции – 08.45, завершение –10.00) на утро 11 октября отмечались признаки сенсомоторной афазии в течение двух часов (09.00–11.00). В 11.00 пациентка начала говорить. Данные компьютерной томографии головного мозга (10.00 11 октября) показали последствия перенесенных лакунарных инфарктов с обеих сторон, признаки хронической цереброваскулярной недостаточности и атрофические изменения коры головного мозга. Данных об ОНМК по ишемическому типу на момент исследования нет. На момент осмотра в этот период, со слов пациентки, «тяжело найти слова». Развитие острых ишемических инсультов описано нами на основании данных наблюдений в клиниках г. Уфы [8, 10].
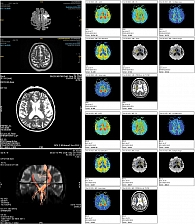
Магнитно-резонансная томография (МРТ) головного мозга от 23 октября 2023 г. продемонстрировала отчетливые признаки церебрального инсульта по ишемическому типу в бассейне левой средней мозговой артерии.
В неврологическом статусе на момент проведения МРТ – легкий центральный правосторонний гемипарез (сила мышц равномерно снижена до 4 баллов) и симптом Бабинского билатерально.
Пациентке проведена трактография (DTI), по результатам которой рассчитаны данные фракционной анизотропии на стороне инсульта (0,539) и контралатеральной стороне (0,588). Средняя скорость диффузии на стороне поражения составила 807, на контралатеральной стороне – 924 (рис. 11), что полностью соотносится с результатами клинического осмотра с оценкой по клиническим шкалам: 4 балла по шкале NIHSS, 4 балла по шкале Френчай, 1 балл по шкале Хаузера, 11 баллов по шкале Ривермид, 11 баллов по шкале МоСА, 4 балла по шкале Рэнкин.
Обсуждение и выводы
В результате проведенных морфологических исследований установлены патоморфологические особенности ишемических инсультов у женщин. Эти данные могут быть соотнесены с данными прижизненной нейровизуализационной диагностики. В частности, при ишемии мозговой артерии в ткани головного мозга на ранних сроках после ишемии первоначально развиваются дисциркуляторные и отечные явления, затем начинают преобладать деструктивно-некротические изменения как в нервных, так и в глиальных клетках. В ответ на эти деструктивные изменения в очаге острой ишемии в окружающих тканях развиваются воспалительно-регенераторные реакции в виде расширения сосудов, миграции из крови лейкоцитов в очаг деструкции, формирования воспалительно-клеточного демаркационного вала вокруг некроза.
Определение морфологических изменений в головном мозге в сочетании с количественной диагностикой неврологического дефицита с использованием клинических шкал крайне важно для персонификации построения реабилитационных программ для пациентов, перенесших инсульт. По данным последних международных публикаций [11, 12], пациенты обоего пола имеют определенные морфологические различия в структурах головного мозга после церебральных инсультов, влияющие на функциональные исходы. Это необходимо учитывать при выборе эффективной фармакотерапии и индивидуальных алгоритмов медицинской реабилитации для постинсультных пациентов. Требуются дополнительное расширенное исследование гендерных различий в клинико-морфологическом направлении у пациентов, перенесших церебральный инсульт, и сопоставление данных, полученных в разных регионах мира.
Авторы благодарят Башкирский государственный медицинский университет, на базе которого поддерживается межвузовское международное сотрудничество с Самаркандским государственным медицинским университетом в рамках реализации программы стратегического академического лидерства «Приоритет – 2030».
Конфликт интересов отсутствует.
A.T. Dzhurabekova, PhD, Prof., M.I. Kamalova, PhD, L.R. Akhmadeeva, PhD, Prof., D.E. Baikov, PhD, Prof., R.R. Gizatullin, G.A. Bulyakova, E.N. Akhmadeeva, PhD, Prof.
Samarkand State Medical Institute, Samarkand
Bashkir State Medical University
Аcademy of Sciences of Bashkortostan Republic
Contact person: Leila R. Akhmadeeva, Leila_ufa@mail.ru
The purpose of this study was to establish morphologic peculiarities of the development of cerebral strokes in women. In this paper we discuss post-mortem pathomorphologic characteristics and neuroimaging results in female patients after ischemic cerebral strokes.
Material and methods. The results of the analysis of 48 protocols of thanatological examination of patients with diagnosed acute cerebrovascular accident, as well as clinical cases in which the data of an objective assessment of neurological and functional statuses and the results of tomographic (X-ray computer and magnetic resonance (MR)) studies of the brain in women were correlated are presented. The research was conducted at the Bashkir State Medical University and the Republican Pathoanatomical Center of Samarkand (Republic of Uzbekistan) in the period from 2021 to 2023. The pathomorphological study used generally accepted methods, with macro- and microscopic examination of the structures of the brain and its arterial system at all structural and functional levels, including the main arteries of the head - internal carotid and vertebral arteries, intracranial arteries – vessels of the Willis circle and their branches, as well as intracerebral arteries and vessels of the microcirculatory bed. In addition to traditional techniques, MR tractography was used in neuroimaging studies.
Results. It has been established that at cerebral artery ischemia in the brain tissue in early terms after ischemia initially dyscirculatory and edematous phenomena develop, then the prevalence of destructive-necrotic changes in both nerve and glial cells begins. To these destructive changes in the focus of acute ischemia the inflammatory-regenerative reactions develop in the surrounding area in the form of vascular dilation, migration of leukocytes from blood to the focus of destruction, formation of inflammatory-cell demarcation shaft around the necrosis. Our results were compared to the data from the literature.
Conclusion. As a result of our studies the morphologic diagnostic features of ischemic strokes in women have been established.
