Оптимальная инсулинотерапия требует оптимальной титрации дозы
- Аннотация
- Статья
- Ссылки
- English
С учетом данных о взаимосвязи между состоянием компенсации углеводного обмена и частотой сосудистых осложнений, а также эффективной защитой бета-клеток инсулинотерапия при наличии показаний остается наиболее эффективным вариантом лечения СД 2 типа и единственным патогенетически обоснованным и жизненно необходимым – при СД 1 типа. В то же время, согласно результатам исследования A1chieve в России, у пациентов при инициации базальной инсулинотерапии средний уровень гликированного гемоглобина (HbA1c) составлял 9,7%, готовыми смесями – 10,1%, базис-болюсной терапии – 10,4%. Эти данные свидетельствуют о том, что у эндокринологов сложилось мнение о необходимости начинать инсулинотерапию только при уровне HbA1c > 9,0%.
С учетом данных о взаимосвязи между состоянием компенсации углеводного обмена и частотой сосудистых осложнений, а также эффективной защитой бета-клеток инсулинотерапия при наличии показаний остается наиболее эффективным вариантом лечения СД 2 типа и единственным патогенетически обоснованным и жизненно необходимым – при СД 1 типа. В то же время, согласно результатам исследования A1chieve в России, у пациентов при инициации базальной инсулинотерапии средний уровень гликированного гемоглобина (HbA1c) составлял 9,7%, готовыми смесями – 10,1%, базис-болюсной терапии – 10,4%. Эти данные свидетельствуют о том, что у эндокринологов сложилось мнение о необходимости начинать инсулинотерапию только при уровне HbA1c > 9,0%.




Введение
Прогнозы экспертов Международной федерации диабета остаются неутешительными в отношении динамики заболеваемости сахарным диабетом (СД), несмотря на то что они всегда отличались оптимистичностью, а реальные цифры оказывались на десятки миллионов больше предполагаемых. Возрастание популяции больных СД, прежде всего СД 2 типа, и частоты его хронических осложнений – одна из актуальных проблем здравоохранения, с которыми сегодня сталкивается мировое сообщество. Скачкообразное увеличение распространенности данной патологии вносит существенный вклад в увеличение общих расходов [1].
Сахарный диабет – коварное заболевание, которое дает о себе знать, когда развиваются осложнения. У больных, плохо контролирующих свое состояние, очень высока частота инфаркта миокарда, мозгового инсульта, слепоты, почечной недостаточности и гангрены нижних конечностей. В связи с этим оптимизация подходов к фармакотерапии сахарного диабета является приоритетной задачей современной медицины.
Практически все международные и национальные рекомендации по инициации коррекции гликемии у пациентов с СД 2 типа указывают на необходимость начинать с изменения образа жизни и приема одного или нескольких пероральных сахароснижающих препаратов. Однако по мере прогрессирования заболевания фаза гиперсекреции инсулина сменяется фазой истощения, что приводит к дефициту инсулина. В этот период инсулинотерапия становится необходимостью. С учетом полученных данных о связи между состоянием компенсации углеводного обмена и частотой сосудистых осложнений, а также эффективной защитой бета-клеток от воздействия глюкозо- и липотоксичности инсулинотерапия при наличии показаний считается наиболее эффективным методом у пациентов с СД 2 типа и единственным патогенетически обоснованным и жизненно необходимым – у больных СД 1 типа.
Интерес к определению оптимального лечения СД 2 типа постоянно растет, что подтверждается появлением инновационных как пероральных, так и инсулиновых препаратов. Его конечной целью является предотвращение отдаленных осложнений СД и снижение смертности. Важным средством для этого служит улучшение и поддержание гликемического контроля с течением времени. К сожалению, это непростая задача из-за прогрессирующего течения заболевания. Таким пациентам требуется своевременная оптимизация лечения и в большинстве случаев – назначение инсулина [2].
Своевременному назначению инсулина препятствует ряд надуманных барьеров. Промедление в свою очередь чревато как длительной хронической гипергликемией, так и ее выраженной вариабельностью. Исследование A1chieve в России показало, что у пациентов при инициации базальной инсулинотерапии средний уровень гликированного гемоглобина (HbA1c) составил 9,7%, готовыми смесями – 10,1%, базис-болюсной терапии – 10,4%. Эти результаты свидетельствуют о том, что инсулинотерапию, как правило, назначают при уровне HbA1c > 9,0% [3]. Согласно данным B.R. Shah и соавт., даже если лечением управляют врачи-специалисты, его оптимизируют менее половины пациентов с высоким уровнем HbA1c [4]. Необходимо отметить, что в этом исследовании врачи-специалисты более активно назначали инсулин, чем врачи первичной медицинской помощи. Исследование A1chieve, проведенное P. Home и соавт., продемонстрировало, что средний HbA1c на момент инициации терапии инсулином составлял 9,5%, у 90,0% пациентов с СД уже было какое-то осложнение [5]. В данное наблюдательное неинвазивное исследование было включено более 66 000 лиц с диабетом, начавших или перешедших на аналогичную терапию инсулином.
Кроме того, показания к инициации лечения инсулином плохо определены в руководствах и подлежат обсуждению из-за широкого спектра мнений [6]. По сути, нет конкретной точки, с которой должна начинаться инсулинотерапия. В качестве одного из рациональных подходов может быть предложено рассмотрение некоторых клинических сценариев. Сроки старта терапии инсулином могут быть следующими [2]:
- во время установления диагноза или сразу после него;
- при усугубляющих течение диабета иных заболеваниях;
- в ходе планового амбулаторного лечения диабета.
Необходимо отметить, что последние годы показания к инсулинотерапии при СД 2 типа значительно расширились. Так, показаниями к ней являются недостаточность функции бета-клеток поджелудочной железы, выраженная глюкозотоксичность, непереносимость и недостаточная эффективность пероральных сахароснижающих препаратов [6, 7]. Согласно консенсусу Американской диабетической ассоциации и Европейской ассоциации по изучению диабета, терапия базальным инсулином признана терапией первого ряда при недостаточном контроле СД 2 типа в связи с более низким риском развития гипогликемий и прибавкой массы тела [8].
Инсулинотерапия при СД 2 типа: преимущества и недостатки
Эффект инсулина при СД 2 типа с момента постановки диагноза был оценен в ряде клинических исследований, в частности в проспективном исследовании сахарного диабета в Великобритании (UKPDS) и снижения исходов при начальном вмешательстве гларгином (ORIGIN) [9, 10].
Согласно результатам исследования UKPDS, ранний и постоянный контроль уровня глюкозы способствовал уменьшению риска микрососудистых осложнений и улучшению сердечно-сосудистого прогноза [11, 12].
Кроме того, улучшение гликемического контроля с помощью инсулина связано с улучшением самочувствия пациента, даже если целевые значения HbA1c не достигнуты [13].
Доказательная база в отношении старта терапии инсулином у больных СД 2 типа представлена в таблице [2].
Нежелательные эффекты инсулинотерапии, такие как увеличение массы тела и эпизоды гипогликемии, можно минимизировать за счет коррекции питания, уровня физической активности [5] и более разумного подхода к выбору индивидуальных целей терапии – в зависимости от возраста, наличия осложнений и сопутствующей сердечно-сосудистой патологии. В краткосрочных исследованиях, в которых сравнивали разные инсулины, установлено, что высокий процент лиц с диагностированным сахарным диабетом 2 типа, плохо контролируемым пероральными препаратами, могут достигать целевой гликемии без высоких показателей гипогликемии [14–16].
Использование базальных инсулинов с меньшей вариабельностью, более продолжительным периодом действия, стабильным высвобождением из подкожно-жировой клетчатки является предпочтительным в силу низкого риска развития гипогликемии [17].
Так, в исследовании ORIGIN инсулинотерапия применялась лицами с недавно диагностированным сахарным диабетом 2 типа и высоким риском сердечно-сосудистых заболеваний [10]. При продолжении предшествующей пероральной терапии и систематической титрации базального инсулина (гларгина) глюкозу натощак удавалось поддерживать на нормальном уровне (< 5,3 ммоль/л), HbA1c ≤ 6,3% более шести лет. Исследование ORIGIN показало, что, несмотря на поддержание очень хорошего гликемического контроля, использование инсулина было связано с увеличением массы тела всего лишь на 2,1 кг больше, чем при приеме пероральных препаратов, частота гипогликемии, требующей помощи, была весьма скромной (1% в год) и отсутствовали признаки увеличения риска озлокачествления или других серьезных нежелательных явлений.
Таким образом, можно утверждать, что доказательная база в отношении инсулина лучше, чем для любых других препаратов, снижающих уровень глюкозы, за исключением, возможно, метформина. Однако полученные данные не дают ответа на общие вопросы. Например, настало ли время начинать инсулинотерапию, следует ли рассматривать другие методы лечения [2]. Еще два вопроса: какой инсулин и какой режим введения следует выбирать? Важно подчеркнуть, что базальные инсулины имеют преимущества в отношении частоты инъекций и легкости титрации дозы [16, 18].
Аналог базального инсулина длительного действия – гларгин 300 ЕД/мл (Туджео СолоСтар®)
Гларгин 300 ЕД/мл, в настоящее время широко используемый в России, характеризуется меньшей вариабельностью, медленным высвобождением из преципитата препарата, минимальным риском эпизодов гипогликемии.
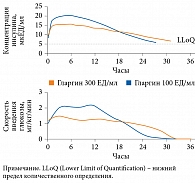
Туджео СолоСтар® обладает плавным фармакокинетическим профилем за счет более медленного и равномерного высвобождения из подкожного депо (рис. 1) [19]. Вследствие снижения объема вводимого инсулина длительность его действия увеличивается до 36 часов [20].
Оценка фармакологической активности инсулина гларгин 300 ЕД/мл проведена R.H. Becker и соавт. В ходе исследования пациентам с СД 1 типа (n = 50) вводили инсулин в дозе 0,4 ЕД/кг/сут в течение шести дней [21]. Выявлена низкая вариабельность концентраций инсулина. Медианное кумулятивное действие линейно увеличивалось в течение 24 часов, колебание средней концентрации составляло 3,3 (2,7–4,7) мкЕД/мл. Срединные вариабельность за 24 часа – 1,8 (1,6–2,1) мкЕД/мл, перепад – 0,8 (0,6–1,1) мкЕД/мл, колебание между максимальной и минимальной концентрацией в равновесном состоянии – 0,6 (0,4–0,8) мкЕД/мл. Средний показатель вариабельности за день достиг 17,4% с коэффициентом вариабельности действия между участниками 34,8%. Полученные данные свидетельствуют о том, что после введения инсулина гларгин 300 ЕД/мл наблюдались низкие колебания его концентраций с высоким уровнем воспроизводимости действия. Этот показатель оказался значительно ниже, чем у гларгина 100 ЕД/мл, который был равен 48% [22].
В другом исследовании R.H. Becker и соавт. изучили фармакокинетические и фармакодинамические профили инсулинов гларгин 300 и 100 ЕД/мл у пациентов с СД 1 типа (С-пептид плазмы < 0,3 нмоль/л) в равновесном состоянии после введения один раз в сутки в течение восьми дней [19]. Для этого использовали эугликемический клэмп. На восьмой день после введения последней дозы инсулинов в дозе 0,4 Ед/кг эугликемия сохранялась в течение 32,7 и 28,7 часа соответственно. При введении гларгина 300 ЕД/мл в дозе 0,6 Ед/кг – до 35,3 часа. Экспозиция гларгина 300 ЕД/мл по сравнению с экспозицией гларгина 100 ЕД/мл была более ровной на протяжении всего периода проведения клэмп-теста. При введении гларгина 300 ЕД/мл жесткий гликемический контроль (≤ 5,8 ммоль/л) удерживался на пять часов дольше, чем при использовании гларгина 100 ЕД/мл. Таким образом, в равновесном состоянии гларгин 300 ЕД/мл обладает более стабильным и пролонгированным фармакокинетическим профилем, чем гларгин 100 ЕД/мл.
Ровный профиль фармакокинетики и фармакодинамики, а также равномерное распределение концентрации в течение 24 часов в группе инсулина гларгин 300 ЕД/мл наблюдались при его применении как в дозе 0,4, так и в дозе 0,6 ЕД/кг/сут. Это свидетельствует о высокой воспроизводимости эффекта инсулина. Высокая воспроизводимость эффекта позволяет пациентам точнее подбирать дозу и самостоятельно осуществлять контроль гликемии [23].
Несмотря на то что инъекции инсулина не способны полностью заменить эндогенную выработку инсулина, идеальный базальный инсулин должен иметь стабильный фармакокинетический и фармакодинамический профиль. Менее выраженные колебания уровня глюкозы обеспечивают более предсказуемый суточный профиль и снижение риска гипогликемии. Как следствие, повышается приверженность терапии.
До сегодняшнего дня сравнение гларгина 300 ЕД/мл и деглудека 100 ЕД/мл основывалось на данных прямых исследований их фармакокинетики и фармакодинамики у пациентов с СД 1 типа, а также непрямых метаанализов клинических исследований [19, 24–26]. BRIGHT – первое рандомизированное клиническое прямое сравнительное исследование эффективности и безопасности гларгина 300 ЕД/мл и деглудека 100 ЕД/мл. Его целью было продемонстрировать не меньшую эффективность и безопасность в отношении снижения уровня HbA1c, а также частоты и встречаемости гипогликемии указанных препаратов у пациентов с СД 2 типа, не контролируемым неинсулиновыми сахароснижающими препаратами. В качестве первичной конечной точки выбрано изменение уровня HbA1c за 24 недели. Конечные точки для оценки безопасности включали встречаемость и частоту гипогликемий за данный период. Последний состоял из двух частей: титрации дозы препарата (с нулевой по 12-ю неделю) и поддержание дозы (с 13-й по 24-ю неделю). Участники исследования (n = 929) были рандомизированы в группу гларгина 300 ЕД/мл (n = 466) и группу деглудека 100 ЕД/мл (n = 463). Численность популяции с назначенным лечением в каждой группе – 462. Группы исследования были сопоставимы по исходным характеристикам. Наиболее часто используемыми неинсулиновыми препаратами были метформин (91,5%) и препараты сульфонилмочевины (65,7%). Исходный показатель HbA1c в группе гларгина 300 ЕД/мл составил 8,7%, деглудека 100 ЕД/мл – 8,6%. Через 24 недели в обеих группах рассматриваемый показатель снизился до 7,0%, разница средних наименьших квадратов (LS) – 0,05% (при 95%-ном доверительном интервале (ДИ) -0,15–0,05) (-0,6 [-1,7–0,6] ммоль/моль), что указывает на не меньшую эффективность гларгина по сравнению с деглудеком (p < 0,0001) (рис. 2). Доля пациентов, достигших целевого уровня HbA1c < 7,0% или целевого уровня HbA1c < 7,0% без подтвержденных гипогликемий (≤ 3,9 или < 3,0 ммоль/л) в любое время суток за 24 недели, в разных группах лечения была сопоставимой. Группы не различались по встречаемости и частоте подтвержденной гипогликемии (≤ 3,9 и < 3,0 ммоль/л) в любое время суток. Однако таковые в группе гларгина 300 ЕД/мл оказались ниже в период титрации дозы (р < 0,05) (рис. 3). Встречаемость и частота подтвержденной гипогликемии (≤ 3,9 и < 3,0 ммоль/л) в ночные часы (с 00:00 до 05:59) были сопоставимы в группах в течение всего периода терапии. Во время активной титрации дозы частота ночной подтвержденной гипогликемии (≤ 3,9 ммоль/л) была ниже в группе гларгина 300 ЕД/мл (номинальное значение p < 0,05) (рис. 4). К сильным сторонам настоящего исследования относятся прямой сравнительный рандомизированный дизайн и достаточная мощность для оценки первичной конечной точки – уровня HbA1c. Исследование было проведено эффективно с систематическим адекватным подбором дозы инсулина, большинство участников (с сопоставимыми исходными характеристиками) полностью выполнили его программу [27].
Титрация базального инсулина: как достичь баланса эффективности и безопасности
Большинству пациентов с СД 2 типа потребуется инсулинотерапия, которую со временем придется корректировать для поддержания достигнутых целей лечения. В крупных проспективных исследованиях установлено, что в клинической практике, как правило, не достигается оптимальный гликемический контроль и одним из препятствий для оптимальной инсулинотерапии является субоптимальная титрация дозы [28]. Активная титрация дозы сразу после инициации инсулинотерапии обычно связана с наибольшим увеличением доз инсулина, а также снижением уровня глюкозы плазмы и HbA1c. В большинстве случаев таковая требуется в первые 12 недель.
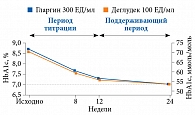
В 15 рандомизированных клинических исследованиях с использованием стратегии «до достижения цели» титрация дозы инсулина проводилась преимущественно в первые 12 недель (рис. 5) [29]. Так, доза инсулина с момента инициации терапии до 12-й недели увеличилась на 150%, в то время как с 12-й недели по 24-ю – всего на 2,5%. И эта тенденция наблюдалась при разных терапевтических режимах (рис. 6). Наиболее выраженный ответ отмечался в период титрации дозы инсулина (в первые 12 недель) у пациентов, получавших инсулин гларгин в комбинации с метформином (пять исследований), равно как и в комбинации с препаратами сульфонилмочевины (шесть исследований) или в комбинации с метформином плюс сульфонилмочевиной (девять исследований). Полученные в 15 рандомизированных клинических исследованиях данные однозначно свидетельствуют в пользу активной титрации дозы базального инсулина преимущественно в первые 12 недель для достижения целевых значений показателей углеводного обмена (HbA1c и глюкозы плазмы натощак) (рис. 6).
Анализ объединенных данных 15 рандомизированных клинических исследований показал, что гликемический ответ при титрации базального инсулина был более выражен на 12-й неделе (рис. 6). Уровень HbA1c с нулевой по 12-ю неделю снизился на 1,4%, с 12-й по 24-ю – на 0,2%. Аналогичная тенденция наблюдалась в отношении глюкозы плазмы натощак. В первые 12 недель на фоне активной титрации дозы базального инсулина таковая снизилась на 4,1 ммоль/л, в то время как во вторые 12 недель – лишь на 0,2 ммоль/л.
Следует отметить, что эти данные перекликаются c результатами наблюдательного ретроспективного анализа, проведенного D. Mauricio и соавт. (2008–2012 гг.). В исследование было включено 40 627 пациентов с СД 2 типа на терапии пероральными сахароснижающими препаратами в комбинации с агонистами рецептора глюкагоноподобного пептида 1 типа или без таковых, начавших лечение базальным инсулином. Это были больные из Франции, Германии, Италии, Испании, Великобритании и США. Установлено, что если в первые три месяца цель терапии не достигается, то через 24 месяца также возможно недостижение уровня HbA1c ≤ 7,0%. Таким образом, данное наблюдение подтверждает, что гликемическая реакция в течение первых 12 недель терапии базальным инсулином является предиктором средне- и долгосрочного гликемического контроля [30].
K. Khunti и соавт. (2013) выделили две фазы инсулинотерапии. Первая фаза – начало терапии и титрация дозы. Соответствует первым 8–12 неделям после инициации инсулинотерапии. Вторая фаза – поддерживающая терапия. В этот период доза инсулина чаще всего остается стабильной, за исключением случаев, когда ее коррекция необходима по соображениям безопасности (например, при гипогликемии) [29, 31, 32].
В клинической практике инерция при подборе дозы инсулина приводит к низкой частоте достижения целевых показателей гликемии, несмотря на использование упрощенных стратегий лечения [33]. Отсрочка c интенсификацией терапии на один год сопровождается повышением риска инфаркта миокарда, инсульта и сердечной недостаточности [34], а устаревшая практика поддержания дисгликемии влияет на качество жизни пациентов [32].
Заключение
Гларгин 300 ЕД/мл обладает усовершенствованным фармакокинетическим и фармакодинамическим профилем по сравнению с инсулином гларгин 100 ЕД/мл, в частности более плавным действием. В исследовании с непрерывным мониторированием гликемии у взрослых пациентов с сахарным диабетом 1 типа гларгин 300 ЕД/мл в отличие от гларгина 100 ЕД/мл продемонстрировал менее выраженную вариабельность действия в период применения и в течение суток, снижая таким образом риск подтвержденной ночной или тяжелой гипогликемии. У лиц, ранее не получавших инсулин и с неадекватным контролем СД 2 типа, гларгин 300 ЕД/мл и деглудек 100 ЕД/мл обеспечивали сопоставимый гликемический контроль при сопоставимой частоте гипогликемий в течение всего периода исследования. При этом меньшая частота и доля пациентов с подтвержденными гипогликемиями в любое время суток отмечались в период титрации дозы инсулина гларгин 300 ЕД/мл. Основную часть процесса титрации базального инсулина следует проводить в среднем в первые 12 недель после инициации лечения (150,0 vs 12,5%). Наиболее выраженный гликемический ответ также наблюдался в первые 12 недель: HbA1c – 1,4 vs 0,2%, глюкоза плазмы натощак – 4,1 vs 0,2 ммоль/л. Аналогичные феномены в титрации и гликемическом контроле отмечались в первые 12 недель в рандомизированных клинических исследованиях и в условиях реальной практики.
Гликемический ответ на протяжении первых 12 недель терапии базальным инсулином является предиктором средне- и долгосрочного гликемического контроля.
Эффективная и безопасная титрация инсулина – ключ к достижению краткосрочных и долгосрочных исходов.
A.M. Mkrtumyan, MD, PhD, Prof.
A.I. Yevdokimov Moscow State University of Medicine and Dentistry
A.S. Loginov Moscow Clinic Scientific Center
Contact person: Ashot M. Mkrtumyan, vagrashot@mail.ru
The article is devoted to the role of timely initiation of insulin therapy for effective correction of glycemia – the main cause of vascular and other complications. Correction of glycemia in most patients with type 2 diabetes mellitus (DM) begins with a change in lifestyle and taking one or more oral hypoglycemic agents. However, as the disease progresses, the necessity of insulin prescribing appears.
Taking into account the data on the connection between the state of carbohydrate metabolism compensation and the vascular complications frequency, as well as the effective beta-cells protection, insulin therapy in the presence of indications remains the most effective treatment option for type 2 diabetes and the only pathogenetically justified and vital – in type 1 diabetes. At the same time, according to the results of the A1chieve study in Russia, in patients with initiation of basal insulin therapy, the average level of glycated hemoglobin (HbA1c) is 9.7%, ready mixtures – 10.1%, basic bolus therapy – 10.4%. These data indicate that endocrinologists have the opinion that it is necessary to start insulin therapy only at the level of HbA1c > 9.0%.
