Псориаз и заболевания пищеварительной системы у детей
- Аннотация
- Статья
- Ссылки
- English
Псориаз является распространенным хроническим иммуноопосредованным воспалительным заболеванием, которое характеризуется нарушением процессов кератинизации и развитием патологических очагов в коже, ногтях и суставах как у детей, так и у взрослых [1]. Особое место в дерматологии занимает псориаз у детей, так как заболевание может оказывать существенное влияние на качество жизни, способствуя снижению показателей умственной, эмоциональной, физической и социальной активности по сравнению со здоровыми детьми [2, 3]. При дообследовании почти у 50% пациентов с хроническими дерматозами выявляется патология желудка, а у 30% – воспалительные изменения в тонкой кишке [4]. У детей с псориазом также отмечают сопутствующие заболевания желудочно-кишечного тракта (ЖКТ) [5]. Согласно данным исследования, проведенного в 2018 г. Y. Fu и соавт., у детей с псориазом встречаемость воспалительных заболеваний кишечника (ВЗК) увеличивается в 1,75 раза, а вероятность развития болезни Крона – до 1,7 раза [6]. Показано также, что у пациентов как с псориазом, так и с ВЗК выявляются схожие изменения микробного пейзажа [7].
Эпидемиология
Псориаз является одним из самых распространенных хронических дерматозов, которым страдают от 0,91 до 8,5% населения во всем мире [8]. На распространенность заболевания оказывают влияние ряд факторов, усугубляющих друг друга: возраст, пол, генетические, экологические факторы, этническая принадлежность, климат и пр. [9]. Обнаружено, что у представителей европеоидной расы в Европе, США, Канаде и Австралии псориаз более распространен, чем у представителей других рас, а реже всего данным дерматозом болеет население азиатских, африканских и латиноамериканских стран (от 0,3 до 0,9% случаев) [10]. Так, частота заболеваемости псориазом в Индии составляет от 0,5 до 2,3%, в Малайзии – до 5,5%, в Японии – от 0,29 до 1,18%. В разных регионах Китая заболевемость колеблется от 0,05 до 1,23%. Низкую заболеваемость псориазом у азиатов связывают с низкой регистрацией основного иммуногенетического маркера дерматоза – HLA-Cw6 [11]. В странах Южной Америки распространенность заболевания находится в диапазоне от 1,3 до 4,2% (в Бразилии – 1,3%, в Венесуэле – 2%, в Мексике – 3%, в Парагвае – 4,2%). В США частота встречаемости данной патологии в среднем составляет 2,4%, тогда как в северных штатах уровень заболеваемости значительно выше [12]. В последние годы в Российской Федерации отмечается высокий уровень заболеваемости псориазом в детском и особенно в подростковом возрасте [13].
В ряде исследований показаны два возрастных пика манифестации псориаза у детей: в 6–7 лет и в пубертатном периоде, что совпадает с периодами физиологического вытягивания ребенка. В большинстве случаев начало болезни связано со стрессом и длительными психоэмоциональными перегрузками. Особенности клинической картины и течения псориаза у детей зависят от возраста. Для подросткового периода характерны более частая манифестация заболевания и развитие тяжелых форм, для раннего детского возраста – преобладание экссудативных форм с атипичной локализацией очагов (веки, область естественных складок, гениталии) [14]. До 15-го года жизни псориаз развивается примерно у 25% детей. Заболеваемость в возрастном диапазоне с 14 до 17 лет превышает аналогичный показатель среди взрослых в 1,8 раза. Согласно данным литературы, псориаз в два раза чаще встречается у девочек по сравнению с мальчиками [15, 16]. Современные исследования часто демонстрируют связь псориаза с поражениями других органов и систем [17]. Псориаз у детей и подростков способен оказывать крайне негативное влияние на качество их жизни, при этом остается малоизученной сама проблема распространенности сопутствующей патологии в зависимости от возрастного ценза [18].
Патогенез и факторы риска
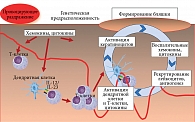
Согласно современным данным, в основе развития псориаза лежат генетические изменения, нарушения реакций адаптивного и врожденного иммунитета, а также ряд факторов риска, благодаря которым реализуются все патогенетические механизмы болезни [19]. В патогенезе псориаза одним из ведущих факторов является генетическая детерминированность, которая оказывает влияние не только на механизмы развития заболевания, но и на тяжесть его течения. До 30% детей имеют родственника первой линии родства, страдающего псориазом [20]. Также высокий риск формирования болезни, в том числе в детском возрасте, связан с полиморфизмами в аллелях гена Il12b, который кодирует общую субъединицу интерлейкина (ИЛ) 12 и ИЛ-23 – p40, и гена Il23r, кодирующего рецептор ИЛ-23 [21]. Не менее важную роль в патогенезе псориаза играют иммунные изменения, такие как нарушения соотношения числа Т- и В-лимфоцитов, их контактной сенсибилизации, увеличение содержания иммуноглобулина (Ig) A, IgE, IgG (рис. 1) [22, 23].
В эпидермисе псориатических элементов наблюдаются отложения иммунных комплексов, антител и комплемента [24]. Считается, что за развитие проявлений псориаза ответственны взаимодействия между кератиноцитами и иммунными клетками, такими как нейтрофилы и тучные клетки, дендритные клетки, а также экспрессия ряда цитокинов (фактор некроза опухоли (ФНО) α, ИЛ-17, ИЛ-20, ИЛ-22 и пр.) [25]. Ключевыми цитокинами, во многом влияющими на патогенез, являются ИЛ-12 и ИЛ-23 [26]. У детей к предрасполагающим факторам развития болезни относятся инфекции бета-гемолитических стрептококков, которые способствуют активации T-клеток, стрессы и психоэмоциональное перенапряжение, травмы кожи, которые клинически проявляются феноменом Кебнера (изоморфной реакцией), ветряная оспа, прием некоторых лекарственных средств (тетрациклины, нестероидные противовоспалительные препараты, антималярийные препараты и др.) [27, 28].
Важно отметить, что у больных псориазом ВЗК встречаются чаще, чем в общей популяции. Так, с 2010 по 2018 г. S. Masaki и соавт. наблюдали 681 пациента с псориазом в университетском госпитале в Фукуоке (Япония). Было выявлено, что за данный период времени язвенный колит (ЯК) дебютировал у 1,2%, а болезнь Крона (БК) – у 0,3% [29, 30]. При ВЗК и наличии псориаза транслокация бактериальных метаболитов, обусловленная повышением проницаемости кишечного барьера, не индуцируется одним специфичным бактериальным видом, а связана с бактериальным дисбалансом, который в последующем приводит к нарушению регуляции в системе «микробиота – кишечный барьер» [31]. У пациентов с ВЗК течение псориаза усугубляет рост барьерной проницаемости с последующим выходом метаболитов бактерий кишечника в кровоток. Это инициирует субклиническое системное воспаление и влияет на реактивность иммунных клеток крови [32]. Псориаз и ВЗК имеют сходные иммунологические механизмы развития и генетические факторы. Генетический полиморфизм ИЛ-23R, определяющий сигнальный ИЛ-12/23 путь иммунопатогенеза, является одним из них [33].
Псориаз и заболевания пищеварительного тракта
Общеизвестно, что пищеварительный тракт и кожный покров тесно взаимосвязаны, что объяснимо общностью происхождения (из одного зародышевого листка – эктодермы) и схожей функциональной ролью [34]. Прежде всего органы пищеварения и кожа участвуют в регуляции гомеостаза всего организма, а также выполняют барьерную функцию. Рост патологии кожи в популяции можно объяснить высокой заболеваемостью со стороны пищеварительной системы. Примерно у 50% пациентов с хроническими дерматозами при дообследовании выявляется патология желудка, а воспалительные изменения в тонкой кишке обнаруживаются у 30% [35–37].
У детей псориаз признан независимым фактором риска развития метаболического синдрома (МС) [38]. В исследовании S.C. Au и соавт. была показана распространенность МС у детей с псориазом в сравнении с контролем (30 и 7,4% соответственно), однако у пациентов обеих групп не было выявлено значимых различий в индексе массы тела (ИМТ) [39]. Также установлена взаимосвязь ожирения и псориаза в детском возрасте и большая, чем в общей популяции, частота встречаемости центрального распределения подкожно-жировой клетчатки [40], что позволяет расценивать избыточную массу тела как возможный предиктор развития заболевания [41]. У детей, страдающих дерматозом, даже при контроле массы тела сохраняется тенденция к повышению уровней липидов, триглицеридов и холестерина, наравне с изменениями соотношения в крови составляющих липопротеидов, что и послужило первопричиной появления таких терминов, как «холестериновая болезнь» и «липоидоз кожи» [42]. Различия в распространенности коморбидных заболеваний обусловлены особенностями детского возраста, в связи с чем возникает необходимость проведения скринингов данных заболеваний в определенных возрастных группах. Ожирение и МС являются одними из часто встречающихся, в то время как изолированная дислипидемия, сахарный диабет второго типа, ВЗК являются более редкими коморбидными патологиями, что предполагает индивидуальный подход к профилактике и скринингу [43].
В условиях окислительного стресса отмечается стремительное снижение уровня липопротеидов высокой плотности (ЛПВП), включая антиатерогенную, противовоспалительную и антиоксидантную активность [44]. Пациенты с псориазом имеют более низкие уровни защитных ЛПВП и высокие – липопротеидов низкой плотности (ЛПНП). Отмечено также увеличение размера ЛПВП-частиц, которое характерно для больных сахарным диабетом [45]. Как при псориазе, так и при ВЗК наблюдаются идентичные изменения микробного пейзажа кишечника [46, 47]. Часто в осложненной форме протекает дерматоз, ассоциированный с БК [48, 49]. Имеется также тесная взаимосвязь псориаза с неалкогольной жировой болезнью печени (НАЖБП) [50]. В исследовании P. Gisondi и соавт. были изучены 130 пациентов с псориазом (ни один из них не получал потенциально гепатотоксичных препаратов). Авторами было выявлено, что распространенность НАЖБП была почти в два раза выше среди пациентов с дерматозом, чем в контрольной группе, представленной соматически здоровыми добровольцами (47 и 28% соответственно) [51].
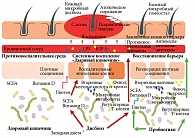
В результате воспалительных процессов как у детей, так и у взрослых, страдающих псориазом, нарушения микробиоценоза и/или увеличение кишечной проницаемости приводят к патологической транслокации продуктов метаболизма, микробных токсинов и антигенов во внутренние среды организма [52] (рис. 2).
Типичным признаком дисбиоза толстой кишки у таких пациентов является истощение числа симбионтных бактерий, включая Bifidobacterium spp., Faecalibacterium prausnitzii, Lactobacterium spp., наряду с колонизацией некоторыми патогенными микроорганизмами: Helicobacter spp., Campylobacter spp., Mycobacterium spp., Escherichia coli, Salmonella spp., Alcaligenes spp. и др. [53]. Вследствие этого избыточно стимулируются иммунные клетки и запускается каскад аномальных воспалительных и аллергических реакций [54].
Таким образом, раннее распознавание кожных проявлений, связанных с заболеваниями ЖКТ, дает возможность своевременно направить пациента к гастроэнтерологу с целью определения дальнейшей тактики его ведения.
Лечение
По результатам анализа двух баз данных США было показано: при ВЗК риск развития псориаза повышается в 1,5 раза и более чем в три раза – всех мышечно-скелетных иммуновоспалительных заболеваний, который особенно высок при БК [55]. В исследовании A.B. Gottlieb и соавт. были обобщены данные систематических обзоров литературы и метаанализа 79 исследований. Обнаружено, что БК и ЯК оказались в числе наиболее частых коморбидных состояний при псориазе [56]. В настоящее время базисные противовоспалительные методы терапии псориаза далеко не всегда позволяют контролировать течение заболевания, не оказывают терапевтический эффект на ассоциированные с псориазом коморбидные состояния, а их длительное использование ограничено целым рядом побочных эффектов [57]. Современные достижения в изучении биологических препаратов позволяют минимизировать риск побочных эффектов системной иммуносупрессивной терапии в детском возрасте с помощью таргетного воздействия на конкретные звенья патогенетического процесса [58].
В начале 1990-х гг. у больных псориазом были обнаружены повышенные уровни ФНО-α, после чего последовало создание нескольких антител, способных блокировать активность ФНО-α, а также блокаторы рецепторов ФНО-α [59]. Данные препараты вывели лечение больных псориазом на принципиально новый уровень и кардинальным образом изменили подходы к лечению ряда других аутоиммунных заболеваний: ревматоидного артрита, ВЗК и др. [60]. В последующем были синтезированы генно-инженерные биологические препараты (ГИБП). На данный момент основные группы ГИБП при данном дерматозе включают блокаторы ФНО-α, ИЛ-12/23 и ИЛ-17 [61]. В настоящее время пересечение терапевтического спектра при псориазе и ВЗК является ключевым моментом при определении тактики ведения данной категории больных, что, безусловно, влияет на выбор ГИБП [62].
Терапия, направленная на ФНО-α, значительно расширила терапевтические возможности для пациентов с ВЗК, ревматоидным артритом, псориазом и псориатическим артритом и значительно улучшила качество жизни пациентов. Однако, несмотря на эффективность анти-ФНО-препаратов, у 30–40% пациентов с ВЗК наблюдается отсутствие первичного ответа на терапию, а у 20–30% больных развивается вторичная потеря ответа на данные препараты в течение первого года терапии [63]. Также анти-ФНО-α агенты могут вызывать псориатические высыпания или ухудшить течение ранее существовавшего псориатического заболевания кожи de novo, что получило название «парадоксальный псориаз». При рефрактерном течении ВЗК большинство исследователей предлагают рассматривать альтернативные варианты лечения, например моноклональные антитела к белку α4β7-интегрину (ведолизумаб) и блокаторы ИЛ-12/23 (устекинумаб) [64]. С появлением в арсенале дерматовенерологов устекинумаба терапевтические опции для категории больных с непереносимостью и/или «парадоксальными» реакциями на ингибиторы ФНО-α значительно расширились [65]. Так, согласно данным рекомендаций Британской ассоциации дерматовенерологов (British Association of Dermatologists), устекинумаб характеризуется самой низкой частотой развития нежелательных явлений на 1000 пациентов в сравнении с секукинумабом, инфликсимабом, адалимумабом и этанерцептом [66].
По данным многочисленных исследований, именно ингибирование регуляторных цитокинов ИЛ-12/23 имеет целый ряд преимуществ в сравнении с блокированием эффекторных цитокинов (ФНО-α, ИЛ-17) благодаря потенциально долгосрочному устойчивому результату терапии и более редкому режиму введения препарата [67, 68]. Предполагается, что аналогично тому, как ингибитор ФНО-α способен индуцировать псориаз из-за дисбаланса цитокинов (повышенной экспрессией IFN типа I), устекинумаб блокирует активность ИЛ-23, который в большом количестве вырабатывают «IFNα-спровоцированные» дендритные клетки. В данном случае одним из преимуществ устекинумаба является не только его эффективность как при псориазе, так и при ВЗК, но и доказанная эффективность при ладонно-подошвенной форме псориаза. Необходимо отметить, что отмена ГИБП в детском возрасте в основном связана с прогрессирующей потерей эффективности. Существуют определенные факторы риска наступления неэффективности биологической терапии – высокий ИМТ на момент инициации ГИБП, отягощенный семейный анамнез, последующая смена одного или нескольких ГИБП [69]. Назначение ГИБП пациентам с псориазом всегда должно проводиться с учетом особенностей клинической картины пациента, наличия сопутствующих и коморбидных заболеваний, а также с учетом факторов риска, связанных с неэффективностью проводимой терапии или влияющих на длительность терапевтического эффекта [70].
Заключение
Псориаз представляет собой хроническое системное воспалительное неинфекционное заболевание, течение которого зависит от наличия многих сопутствующих заболеваний. Особую роль в возникновении псориаза играет гастроинтестинальная патология, что, безусловно, должно учитываться при выборе тактики ведения пациентов с помощью постоянного анализа и мониторинга таких пациентов.
M.Yu. Lysenko
National Medical Research Center for Child Health, Moscow
Contact person: Marina Yu. Lysenko, mpomazanova87@mail.ru
There is a growing body of evidence suggesting a close relationship between psoriasis and gastrointestinal pathology. This review article provides a brief historical sketch of the disease, presents current epidemiological data on the prevalence of psoriasis in children, analyzes issues of etiology and pathogenesis, and provides information on the role of diseases of the digestive system in children with psoriasis. Treatment of the disease are considered separately. The current literature review is intended to summarize the current information about psoriasis in children to help pediatricians and clinicians.
