Современная медикаментозная терапия вторичного (почечного) гиперпаратиреоза
- Аннотация
- Статья
- Ссылки




Хорошо известно, что существует тесная связь между хроническими прогрессирующими заболеваниями почек и патологическими изменениями скелета. Имеющиеся данные подтверждают наличие взаимодействия между сопутствующими почечной недостаточности нарушениями кальций-фосфорного обмена, костного метаболизма и сердечно-сосудистыми заболеваниями. В 2006 г. в международной программе «Заболевания почек: улучшение мировых результатов лечения» (Kidney Disease: Improving Global Outcomes, KDIGO) был предложен принципиально новый термин для обозначения установленной взаимосвязи – «хроническая болезнь почек – минерально-костные нарушения (ХБП-МКН)» [1].
Распространенным, имеющим серьезные последствия вариантом течения ХБП-МКН является вторичный гиперпаратиреоз (ГПТ). Это полиорганное полисистемное заболевание, к патогенетическим факторам которого относятся возникающие при снижении функции почек задержка в организме неорганического фосфата, гипокальциемия, нарушение метаболизма D-гормона (кальцитриола) и аномальный кальциемический ответ кости на действие паратиреоидного гормона (ПТГ) [2]. У диализных больных риск возникновения и/или прогрессирования ГПТ не только сохраняется, но и возрастает пропорционально длительности лечения.
Судить о распространенности ГПТ в диализных центрах, в том числе отечественных, довольно сложно. Это связано и с тем, что ведущие в этой области эксперты («Инициатива качества лечения заболеваний почек» (Kidney Disease Outcomes Quality Initiative, KDOQI и KDIGO)) рекомендуют различные целевые уровни в крови ПТГ, кальция и фосфора, и с тем, что в России повсеместное определение этих биохимических маркеров минерально-костных нарушений затруднено [3–8].
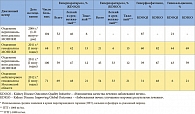
Проведенный нами анализ частоты и тяжести ГПТ, а также частоты нарушений со стороны кальций-фосфорного обмена в популяции больных, получающих заместительную почечную терапию гемо- и перитонеальным диализом в нескольких центрах Московской области, свидетельствует о достаточно высокой распространенности этих состояний – от трети до половины пациентов нуждаются в профилактике развития и лечении ГПТ и сопутствующих расстройств кальций-фосфорного обмена (табл. 1).
Терапевтическая тактика при вторичном ГПТ заключается в комплексном воздействии на основные патогенетические механизмы заболевания. Важное место в лечебном процессе занимают современные лекарственные средства – препараты D-гормона и кальцимиметики, имеющие различный механизм действия (табл. 2). Далее в статье нами обобщен собственный опыт использования этих классов препаратов в лечении ГПТ у диализных больных.
Препараты D-гормона в лечении ГПТ
К настоящему времени накоплен большой опыт применения препаратов D-гормонов (кальцитриол, его синтетический аналог альфакальцидол) для лечения вторичного ГПТ, свидетельствующий об обратном развитии как лабораторных, так и костных нарушений на фоне лечения [4, 9–11]. Назначение этих препаратов приводило к снижению в крови уровня ПТГ, стабилизации или росту массы костной ткани. Увеличение параметров костеобразования и минерализации новообразованной костной ткани, уменьшение показателей резорбции, активизация пролиферации и дифференцировки клеток-предшественников остеобластов подтверждались данными гистоморфометрии и изучения клеточных культур. Лечебный эффект кальцитриола и его синтетических аналогов связан, во-первых, с повышением плотности рецепторов к витамину D, расположенных на поверхности паратироцитов (что восстанавливает чувствительность околощитовидных желез к сывороточному кальцию), а во-вторых, со снижением резистентности костей к действию ПТГ. Подавляя транскрипцию гена ПТГ и тем самым замедляя избыточную пролиферацию паратиреоидных клеток, кальцитриол и его синтетические аналоги приводят к уменьшению объема гиперплазированных околощитовидных желез [12].
Помимо околощитовидных желез, органами-мишенями активных форм витамина D являются тонкий кишечник, где увеличивается абсорбция потребляемых с пищей кальция и фосфора, и кости, в которых усиливаются резорбтивные процессы. Если небольшое увеличение концентрации кальция в крови у больных с гипокальциемией является патогенетическим действием препаратов, то чрезмерное – побочным. Кроме того, бесконтрольное применение активных форм витамина D может привести к развитию низкообменного заболевания костей – адинамической костной болезни. Тем не менее, несмотря на высокий риск побочных эффектов, активные формы витамина D до недавнего времени широко использовались в лечении почечного ГПТ [3, 9, 13].
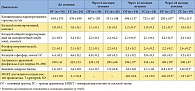
Проведенное нами сравнительное клиническое проспективное исследование, включившее 58 пациентов, получающих заместительную терапию перитонеальным диализом, продемонстрировало достаточно высокую эффективность препаратов D-гормона (кальцитриол, альфакальцидол) в лечении и предупреждении прогрессирования вторичного ГПТ. В основную группу вошли 34 пациента, из них 23 пациента с ГПТ легкого течения и 11 пациентов с ГПТ умеренно тяжелого течения. Группу сравнения составили 24 человека, из них 15 пациентов с ГПТ легкого течения и 9 больных с ГПТ умеренно тяжелого течения. Были проанализированы результаты клинического, лабораторного и инструментального исследований на протяжении 2 лет (табл. 3). К концу наблюдения в группе пациентов, регулярно принимавших препараты D-гормона, уменьшение интенсивности / исчезновение болевого синдрома было зарегистрировано у 85% пациентов, в группе сравнения – нарастание интенсивности или появление болевого синдрома у 62,5%. Среднее снижение уровня ПТГ через 6 месяцев составило 18%, через 1 год – 35%; среднее снижение активности щелочной фосфатазы – соответственно 8% и 18%. Через 1 год в основной группе число пациентов с целевым уровнем ПТГ увеличилось на 32,4%, в то время как в группе сравнения – уменьшилось на 37,5%. В основной группе сывороточные концентрации кальция и фосфора демонстрировали однонаправленную тенденцию к повышению, в группе сравнения – такую же для фосфора и противоположно направленную для кальция. Через 1–2 года наблюдения сывороточная концентрация фосфора в основной группе увеличилась на 5–10%, в группе сравнения – на 14–24%, кальций-фосфорное произведение – соответственно на 9–16% и 9–20%. Сравнение результатов динамической денситометрии дистального отдела костей предплечья и рентгенографии кистей подтверждало эффективность препаратов D-гормона в профилактике и лечении ГПТ.
За все время наблюдения гиперкальциемия и гиперфосфатемия, потребовавшие временного уменьшения дозировки или отмены препарата, регистрировались соответственно у 6% и 79% больных через один год лечения и у 11% и 74% больных через 2 года лечения. У 4 больных, длительно принимавших альфакальцидол, данные клинико-рентгено-лабораторного обследования соответствовали адинамической костной болезни. После коррекции дозы препарата (временной отмены и затем назначения в меньшей дозе) у 3 из них (4-й больной отказался отменять прием альфакальцидола) отмечено увеличение плазменной концентрации ПТГ до целевого уровня и активности щелочной фосфатазы. У 1 больного развились деформация, дефигурация и ограничение подвижности правого плечевого сустава. При рентгенографии сустава определялись признаки периартикулярно расположенных депозитов кальция, регрессировавших после отмены карбоната кальция и альфакальцидола.
Таким образом, результаты представленного исследования убедительно демонстрируют, что у диализных больных неселективные аналоги D-гормона эффективны для профилактики развития, а также лечения и предупреждения прогрессирования легкого и умеренно выраженного ГПТ, не сопровождающегося гиперкальций- и гиперфосфатемией. Регулярный прием этих препаратов приводит к нормализации кальциевого баланса, снижению и достижению целевого уровня ПТГ в крови, то есть обеспечивает патогенетическое воздействие. На этом фоне улучшается костный метаболизм, минимизируется потеря и происходит увеличение костной минеральной массы. Однако присущие данному классу препаратов побочные эффекты, такие как гиперфосфатемия, встречаются достаточно часто, гиперкальциемия и избыточное подавление функции околощитовидных желез – реже.
Стремление нивелировать нежелательные явления, свойственные препаратам D-гормона, привело к созданию новой группы лекарственных средств, обладающих селективной активацией рецепторов витамина D, расположенных на поверхности главных клеток околощитовидных желез. Доклинические и клинические испытания показали: насколько эти препараты активны в отношении подавления секреции ПТГ, настолько они неактивны в отношении всасывания кальция и фосфора в кишечнике и резорбции их из костей [14]. Среди селективных активаторов рецепторов витамина D наиболее широкое клиническое применение в лечении ГПТ приобрел парикальцитол. Опыт его использования за рубежом составляет 10 лет, за которые препарат доказал свою клиническую и экономическую эффективность. В более ранних зарубежных публикациях и данных недавних отечественных исследований всесторонне представлены все аспекты применения парикальцитола при вторичном ГПТ [15–19].
В России парикальцитол зарегистрирован в 2010 г., опыт его применения накапливается. Было проведено 12-недельное исследование влияния парикальцитола на параметры костного метаболизма и кальций-фосфорного обмена у 10 гемодиализных больных с легким (n = 5), умеренно тяжелым (n = 3) и тяжелым (n = 2) течением ГПТ (табл. 4). Парикальцитол вводился внутривенно в конце каждого сеанса гемодиализа в дозе 5 мкг.
Устойчивое (на протяжении 3 месяцев) снижение плазменной концентрации ПТГ с достижением целевого уровня регистрировалось у 6, отсутствие динамики – у 2 и увеличение содержания ПТГ – у 2 больных. Среднее снижение ПТГ к концу срока наблюдения составило 34%, активности щелочной фосфатазы – 3%. Увеличение сывороточной концентрации кальция регистрировалось у всех больных, из них в пределах целевого уровня – у 8; увеличение сывороточной концентрации фосфора выше целевого уровня – у 7 больных. Общий профиль переносимости парикальцитола оказался удовлетворительным.
Таким образом, первый опыт применения парикальцитола свидетельствует о перспективности его использования с целью предупреждения прогрессирования и лечения вторичного (почечного) ГПТ у пациентов с целевыми параметрами кальций-фосфорного обмена. В отношении снижения ПТГ препарат не уступает по эффективности неселективным активаторам рецепторов витамина D. Коррекция дозы препарата и/или схемы лечения по результатам мониторинга показателей кальций-фосфорного обмена и костного метаболизма повысит устойчивость антигиперпаратиреоидного эффекта препарата.
Цинакалцет в лечении ГПТ
Несколько лет назад в арсенале клиницистов появился новый препарат с принципиально иным антигиперпаратиреоидным механизмом действия – цинакалцет. На сегодняшний день цинакалцет является первым и единственным кальцимиметиком, оказывающим универсальное воздействие на околощитовидные железы. Он вызывает аллостерическую модуляцию кальцийчувствительных рецепторов, расположенных на поверхности главных клеток, и тем самым снижает порог реакции этих рецепторов на внеклеточный кальций. Это обеспечивает регуляцию и точный контроль секреции ПТГ, что приводит к подавлению и обратному развитию гиперплазии околощитовидных желез [20–25]. Доклинические и клинические испытания убедительно продемонстрировали способность цинакалцета не только снижать и длительно удерживать в целевом диапазоне уровень ПТГ в крови и одновременно контролировать состояние кальций-фосфорного обмена, но и улучшать прочность костной ткани и предупреждать развитие сосудистого и сердечного кальциноза [26–28].
Клиническая эффективность цинакалцета в отношении биохимических маркеров ГПТ (легкого – 16, умеренно тяжелого – 5, тяжелого – 21) продемонстрирована в открытом несравнительном исследовании продолжительностью от 3 до 36 месяцев, включавшем 42 больных на заместительной почечной терапии – гемодиализе (n = 30), перитонеальном диализе (n = 10) – и пациентов с функционирующим почечным трансплантатом (n = 2). Альфакальцидол (0,5–0,75 мкг/сут) и карбонат кальция (4–7 г/сут) по показаниям назначались исходно или добавлялись в последующем.
К концу 6-го месяца приема цинакалцета плазменная концентрация ПТГ снизилась в среднем на 41 ± 22%, достигнув целевого диапазона у 14 больных, причем степень снижения не зависела от исходной, составив от 0 до 75%. Снижение сывороточной концентрации кальция с развитием гипокальциемии регистрировалось у 46%, снижение сывороточной концентрации фосфора – у 54% больных. Таким образом, частота исходной гиперфосфатемии составила 63%, через 6 месяцев – 35%. Степень снижения уровней в крови кальция и фосфора была тем значительнее, чем выше были начальные значения. К концу первого года лечения целевых уровней ПТГ достигли 28 пациентов, к концу второго – все больные (табл. 5). Гипокальциемия сохранялась в среднем у трети больных.
Высокая клинико-лабораторная эффективность цинакалцета в поддерживающей дозе 15–45 мг/сут установлена у всех (n = 5) больных с вторичным ГПТ, перенесших паратиреоидэктомию, осложнившуюся персистированием или рецидивированием процесса. Высокая клинико-лабораторная эффективность цинакалцета также была определена у реципиентов почечного трансплантата, имеющих третичный ГПТ. Достижение целевого уровня биомаркеров ГПТ сопровождалось положительной клинической симптоматикой, выражавшейся в уменьшении интенсивности болевого костно-суставного и мышечного синдромов и повышении двигательной активности, а также в отсутствии отрицательной рентгенологической и денситометрической динамики. При повторной денситометрии костей скелета через год средний прирост минеральной плотности костной ткани в поясничном отделе позвоночника (L1–L4) составил 8%, в дистальном отделе костей предплечья – 6%, в шейке бедренной кости – 5%. Для сравнения: в эти же сроки у пациентов, не получавших лечения цинакалцетом, регистрировалась отрицательная динамика с потерей минеральной плотности костной ткани в поясничном отделе позвоночника (L1–L4), в дистальном отделе костей предплечья и в шейке бедренной кости, в среднем составившая соответственно 10%, 11% и 10%.
Недостаточный эффект в первые месяцы лечения цинакалцетом отмечен нами у 5 пациентов с тяжелым течением ГПТ, из которых 4 пациентам была выполнена паратиреоидэктомия. Один пациент, отказавшийся от хирургического лечения, вновь вернулся к приему цинакалцета. Через 1,5 года у него отмечена нормализация ПТГ, параметров кальций-фосфорного обмена и уменьшение объема исходно увеличенных правых околощитовидных желез.
Таким образом, приведенные данные свидетельствуют о высокой эффективности и безопасности цинакалцета для лечения ГПТ у больных ХПН, получающих заместительную почечную терапию. Препарат обеспечивает хороший и длительный контроль целевых уровней в крови ПТГ и фосфора, назначение же синтетических аналогов D-гормона и карбоната кальция практически исключает развитие гипокальциемии. Удовлетворительный ответ на терапию цинакалцетом при незначительных нежелательных явлениях ожидаем при легком и среднетяжелом течении вторичного ГПТ. Прогнозирование и достижение хорошего результата при тяжелых нарушениях костного и кальций-фосфорного метаболизма представляет определенные трудности. Таким пациентам требуется длительное титрование дозы препарата с подбором поддерживающей дозировки и постоянная коррекция нежелательных явлений.
К отдельной категории пациентов, демонстрирующих высокую эффективность цинакалцета, относятся пациенты с персистирующим и рецидивирующим ГПТ, у которых выполнение повторной паратиреоидэктомии может оказаться невозможным. Наконец, цинакалцет обеспечивает длительное эффективное лечение третичного ГПТ у реципиентов с удовлетворительно функционирующим почечным трансплантатом, что позволяет избежать хирургического вмешательства.
Заключение
Профилактика развития и лечение вторичного ГПТ – непростая задача для специалистов, занимающихся лечением пациентов с ХПН. Несмотря на отработанную стратегию лечения ГПТ – консервативные способы коррекции нарушений кальций-фосфорного обмена и костного метаболизма и оперативное удаление гиперплазированных околощитовидных желез – эта проблема не теряет актуальности. Исследования последних лет, разработка международных рекомендаций по ведению пациентов с расстройствами кальций-фосфорного и костного обмена (KDOQI/KDIGO), а также связь таких нарушений с высокой сердечно-сосудистой смертностью в популяции страдающих хронической болезнью почек служат тому доказательством [1, 8]. Подтверждением значимости данной проблемы в РФ являются и результаты проведенного анализа частоты и тяжести нарушений кальций-фосфорного обмена и ГПТ в нескольких диализных центрах Подмосковья.
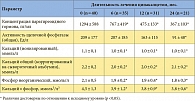
Известно, что у диализных больных функция околощитовидных желез напрямую и косвенно связана с сывороточной концентрацией фосфора, в свою очередь, гиперфосфатемия – достаточно распространенное нарушение. Как показывают наши данные, ее частота достигает 31–60% по критериям KDOQI и 48–82% по критериям KDIGO. При этом отсутствие на данном этапе в России широкого выбора фосфат-связывающих препаратов существенно ограничивает применение этой составляющей комплексной терапии ГПТ. Гиперфосфатемия также лимитирует использование неселективных и селективных препаратов D-гормона при их удовлетворительном антигиперпаратиреоидном эффекте. Опыт показывает, что на фоне лечения активными формами витамина D гиперкальциемия развивается редко, а существенно чаще – гиперфосфатемия (табл. 6).
В условиях часто сопутствующей ГПТ гиперфосфатемии предпочтительнее назначение цинакалцета (табл. 6). Благодаря своему уникальному механизму действия и высокой эффективности при лечении вторичного, третичного, персистирующего и рецидивирующего ГПТ цинакалцет займет ведущее место в схемах лечения данного заболевания. Коррекция гипокальциемии – исходной или возникающей в ходе лечения цинакалцетом – не представляет сложности. Она может быть достигнута назначением или увеличением дозы карбоната кальция, препаратов D-гормона (неселективных и селективных), а также изменением концентрации кальция в диализирующем растворе.
Основными принципами современной медикаментозной терапии ГПТ являются, во-первых, индивидуализация подхода к выбору алгоритма лечения и, во-вторых, использование комбинированной терапии с включением лекарственных препаратов с различным механизмом действия и профилем нежелательных явлений. При планировании схемы лечения ГПТ у конкретного больного следует учитывать следующее: качество и адекватность диализа, уровень в крови маркеров костного метаболизма и кальций-фосфорного обмена, эффективность и стоимость лекарственных препаратов и др. Несмотря на выраженный антигиперпаратиреоидный эффект обоих классов лекарственных средств (активные метаболиты витамина D и кальцимиметики), применение их представителей в виде монотерапии в реальной практике будет все-таки ограниченным (табл. 7).
Накопленная к настоящему времени собственная клиническая практика лечения ГПТ у диализных больных и реципиентов почечного трансплантата позволяет прогнозировать более высокую потребность в цинакалцете. Тем не менее современный алгоритм лечения ГПТ в диализной популяции в соответствии с целевыми показателями KDOQI/KDIGO диктует использование комбинации препаратов с различным механизмом действия. Проведение комбинированной терапии оптимально и с точки зрения клинической, и с точки зрения экономической эффективности, потому что она обеспечит:
- усиление антигиперпаратиреоидного эффекта за счет различного лечебного действия препаратов;
- нивелирование нежелательных явлений каждого из препаратов;
- достижение максимального соотношения «эффективность/стоимость».
Последовательность назначения комбинации препаратов может быть разной в зависимости от тяжести ГПТ и расстройства кальций-фосфорного обмена. В отсутствие гиперфосфатемии лечение может начинаться с неселективных или селективных аналогов D-гормона, а при развитии гиперфосфатемии и/или гиперкальциемии дополняться цинакалцетом. Или, наоборот, при исходной не поддающейся коррекции гиперфосфатемии лечение начинают с цинакалцета; в случае развития стойкой гипокальциемии при условии достижения целевого значения фосфора назначаются активные формы витамина D (неселективные или селективные).
Хочется надеяться, что взвешенный подход к выбору лекарственных средств и акцент на комбинации препаратов с различным механизмом действия позволят удовлетворительно контролировать состояние кальций-фосфорного обмена и костного метаболизма, предупреждать прогрессирование и развитие тяжелого ГПТ на всех этапах заместительной почечной терапии и тем самым снизить потребность в хирургическом лечении данного заболевания.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.