Современный взгляд на роль селена в физиологии и патологии щитовидной железы
- Аннотация
- Статья
- Ссылки
- English


Введение
Микроэлементы – химические вещества, находящиеся в организме в очень малых количествах, в частности, их содержание не превышает 0,005% массы тела, концентрация в тканях составляет не более 0,000001%. Концентрация микроэлементов строго сбалансирована и поддерживается гомеостазом. Баланс микроэлементов обеспечивает реализацию жизненно важных функций организма.
Микроэлементы участвуют во всех биохимических процессах (окислительно-восстановительных реакциях, свободнорадикальном окислении, дифференцировке, росте тканей и т.д.). Они также необходимы для биосинтеза некоторых гормонов, витаминов и других биологически активных веществ, участвуют в их метаболизме, влияют на активность ферментов (как часть каталитических центров ряда ферментов или конкурентный ингибитор ферментов) и белков-переносчиков [1–3].
В особую группу выделяют незаменимые (эссенциальные) микроэлементы (железо, йод, медь, селен, марганец, цинк, кобальт, молибден, хром, фтор). Их экзогенное поступление необходимо для нормальной жизнедеятельности организма [4–6].
Длительный дефицит или избыток микроэлементов может приводить к развитию эндемических заболеваний, среди которых наиболее изучены йододефицитные – самая распространенная патология щитовидной железы (ЩЖ). К йододефицитным заболеваниям, согласно определению Всемирной организации здравоохранения, относятся все патологические состояния, которые развиваются в популяции в результате йодного дефицита и могут быть предотвращены при нормализации потребления йода [7–9]. Физиологическая доза йода составляет 150–200 мкг/сут, безопасная – до 1000 мкг/сут. Потребность в йоде зависит от возраста и физиологического состояния.Так, она повышается в период беременности и лактации, а также полового созревания (табл. 1).
Йод оказывает непосредственное влияние на функционирование ЩЖ. Без этого микроэлемента невозможен биосинтез тиреоидных гормонов: тироксина (Т4) и трийодтиронина (Т3), участвующих в регуляции метаболических процессов. Тиреоидные гормоны также важны для нормального развития центральной нервной системы в онтогенезе и раннем постнатальном периоде [8, 10]. Они участвуют в критических процессах репликации клеток, необходимых для роста мозга, обеспечивают дифференцировку нервных клеток, рост аксонов, дендритов, миелинизацию и синаптогенез в развивающемся мозге.
Дефицит йода неблагоприятно отражается на репродуктивном здоровье женщины. Он ассоциируется с риском развития бесплодия, невынашивания беременности и мертворождения [1–13].
Необходимо отметить, что в отличие от йододефицитных заболеваний эндемия зоба характеризуется смешанным генезом, обусловленным разнообразием и сложным взаимодействием внешних факторов [14–17].
На метаболизм йода оказывают влияние многие микроэлементы, в первую очередь селен. Это основной молекулярный синергист йода [18–20].
Селен участвует в окислительно-восстановительных реакциях, реакциях дыхательной цепи, пентозофосфатном цикле, цикле лимонной кислоты и перекисном окислении липидов, регуляции клеточного роста и апоптоза, секреции и метаболизме тиреоидных гормонов, иммунных процессах [3, 4, 21–23].
Как и йод, селен необходим для нормального функционирования ЩЖ и поддержания тиреоидного метаболизма [10, 18, 24]. В настоящее время обсуждается роль селена в метаболических процессах, подчеркивается целесообразность нормализации его уровня при различных заболеваниях [14, 20, 21, 25–27].
Содержание селена в организме человека составляет 10–20 мг [6], при этом около 80% микроэлемента присутствует в виде селеноцистеина. В физиологических условиях селен в селеноцистеине почти полностью ионизирован и, следовательно, является чрезвычайно эффективным биологическим катализатором [1, 14, 18].
Установлено, что спектр биологической активности селена преимущественно связан с селенозависимыми протеинами, к которым относятся оксидоредуктазы (дейодиназы, три изоформы), глутатионпероксидазы (семь изоформ), тиоредоксин редуктазы (три изоформы), селенопротеины P, W, T, M [10, 14, 28, 29].
Селен является частью системы «глутатионпероксидазы – тиоредоксин редуктазы» (GPx/TrxR) [6, 7, 30]. Система GPx/TrxR участвует в антиоксидантной защите организма, регуляции таких процессов, как клеточная пролиферация, дифференцировка, транскрипция генов, репарация ДНК и апоптоз [26, 27].
В ЩЖ экспрессированы несколько глутатионпероксидаз (GPx1, GPx3 и GPx4), участвующих в метаболизме тиреоидных гормонов и обеспечивающих защиту клеток от повреждающего действия перекиси водорода (H₂O₂) и свободных радикалов [19, 31]. Каждая глутатионпероксидаза способна восстанавливать потенциально опасные реактивные формы кислорода (например, H₂O₂ и гидроперекиси липидов) до безвредных соединений (воды и спирта), что препятствует образованию новых свободных радикалов.
Глутатионпероксидаза – это селензависимый фермент, поэтому ее активность напрямую зависит от содержания селена в крови [10, 18, 32]. Дефицит селена приводит к снижению ее активности, а введение селена – к повышению таковой. При глубоком дефиците селена синтеза указанных белков не происходит [6, 31].
Тиоредоксин редуктаза также играет важную роль в антиоксидантных процессах. Кроме того, она участвует в регулировании некоторых факторов транскрипции (NF-kВ, Ref-1, P53) и экспрессии некоторых генов [26, 33, 34].
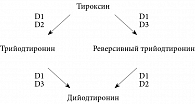
Семейство селеносодержащих оксидоредуктаз представлено тремя типами йодтиронин дейодиназ (D1, D2, D3) (рис. 1) [19]. Следует отметить, что дейодиназы отличает тканевая и органная специфичность (табл. 2) [24, 29]. Так, D1 в основном экспрессирована в печени, почках, ЩЖ и гипофизе, D2 – в ЩЖ, сердце, центральной нервной системе, гипофизе, скелетной мускулатуре, бурой жировой ткани и плаценте, D3 – в матке (во время беременности), плаценте, а также печени, головном мозге и коже эмбриона [10, 31, 33]. В условиях дефицита селена из селенозависимых белков именно дейодиназы приоритетно обеспечиваются селеном [29, 32]. При этом экспрессия D1 в ЩЖ остается прежней или незначительно повышается, экспрессия D1 и D3 поддерживается на прежнем уровне в головном мозге и плаценте, несмотря на то что в других органах и тканях экспрессия D1 снижается [19].
Экспериментальные модели с использованием трансгенных мышей, лишенных возможности экспрессировать тот или иной тип дейодиназ, подтвердили ключевую роль ферментов в физиологии тиреоидных гормонов. В частности, у мышей, лишенных способности экспрессировать D1, выявлялись аномальные концентрации тиреоидных гормонов и их метаболитов. Это свидетельствовало об участии фермента в регулировании запасов йода в организме. У D2-редуцированных мышей отмечались нарушения слуха, термогенеза и развития мозга, у D3-редуцированных мышей – снижение жизнеспособности и фертильности, задержка роста, уменьшение уровня Т3 и повышение – Т4 [10].
Основной внеклеточный источник селена – селенопротеин P (до 6–7 мкг селена/дл плазмы). Его роль заключается в транспортировке селена в разные ткани, главным образом в ткани головного мозга [22, 26]. Селенопротеин Р обнаруживается не только в плазме крови, но и в эндотелии сосудов. Считается, что его недостаток может быть причиной одного из субтипов шизофрении. Селенопротеин P также выступает в качестве антиоксиданта, защищая эндотелиальные клетки от повреждений свободными радикалами (пероксинитритом и др.). Селенопротеин W необходим для нормального метаболизма мышц. Функции других селенопротеинов менее изучены [1, 3].
Согласно рекомендациям Всемирной организации здравоохранения, норма суточного потребления селена составляет 50–200 мкг, однако оптимальной для поддержания стабильной активности селеноэнзимов является доза 50–70 мкг (70 мкг для взрослых мужчин и 55 мкг для взрослых женщин) [2, 6, 32, 35]. Селен поступает в организм преимущественно с пищей. Микроэлемент содержится в продуктах растительного и животного происхождения (сливочном масле, яйцах, мясных продуктах, рыбе, моллюсках, капусте, шпинате, чесноке, ростках пшеницы, бразильских орехах, семечках подсолнуха и коричневом рисе). Несмотря на небольшую суточную потребность, обычный пищевой рацион не обеспечивает достаточного поступления селена в организм, к тому же этот микроэлемент может плохо усваиваться [1, 3]. Поэтому рекомендуется принимать препараты селена дополнительно [1, 24, 32, 36].
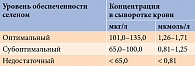
В ходе ряда исследований были установлены референсные значения концентрации селена в сыворотке крови (табл. 3) [10]. Считается, что оптимальная обеспеченность организма селеном достигается при его концентрации в сыворотке крови от 101 до 135 мкг/л (1,26–1,71 мкмоль/л). При уровне менее 65 мкг/л (< 0,81 мкмоль/л) могут развиваться различные нарушения.
Дефицит селена наблюдается гораздо чаще, чем принято считать [1, 6, 18, 32]. В настоящее время его испытывают около 80% населения России. Установлено, что средний россиянин в сутки потребляет с пищей всего 25–30 мкг селена. При оценке уровня обеспеченности селеном у 87% жителей Москвы и Московской области его концентрация в сыворотке крови находилась в субоптимальном диапазоне – 96–100 мкг/л [37].
Глубокий дефицит селена встречается очень редко. Умеренный – часто отмечается у беременных. Во время беременности уменьшаются концентрация селена и активность глутатионпероксидазы (концентрация селена в первом триместре – 65 мкг/л, в третьем – 50 мкг/л). Повышенная потребность в селене во время беременности обусловлена необходимостью максимально повысить активность глутатионпероксидазы в плазме, а также насытить селенопротеинами ткани плода.
Установлено, что дефицит селена у женщин может приводить к бесплодию, невынашиванию беременности, синдрому задержки внутриутробного развития плода и преэклампсии [3, 11].
Роль селена и йода в метаболизме тиреоидных гормонов
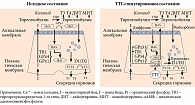
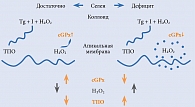
Йод поступает в ЩЖ из крови в форме йодида. Для биосинтеза тиреоидных гормонов необходимо окисление йодида до его активной формы с последующим йодированием тирозильных остатков тиреоглобулина. Окисление йодида на апикальной части тиреоцитов в просвете фолликула протекает очень быстро и катализируется тиреопероксидазой (ТПО). H₂O₂ выступает в качестве окисляющего агента, активизирует ТПО и таким образом запускает процесс йодирования тиреоглобулина [10, 14]. Последний контролируется глутатионпероксидазой – под действием этого энзима происходит восстановление H₂O₂ до H₂O. Образовавшаяся на поверхности тиреоцитов H₂O₂ используется в реакциях йодирования, а внутриклеточная H₂O₂ разрушается антиоксидантными ферментами, такими как глутатионпероксидаза, тиоредоксин и каталаза (рис. 2) [18, 22]. Предполагают, что тиреотропный гормон (ТТГ) стимулирует йодирование тиреоглобулина именно за счет увеличения продукции H₂O₂.
Образование H₂O₂, необходимой для биосинтеза тиреоидных гормонов и в то же время потенциально опасной для тиреоцитов, регулируется ТТГ через сложную систему вторичных мессенджеров (фосфолипазный каскад) и скорее всего является одним из механизмов ограничения синтеза гормонов ЩЖ при достаточном количестве йода [14, 19].
Из селенозависимых белков в ЩЖ человека наиболее активно экспрессируется экстрацеллюлярная, или плазматическая, глутатионпероксидаза (GPx3), которая и определяет повышенное содержание селена в этом органе [10]. В отсутствие ТТГ секреция GPx3 тиреоцитами приводит к сокращению количества доступной для реакций йодирования H₂O₂. И наоборот, в присутствии ТТГ снижается активность GPx3, как следствие, увеличивается количество доступной H₂O₂. В то же время внутри тиреоцитов растет концентрация GPx3, таким образом усиливается защита от окислительного стресса, индуцированного синтезом тиреоидных гормонов (см. рис. 2) [23, 26].
При дефиците селена снижается активность глутатионпероксидазы, вследствие чего накапливается избыточное количество H₂O₂ и увеличивается активность ТПО [23]. Во-первых, это подтверждает, что система глутатионпероксидазы занимает центральное место в процессе йодирования, во-вторых, что интратиреоидное содержание селена определяет ее активность.
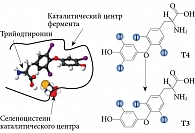
Важнейший путь метаболизма тиреоидных гормонов – последовательное отщепление атомов йода (дейодирование) осуществляется при участии специфических ферментов – селенодейодиназ (D1, D2 и D3). Дейодиназы имеют особую биологическую значимость в последовательной трансформации молекулы Т4 – активации (D1 и D2) и инактивации (D3) с образованием активного и реверсивного Т3. Считается, что в норме около 80–90% активного Т3 образуется за счет дейодирования по наружному кольцу Т4 дейодиназами (D1 и D2). Инактивация тиреоидных гормонов осуществляется путем дейодирования их внутреннего кольца с помощью D3 [22, 28].
В активном центре дейодиназ находится селеноцистеин (рис. 3). Некоторые авторы считают, что селен, входящий в состав селеноцистеина, является акцептором йода при дейодировании [19, 24]. Интересно, что замена селеноцистеина в молекуле D1 на цистеин приводит к значительному снижению активности фермента – более чем в 100 раз [26]. Несмотря на основные механизмы регуляции синтеза селенодейодиназ (ТТГ, тиреоидные гормоны, циклическая аденозинмонофосфатаза), уровень селена прямо влияет на их активность и косвенно – на метаболические процессы через синтез активного Т3 [22, 27, 32].
Таким образом, селен необходим для проявления каталитической активности дейодиназ. Его содержание в крови оказывает прямое регулирующее воздействие на экспрессию этих ферментов. Однако механизм такого воздействия до конца не ясен [28].
Дефицит селена и функциональное состояние щитовидной железы
Связь между обеспеченностью организма селеном и функциональным состоянием ЩЖ изучалась во многих работах [5, 18, 25]. Исследование биохимических ассоциаций между йодом и селеном в процессе метаболизма тиреоидных гормонов показало, что дефицит селена может усиливать действие йодного дефицита [5, 10, 13, 14, 19, 38].
Недостаточный уровень селена ассоциируется со снижением синтеза ферментов, принимающих участие в синтезе и метаболизме тиреоидных гормонов. При этом добавление йода не компенсирует указанный дефект [11, 25].
Селензависимые ферменты связаны с функционированием иммунной системы, поэтому снижение их активности может отрицательно повлиять на локальные воспалительные реакции в ЩЖ. Негативное влияние дефицита селена на состояние ЩЖ подтверждено в ряде экспериментальных работ [10, 15, 28, 39].
Дефицит йода приводит к повышению уровня ТТГ. Длительная стимуляция ТТГ йодирования тиреоглобулина неизбежно приводит к повышению продукции H₂O₂ и токсическому влиянию последней на тиреоидный эпителий. Из-за снижения активности селенопротеинов, в частности глутатионпероксидазы, антиоксидантная защита тиреоидных клеток ослабевает и избыток H₂O₂ накапливается в тиреоцитах [14, 30, 32]. Цитотоксическое воздействие H₂O₂ на ткань ЩЖ усиливается (рис. 4). В очаге некроза, возникшем вследствие избытка H₂O₂, макрофаги усиленно продуцируют трансформирующий ростовой фактор бета. Такие сдвиги способствуют пролиферации фибробластов на фоне снижения пролиферации тиреоцитов, что способствует развитию фиброза и препятствует восстановлению тиреоидной ткани [39]. При этом последние два процесса, как показано в эксперименте на крысах, в большей степени обусловлены дефицитом селена [15]. У животных, имеющих дефицит селена, выявлено снижение конверсии Т4 в Т3, которое ассоциировалось с развитием гипотиреоза [26, 34].
Эксперименты на животных моделях показали, что дефицит селена обусловливает снижение активности внутриклеточной глутатионпероксидазы и таким образом способствует цитоплазматическому йодированию белков при наличии H₂O₂, тогда как при достаточном количестве этого микроэлемента йодирование ограничено только апикальным полюсом тиреоцитов. Аномальное йодирование внутриклеточных белков может приводить к апоптозу клеток или формированию необычных эпитопов, распознаваемых иммунной системой как чужеродные [10, 26, 32].
В культурах человеческих фолликулов ЩЖ, в которых индуцировали апоптоз высокими дозами H₂O₂, йода или трансформирующего ростового фактора бета, низкие дозы селена способствовали повышению активности глутатионпероксидазы, в результате снижался апоптоз тиреоцитов [14, 32].
Результаты лабораторных исследований были подтверждены результатами клинических исследований. Q. Wu и соавт. доказали, что дефицит селена коррелирует с повышенным риском заболеваний ЩЖ [16]. В масштабном исследовании оценивалась распространенность тиреоидной патологии (гипотиреоз, аутоиммунный тиреоидит, зоб) в двух провинциях Китая, различающихся по уровню содержания селена в почве и растениях. В зависимости от содержания селена в крови участники были рандомизированы на две группы: с адекватным (n = 3038) и низким (n = 3114) селеновым статусом (медиана концентрации селена в группах различалась почти вдвое – 103,6 против 57,4 мкг/л, p = 0,001). Распространенность патологии ЩЖ была достоверно ниже в группе с адекватным селеновым статусом – 18 против 30,5% в группе с низким селеновым статусом (р < 0,001). Авторы подчеркнули, что восполнение дефицита селена способно снизить риск развития заболеваний ЩЖ у лиц с низким селеновым статусом, обусловленным местом проживания.
H. Derumeaux и соавт. отметили, что потребление селена снижало риск развития зоба. Было сделано предположение, что селен может оказывать протективное действие в отношении аутоиммунных заболеваний ЩЖ [40].
При проведении профилактики и терапии йододефицитных заболеваний следует учитывать взаимодействие йода и селена в синтезе и метаболизме тиреоидных гормонов [5, 29, 19]. Исследования, анализирующие долгосрочные результаты профилактики йододефицита с помощью применения йодированной соли без восполнения селенодефицита, показали, что последний может провоцировать рост титра антитиреоидных антител (АТ-ТПО, АТ-ТГ) и, как следствие, развитие аутоиммунных процессов [41–43]. Селенодефицит усиливает цитотоксическое воздействие на ткань ЩЖ H₂O₂ как побочного продукта синтеза тиреоидных гормонов. Это может способствовать увеличению титра антитиреоидных антител и в конечном счете развитию аутоиммунных тиреопатий [18, 32].
В других работах наблюдалась тенденция к уменьшению риска развития гипотиреоза у беременных с высокой концентрацией АТ-ТПО в крови (группа риска преждевременного прерывания беременности) на фоне приема селена [12, 13]. Механизмы влияния селена на АТ-ТПО объясняют его способностью модифицировать воспаление и иммунные реакции, подавлять выделение цитокинов, а также повышать активность селенозависимых белков, уменьшая выраженность локальных воспалительных реакций [14, 23, 32].
Дополнительный прием селена в дозе, соответствующей суточной потребности, на протяжении 6–12 месяцев приводил к достоверному снижению титра АТ-ТПО, способствовал уменьшению выраженности аутоиммунного процесса и улучшению эхоструктуры ЩЖ (по данным ультразвукового исследования) [13, 23, 25, 40, 42].
Метаанализ данных 16 контролируемых исследований, проведенный J. Wichman и соавт., показал, что применение селена снижало титр АТ-ТПО, АТ-ТГ у пациентов с аутоиммунным тиреоидитом независимо от того, применяли они L-тироксин или нет [43]. Клиническое значение данного феномена еще предстоит уточнить. Однако уже сейчас ясно, что селенодефицит может негативно отразиться на функциональном состоянии ЩЖ и способствовать нарушению иммунологического контроля [18, 32].
До конца не установлена связь между дефицитом селена и развитием узлового зоба. На данный момент существует несколько гипотез о механизмах развития узлов у пациентов с селенодефицитом, основная – нарушение метаболизма глутатионпероксидазы [14, 18].
Многие специалисты рассматривают селен как необходимый компонент успешного лечения и профилактики заболеваний ЩЖ, в том числе связанных с дефицитом йода [14, 18, 25, 36, 42]. Профилактическое назначение препаратов селена также целесообразно во время беременности (безусловно, в комбинации с препаратами йода) [10, 11, 38], поскольку примерно у 10% беременных определяется повышенная концентрация АТ-ТПО и у 5% развивается послеродовый тиреоидит [10].
Сказанное выше подтверждает необходимость применения препаратов, в состав которых входят йод и селен в дозах, не превышающих суточную физиологическую потребность.
Заключение
Селен влияет на физиологические процессы, происходящие в ЩЖ. Часто сопутствующий йододефицитным состояниям дефицит селена может утяжелять функциональные и структурные изменения в ЩЖ. Опасность ситуации усугубляется недостаточной информированностью медицинского сообщества о реальной распространенности данного состояния.
Роль селена в профилактике и его влияние на течение и прогноз заболеваний ЩЖ до конца не изучены. Поэтому требуется дальнейшее исследование проблемы.
Ye.V. Biryukova
FSBEI HE ‘A.I. Yevdokimov Moscow State University of Medicine and Dentistry’
Contact person: Yelena Valeryevna Biryukova, lena@obsudim.ru
Functions of selenium as an essential trace element are discussed in human. Selenium exhibits anti-oxidant and anti-inflammatory properties, takes place in many metabolic reactions. Biological activity of selenium is mediated via selenium-dependent proteins (deiodinases, glutathione peroxidases, thioredoxin reductases). The data regarding a role of selenium-containing compounds in metabolic processes and developing thyroid pathology are outlined in the paper. A link between selenium and iodine in metabolism of thyroid hormones was found during clinical and epidemiological studies.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.