Влияние вариабельности гликемии на течение сахарного диабета 2 типа и современные возможности ее коррекции
- Аннотация
- Статья
- Ссылки

В настоящее время хорошо изучены механизмы отрицательного воздействия выраженной вариабельности гликемии на возникновение и прогрессирование осложнений СД. Установлено, что наряду с избыточным гликозилированием вследствие хронической гипергликемии осложнения СД 2 типа развиваются в результате окислительного стресса, который активируется под влиянием гипергликемии, но в большей степени зависит от колебаний уровня глюкозы крови.
Окислительный (оксидативный) стресс – это избыточная продукция свободных радикалов в результате увеличения концентрации субстратов окисления, а именно глюкозы и липидов, сочетающаяся со снижением активности антиоксидантных систем. Активные формы кислорода, которые образуются вследствие запуска оксидативного стресса, вызывают нарушение функции главного антиатерогенного вещества эндотелия сосудов – оксида азота, тем самым приводят к эндотелиальной дисфункции, а следовательно, к развитию и прогрессированию сосудистых осложнений СД. Кроме того, окислительный стресс запускает механизмы поражения бета-клеток, чем еще сильнее усугубляет течение заболевания.
Становится ясно: для того чтобы получить подробную картину состояния углеводного обмена пациента, помимо HbA1c необходимо учитывать выраженность колебаний гликемии в течение дня. В этой связи патогенез развития сосудистых осложнений СД на сегодняшний день трактуется как совокупность и результат действия двух патологических процессов – избыточного гликозилирования и активации окислительного стресса. Оба эти процесса в разной степени активируются гипергликемией и выраженными колебаниями уровня глюкозы крови [1].
Следует также отметить, что постпрандиальная гипергликемия и выраженная вариабельность гликемии являются серьезными повреждающими факторами, приводящими к истощению и снижению массы бета-клеток, в то время как постоянно повышенный уровень гликемии может и не приводить к этим последствиям. Таким образом, целью терапии пациента с СД является создание такого гликемического профиля, при котором показатели гликемии будут находиться в диапазоне допустимых минимальных и максимальных значений на протяжении суток.
Отследить эти показатели позволяет существующий в настоящее время метод суточного мониторирования уровня глюкозы крови Continuous glucose control monitoring system (CGMS). Чаще всего у пациентов с СД 2 типа колебания гликемии связаны с приемом пищи. В исследованиях продемонстрировано, что образование продуктов оксидативного стресса увеличивается после еды и находится в прямой зависимости от постпрандиального уровня гликемии [3].
Патологической причиной гипогликемии при СД 2 типа является утрата гормонального ответа на низкий уровень глюкозы крови со стороны альфа- и бета-клеток. В физиологических условиях низкая концентрация глюкозы крови ведет к уменьшению выработки инсулина бета-клетками и стимуляции секреции глюкагона альфа-клетками. Из-за нарушения физиологического взаимодействия между инсулином и глюкагоном при гипогликемии отсутствует стимуляция секреции глюкагона, что лишает организм защиты от тяжелых гипогликемий.
Несомненно, коррекция постпрандиальных пиков гликемии и гипогликемий должна включать в первую очередь изменение режима питания, обучение пациента и информирование его о причинах, которые могут вызвать их развитие. Однако терапия пероральными сахароснижающими препаратами (ПССП) занимает центральное место в управлении СД 2 типа, и ее роль возрастает по мере прогрессирования заболевания.
Хорошо известно, что препараты, назначаемые для коррекции гликемического статуса, нередко создают дополнительные риски развития гипогликемии, тем самым увеличивая вариабельность уровня глюкозы крови и способствуя запуску патологических процессов, приводящих к развитию диабетических осложнений. На сегодняшний день гипогликемия является побочным действием препаратов сульфонилмочевины, используемых в качестве базисных препаратов при лечении пациентов с СД 2 типа в течение более 60 лет и обладающих высокой степенью эффективности и безопасности применения.
Наряду с препаратами сульфонилмочевины выраженным сахароснижающим эффектом обладают метформин и тиазолидиндионы. Препараты метформина являются основой медикаментозной коррекции углеводного обмена, высокоэффективны и безопасны в применении. Ограничения в отношении приема метформина чаще всего связаны с развитием побочных реакций со стороны желудочно-кишечного тракта; при этом общая непереносимость препарата достигает 10–20%. При назначении метформина также следует учитывать довольно большое число противопоказаний, например, нарушения функции почек и печени, тяжелая гипоксия, а именно сердечная недостаточность III–IV класса, дыхательная недостаточность, алкогольная болезнь [5, 6]. Применение тиазолидиндионов в настоящее время ограничено в связи с их кардиотоксичностью, а препарат росиглитазон официально запрещен к использованию во многих странах.
В настоящий момент в диабетологии преобладают следующие тенденции: многофакторный и индивидуальный подход к лечению пациента, сохранение возможности применения традиционных ПССП, использование препаратов, не так давно появившихся в арсенале клиницистов. Современный взгляд на патогенез диабетических осложнений и технические достижения последних лет позволяют более точно и детально изучать гликемический статус пациента и, соответственно, тщательнее подбирать препараты в каждом клиническом случае.
В этой связи заслуженный интерес вызывает относительно новая группа препаратов – ингибиторы дипептидилпептидазы-4 (ДПП-4), механизм действия которых основан на функции упомянутых выше инкретиновых гормонов. В основе действия этих препаратов лежит реализация физиологических сахароснижающих механизмов ГПП-1 путем ингибирования соответствующего фермента, который в течение двух минут расщепляет ГПП-1, тем самым препятствуя его действию. Рецепторы к ГПП-1 были найдены в островках поджелудочной железы, желудке, периферической нервной системе и других органах [7, 8].
Воздействие ГПП-1 на бета-клетки поджелудочной железы состоит в потенцировании секреции инсулина. При этом важной особенностью является глюкозозависимость действия ГПП-1: при достижении уровня сахара крови около 4,5 ммоль/л инсулинстимулирующий эффект не реализуется [8, 9, 10]. Рецепторы к ГПП-1 обнаружены и в альфа-клетках поджелудочной железы, путем прямого действия на которые реализуется снижение секреции глюкагона, что, в свою очередь, уменьшает продукцию глюкозы печенью. Важно, что и этот эффект глюкозозависим. Таким образом, действие ГПП-1 характеризуется двумя факторами защиты от гипогликемии: глюкозозависимой стимуляцией секреции инсулина и глюкозозависимым подавлением секреции глюкагона [6, 9].
Существует гипотеза, согласно которой снижение постпрандиальной гликемии достигается также за счет торможения опорожнения желудка и замедления всасывания глюкозы [11]. Наличие рецепторов к ГПП-1 в подвздошной кишке приводит к замедлению опорожнения желудка вследствие активации афферентных волокон блуждающего нерва и пролонгированию чувства сытости, что способствует поддержанию исходной массы тела. Таким образом, инактивация фермента ДПП-4 дает возможность реализовать свойства ГПП-1, что представляет собой путь восстановления нарушенной продукции инсулина и коррекции повышенного уровня глюкагона – ключевых расстройств, которые лежат в основе глюкозотоксичности и вариабельности гликемии.
Приведенные выше свойства ингибиторов ДПП-4 дают основания для включения этого класса препаратов в официальные алгоритмы специализированной медицинской помощи больным с СД 2 типа и, соответственно, активного использования в клинической практике. Согласно Консенсусу совета экспертов Российской ассоциации эндокринологов (РАЭ) по инициации и интенсификации сахароснижающей терапии сахарного диабета 2 типа (2011), применение ингибиторов ДПП-4 рекомендовано как на старте сахароснижающей терапии, так и на этапе интенсификации лечения [12].
Одним из препаратов, относящихся к классу ингибиторов ДПП-4, является вилдаглиптин. Возможности применения ингибиторов ДПП-4 находятся в сфере научных интересов коллектива кафедры эндокринологии и диабетологии РМАПО, в связи с чем на кафедре проводилось наблюдательное исследование влияния вилдаглиптина на гликемический профиль пациентов с СД 2 типа.
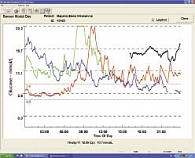
Результаты исследования иллюстрирует клинический пример. Пациентка К., 53 года. Сахарный диабет диагностирован 8 лет назад. На момент обращения на кафедру эндокринологии и диабетологии РМАПО получала метформин 2000 мг/сут и гликлазид МВ 120 мг/сут. Уровень HbA1c составил 11,0%. Уровень гликемии натощак – 9,0 ммоль/л. Индекс массы тела (ИМТ) на момент начала наблюдения равнялся 30 кг/м2. По результатам CGMS в течение трех суток зафиксирован минимальный уровень сахара крови 4,5 ммоль/л, максимальный – 22,0 ммоль/л, амплитуда колебаний составила 17,5 ммоль/л. Время пребывания в состоянии гипергликемии составило 80% от всего времени исследования, нормогликемии – 20%.
Коррекция сахароснижающей терапии включала добавление к существующей схеме вилдаглиптина 50 мг 2 раза в день. Проводилась модификация образа жизни, режима питания и двигательной активности. Результаты контрольного обследования через 12 недель свидетельствовали об улучшении состояния углеводного обмена: показатель гликемии натощак составил 7,2 ммоль/л, HbA1c – 8,7%. ИМТ оставался на прежнем уровне – 30 кг/м2. По результатам CGMS был отмечен минимальный уровень сахара крови 4,5 ммоль/л, максимальный – 12,5 ммоль/л, амплитуда колебаний – 8,0 ммоль/л. Время пребывания в гипергликемии составило 42%, в нормогликемии – 58%, эпизодов гипогликемии не зафиксировано.
Графики суточного мониторирования уровня глюкозы крови до исследования и через 12 недель представлены на рисунке 1. Учитывая положительные результаты терапии с добавлением вилдаглиптина, было принято решение ее продолжить в течение еще одного 12-недельного периода. По результатам лабораторного исследования, проведенного в конце 2-го этапа лечения, отмечено снижение уровня HbA1c до 8,2%, гликемии натощак до 6,6 ммоль/л, гликемии через 2 часа после основных приемов пищи до 9,6 ммоль/л. Субъективно эпизодов гипогликемии пациентка не ощущала. ИМТ уменьшился до 29,0 кг/м2.
