количество статей
7261
Загрузка...
Пожалуйста, авторизуйтесь:
Исследования
Вопросы и перспективы антибактериальной терапии хронической синегнойной инфекции у пациентов с муковисцидозом
"ЭФФЕКТИВНАЯ ФАРМАКОТЕРАПИЯ. Эпидемиология и инфекции" № 1
- Аннотация
- Статья
- Ссылки
В статье приводятся данные по эффективности и безопасности применения нового режима комбинированной антибактериальной терапии с использованием раствора тобрамицина для ингаляций 300 мг / 5 мл (ТОБИ), применявшегося 15-дневным курсом у пациентов, страдающих муковисцидозом, в момент обострения бронхолегочного процесса, поступивших в отделение медицинской генетики РДКБ.
Добавление к системным антибиотикам раствора тобрамицина для ингаляций позволило добиться увеличения клинической и бактериологической эффективности терапии бронхолегочного процесса у 23 пациентов.
Добавление к системным антибиотикам раствора тобрамицина для ингаляций позволило добиться увеличения клинической и бактериологической эффективности терапии бронхолегочного процесса у 23 пациентов.
В статье приводятся данные по эффективности и безопасности применения нового режима комбинированной антибактериальной терапии с использованием раствора тобрамицина для ингаляций 300 мг / 5 мл (ТОБИ), применявшегося 15-дневным курсом у пациентов, страдающих муковисцидозом, в момент обострения бронхолегочного процесса, поступивших в отделение медицинской генетики РДКБ.
Добавление к системным антибиотикам раствора тобрамицина для ингаляций позволило добиться увеличения клинической и бактериологической эффективности терапии бронхолегочного процесса у 23 пациентов.
Добавление к системным антибиотикам раствора тобрамицина для ингаляций позволило добиться увеличения клинической и бактериологической эффективности терапии бронхолегочного процесса у 23 пациентов.
![Рис. 1. Микробиологический пейзаж мокроты пациентов, страдающих муковисцидозом (адаптировано по [3])](/upload/resize_cache/iblock/d11/195_350_1/d119f07b55e8d53fe117a24ed2179109.jpg)
Рис. 1. Микробиологический пейзаж мокроты пациентов, страдающих муковисцидозом (адаптировано по [3])
![Рис. 2. Зависимость между возрастом инфицирования мукоидным штаммом Р. аeruginosa и показателями 10-летней выживаемости у больных муковисцидозом (адаптировано по [4])](/upload/resize_cache/iblock/1a3/195_350_1/1a33854db33b673ea5af7ab05eaefe7b.jpg)
Рис. 2. Зависимость между возрастом инфицирования мукоидным штаммом Р. аeruginosa и показателями 10-летней выживаемости у больных муковисцидозом (адаптировано по [4])

Таблица 1. Комбинированная антимикробная терапия

Таблица 2. Функциональные показатели легких у больных с тяжелым течением муковисцидоза (n = 7)

Таблица 3. Спектр микрофлоры бронхиального секрета 23 больных муковисцидозом до начала лечения (n = 39)
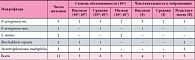
Таблица 4. Спектр микрофлоры бронхиального секрета 23 больных муковисцидозом после лечения (n = 12)
Введение
Орфанные заболевания, или «сиротские болезни», включают в свой спектр более 5000 патологий. Среди генетических орфанных болезней наиболее часто встречающимся считается муковисцидоз (МВ) – аутосомно-рецессивное заболевание с частотой возникновения от 1:2500 до 1:9000 новорожденных, характеризующееся поражением всех экзокринных желез организма. В основе болезни лежит мутация гена СFTR (трансмембранного регулятора МВ), отвечающего за секреторные процессы [1, 2]. В результате происходит сгущение секрета экзокринных желез, что приводит к поражению различных органов и систем – респираторного тракта, желудочно-кишечного тракта, поджелудочной железы, печени, половой сферы. Отделение медицинской генетики РДКБ уже много лет занимается диагностикой и лечением пациентов с МВ. Согласно литературным данным и нашему практическому опыту, больные МВ чаще здоровых детей подвержены легочной инфекции. Причиной этого является наличие в бронхах густого и вязкого секрета, который служит идеальной питательной средой для роста и размножения различных микроорганизмов. Микробиологический состав мокроты больных МВ сложен и меняется с возрастом (рис. 1) [3].
Орфанные заболевания, или «сиротские болезни», включают в свой спектр более 5000 патологий. Среди генетических орфанных болезней наиболее часто встречающимся считается муковисцидоз (МВ) – аутосомно-рецессивное заболевание с частотой возникновения от 1:2500 до 1:9000 новорожденных, характеризующееся поражением всех экзокринных желез организма. В основе болезни лежит мутация гена СFTR (трансмембранного регулятора МВ), отвечающего за секреторные процессы [1, 2]. В результате происходит сгущение секрета экзокринных желез, что приводит к поражению различных органов и систем – респираторного тракта, желудочно-кишечного тракта, поджелудочной железы, печени, половой сферы. Отделение медицинской генетики РДКБ уже много лет занимается диагностикой и лечением пациентов с МВ. Согласно литературным данным и нашему практическому опыту, больные МВ чаще здоровых детей подвержены легочной инфекции. Причиной этого является наличие в бронхах густого и вязкого секрета, который служит идеальной питательной средой для роста и размножения различных микроорганизмов. Микробиологический состав мокроты больных МВ сложен и меняется с возрастом (рис. 1) [3].
В первые годы жизни больного наиболее часто представленным микроорганизмом является Staphylococcus aureus (S. aureus), со временем степень обсемененности мокроты им снижается и начинает превалировать Pseudomonas aeruginosa (рис. 1). При этом показано, что раннее инфицирование Pseudomonas aeruginosa приводит к достоверному снижению выживаемости [4], а дыхательная недостаточность является причиной смерти 90% больных МВ [5, 6] (рис. 2). Долгое время для лечения синегнойной инфекции у пациентов с муковисцидозом применяли комбинации пероральных и внутривенных антибиотиков (АБ) с антисинегнойной активностью: цефалоспоринов III–IV поколения (цефтазидим, цефоперазон, цефепим), фторхинолонов (ципрофлоксацин), карбапенемов (имипенем/циластатин, меропенем) и аминогликозидов (гентамицин, амикацин, тобрамицин). Однако использование таких подходов к антибактериальной терапии не всегда давало возможность эффективно подавлять инфекцию и тем самым поддерживать стабильное состояние больного. По-видимому, это обусловлено тем, что пероральный или внутривенный способы введения не дают возможность создать в мокроте, где у пациента с МВ находится очаг инфекции, нужные для подавления P. aeruginosa концентрации АБ. По этой причине особый интерес представляет появление в арсенале врача тобрамицина раствора для ингаляций 300 мг / 5 мл (ТОБИ). Его применение позволяет создавать в мокроте концентрацию тобрамицина, в 25 раз превышающую минимальную подавляющую концентрацию (МПК) P. aeruginosa [6, 7].
Появившись в США впервые в 1997 г., уже в 2004 г. ТОБИ был признан Европейским консенсусом лечения муковисцидоза в качестве стандарта лечения ранней синегнойной инфекции для профилактики поражения легких при МВ как препарат с уровнем доказательности А. Основанием для этого послужили следующие факты: 1) концентрация ТОБИ в мокроте превышает порог резистентности, что дает возможность эрадикации синегнойной инфекции и предотвращения обострений, 2) удобный режим приема – 28 дней ингаляций через 28 дней перерыва – обеспечивает возможность длительного применения препарата в амбулаторных условиях, тем самым снижая количество госпитализаций и нозокомиального инфицирования, значительно улучшая качество жизни и сокращая расходы на лечение [8, 9]. В 2008 г. препарат был зарегистрирован в России. В 2009 г. мы получили возможность использовать этот препарат в своей клинической практике. В этой связи мы поставили перед собой цель оценить бактериологическую и клиническую эффективность и безопасность новой лекарственной формы тобрамицина раствора для ингаляций 300 мг / 5 мл (ТОБИ), который включили в состав комбинированной антибактериальной терапии у больных МВ с хронической синегнойной инфекцией, пролеченных в условиях стационара при стандартных сроках лечения – 15 дней.
Материалы и методы
Для адекватного анализа была выбрана группа из 23 больных МВ в стадии обострения, в возрасте от 4 до 17 лет, поступивших в отделение в течение 2009 г. (7 мальчиков и 16 девочек). Тяжесть заболевания оценивалась по показателю форсированной жизненной емкости легких (ФЖЕЛ): тяжелое течение заболевания (ФЖЕЛ < 70%) отмечалось у 7 детей, среднетяжелое (ФЖЕЛ > 70%) – у 16 пациентов. В динамике отслеживались клинические (одышка, характер кашля, состояние мокроты, количество хрипов) и функциональные (ФЖЕЛ, объем форсированного выдоха за первую секунду (ОФВ1)) показатели легких (аппарат Spiro analyzer ST-95). Проводился также краткосрочный бактериологический мониторинг – микробиологическое исследование мокроты (посев на стандартные среды) до назначения АБ и после окончания лечения (14–15-й день).
В соответствии с результатами микробиологического исследования (проводилось пациентам при поступлении в стационар) с учетом чувствительности выделенной флоры всем больным была назначена комбинированная антибактериальная терапия, состоящая из АБ системного действия и раствора тобрамицина для ингаляций (ТОБИ) (табл. 1). Цефтазидим (200–250 мг/кг/сут) и метронидазол (40 мг/кг/сут) вводились внутривенно в 2 инфузии по 30 минут каждая, а ципрофлоксацин в дозе 40 мг/кг/сут – перорально 2 раза в день. Ингаляции раствора тобрамицина 300 мг / 5 мл проводились 2 раза в день после ингаляции муколитиков (дорназа альфа 2,5 мг 1 раз утром и АЦЦ 300 мг 1 раз вечером) и постурального дренажа в течение 15 дней. Микробиологическая эффективность терапии отслеживалась по результатам микробиологического исследования мокроты на момент окончания лечения в стационаре (на 15-й день). Безопасность проводимой антибактериальной терапии отслеживалась с помощью активного мониторинга в отношении раствора тобрамицина для ингаляций. Определялась его возможная ототоксичность – звуковая, вызванная отоакустическая эмиссия на аппарате Echo screen до и после лечения.
Результаты
В результате проведенного комбинированного антибактериального лечения все 23 пациента были выписаны домой из стационара в состоянии ремиссии. Клинически определялось полное исчезновение кашля и мокроты у больных со среднетяжелым течением заболевания и значительное урежение кашля и скудное количество посветлевшей мокроты у больных с тяжелым течением. В группе пациентов с тяжелым течением оценивались показатели функции внешнего дыхания (ФВД) – ФЖЕЛ и ОФВ1 (до и после лечения), которые свидетельствуют о функциональном состоянии легких. При сравнении этих показателей до и после лечения был обнаружен прирост ФЖЕЛ на 29% и прирост ОФВ1 на 37%, что свидетельствует о значительном улучшении функции легких у этих пациентов в результате проведенной терапии (табл. 2). На следующем этапе мы оценили бактериологическую эффективность проведенной комбинированной терапии. Для этого мы сравнили результаты микробиологического исследования мокроты пациентов до и после лечения (табл. 3, 4). В группе выбранных нами пациентов до лечения преобладающей флорой была Pseudomonas aeruginosa (29 штаммов – 49%) и S. aureus (12 штаммов – 30%). Обращает на себя внимание наличие высокой исходной чувствительности штаммов Pseudomonas aeruginosa к тобрамицину (особенно ее мукоидных форм). По количеству патогенных штаммов у одного пациента группа была распределена на 3 подгруппы: у 9 пациентов (39%) обнаруживали монокультуру Pseudomonas aeruginosa; у 12 пациентов (52%) обнаруживали культуру из двух микробов – Pseudomonas aeruginosa + другой микроб; у 2 пациентов (9%) высевали культуры 3 разных микробов, включая Pseudomonas aeruginosa.
После проведенной терапии микробный пейзаж в посевах изменился: подверглось элиминации 74% штаммов Pseudomonas aeruginosa (из 19 осталось 6 штаммов), 87% штаммов S. aureus, в том числе MRSA (methicillin-resistant Staphylococcus aureus infection – метициллин-устойчивый золотистый стафилококк) (из 15 штаммов осталось 2). Кроме того, необходимо отметить, что 4 из 6 сохранившихся штаммов Pseudomonas aeruginosa обладали необходимой чувствительностью к тобрамицину и, следовательно, можно рассчитывать на их элиминацию при продолжении антибактериальной терапии с участием ингаляционного тобрамицина. Обращает на себя внимание и отсутствие увеличения резистентных штаммов Pseudomonas aeruginosa. Однако даже при появлении этих штаммов возможно преодолеть порог их резистентности и добиться контроля над инфекцией благодаря тому, что раствор тобрамицина для ингаляций 300 мг / 5 мл создает очень высокую (1237 мкг/г) концентрацию действующего вещества в мокроте [10]. Кроме флоры, указанной в таблице 4, у пациентов высевались грибы рода Candida (в 11 случаях) и Aerococcus viridans (у 8 пациентов). Поскольку эти грибы не являются этиологически значимой флорой при муковисцидозе, этот факт представляется нам косвенным показателем успешности антибактериальной терапии. При анализе распределения по пациентам оставшихся после лечения штаммов оказалось, что у 17 человек (74%) высева в мокроте обнаружено не было, монокультура высевалась у 4 пациентов (17%), дикультура – у 1 пациента (0,04%) и трикультура – у 2 пациентов (8,96%). В микробиологических анализах мокроты пациентов после лечения были также обнаружены штаммы другой грамотрицательной флоры – Stenotrophomonas maltophilia и B. cepacia complex, что, вероятно, связано с перезаселением легких другими микроорганизмами.
Степень участия ингаляционного тобрамицина в успехе антибактериальной терапии можно условно вычислить, сравнив полученные в ходе настоящего исследования данные с результатами наших предыдущих исследований эффективности применения антибактериальной терапии при лечении синегнойной инфекции системными АБ, но без раствора тобрамицина для ингаляций [11, 12, 13, 14]. Наши работы 2002–2003 гг. показывают, что антисинегнойный эффект комбинации внутривенных и пероральных АБ позволял достичь чистого высева только у 40% пациентов в конце лечения, продолжавшегося в течение 15–21 дня. Таким образом, добавочный эффект раствора тобрамицина для ингаляций 300 мг / 5 мл составляет более 30%, поскольку именно при добавлении к терапии данного препарата чистый высев был достигнут у 74% пациентов. Безопасность раствора тобрамицина для ингаляций 300 мг / 5 мл отслеживалась прежде всего с точки зрения возможной ототоксичности. Как показали выборочные исследования аудиометрии у 11 больных, никаких дополнительных изменений слуха применение ингаляционного тобрамицина не вызвало. Среди незначительных побочных реакций можно назвать першение в горле (у 2 пациентов) и легкую бронхоспастическую реакцию – у одного больного, которая послужила причиной отмены препарата.
Заключение
В процессе лечения 23 пациентов с МВ в стадии обострения был использован новый режим комбинированной антибактериальной терапии, включающий новый компонент – раствор тобрамицина для ингаляций 300 мг / 5 мл (ТОБИ). Новый режим терапии позволил выписать всех пациентов на 15-й день лечения в состоянии ремиссии. Использование нового режима терапии позволило значительно улучшить функцию легких в группе пациентов тяжелого течения с увеличением показателей ФЖЕЛ на 29% и ОФВ1 на 37%. При оценке бактериологической эффективности данного режима терапии, прежде всего против основных патогенов МВ – Pseudomonas aeruginosa (особенно его мукоидных форм) и S. aureus (в том числе MRSA), была обнаружена элиминация 74% штаммов Pseudomonas aeruginosa и 87% штаммов S. aureus, в том числе MRSA. При этом у 74% пациентов был обнаружен чистый высев в конце курса терапии, что более чем на 30% превышает результаты предыдущих лет при использовании комбинированной антибактериальной терапии с применением только системных АБ. Это доказывает высокую эффективность раствора тобрамицина для ингаляций и необходимость его введения в состав комбинированной терапии хронической легочной синегнойной инфекции даже в стационаре. Применение тобрамицина раствора для ингаляций 300 мг / 5 мл является безопасным и не сопровождается серьезными побочными эффектами.
1. Döring G., Conway S.P., Heijerman H.G. et al. Antibiotic therapy against Pseudomonas aeruginosa in cystic fibrosis: a European consensus // Eur. Respir. J. 2000. Vol. 16. № 4. P. 749–767.
2. Толстова В.Д., Каширская Н.Ю., Капранов Н.И. Массовый скрининг новорожденных на муковисцидоз в России // Фарматека. 2008. № 1. С. 38–43.
3. Cystic Fibrosis Foundation. Annual report 2007.
4. Demko C.A., Byard P.J., Davis P.B. Gender differences in cystic fibrosis: Pseudomonas aeruginosa infection // J. Clin. Epidemiol. 1995. Vol. 48. № 8. P. 1041–1049.
5. Cystic Fibrosis Foundation. Patient Registry: Annual Data report 2004.
6. Ramsey B.W., Burns J., Smith A. Safety and efficacy of tobramycin solution for inhalation in patients with cystic fibrosis: The results of two phase III placebo controlled clinical trials // Pediatr. Pulmonol. 1997. Vol. 24. № S14. P. 137–138.
7. Ramsey B.W., Pepe M.S., Quan J.M. et al. Intermittent administration of inhaled tobramycin in patients with cystic fibrosis. Cystic Fibrosis Inhaled Tobramycin Study Group // N. Engl. J. Med. 1999. Vol. 340. № 1. P. 23–30.
8. Moss R.B. Administration of aerosolized antibiotics in cystic fibrosis patients // Chest. 2001. Vol. 120. № 3. Suppl. P. 107S–113S.
9. Döring G., Hoiby N.; Consensus Study Group. Early intervention and prevention of lung disease in cystic fibrosis: a European consensus // J. Cyst. Fibros. 2004. Vol. 3. № 2. P. 67–91.
10. Geller D.E., Pitlick W.H., Nardella P.A. et al. Pharmacokinetics and bioavailability of aerosolized tobramycin in cystic fibrosis // Chest. 2002. Vol. 122. № 1. P. 219–226.
11. Семыкин С.Ю. Эффективность и безопасность применения ципрофлоксацина при лечении обострений бронхолегочного процесса у детей с муковисцидозом: Автореф. дисс. … канд. мед. наук. М., 2002.
12. Постников С.С. Сравнительная эффективность и безопасность монофторхинолонов (ципрофлоксацин, офлоксацин, перфлоксацин) в проблеме лечения и профилактики жизнеугрожающих инфекций у детей, больных муковисцидозом и апластической анемией: Автореф. дисс. … докт. мед. наук. М., 2003.
13. Семыкин С.Ю., Постников С.С., Поликарпова С.В. и др. Эффективность и безопасность цефепима при лечении обострений бронхолегочного процесса у детей, больных муковисцидозом // Антибиотики и химиотерапия. 2005. № 4. С. 18–22.
14. Семыкин С.Ю., Постников С.С., Передерко Л.В. и др. Клинико-бактериологическая эффективность и переносимость меропенема при лечении бронхолегочного процесса у детей с муковисцидозом // Детская больница. 2007. № 3. С. 29–31.
Новости на тему
Отправить статью по электронной почте
Ваш адрес электронной почты:
В статье приводятся данные по эффективности и безопасности применения нового режима комбинированной антибактериальной терапии с использованием раствора тобрамицина для ингаляций 300 мг / 5 мл (ТОБИ), применявшегося 15-дневным курсом у пациентов, страдающих муковисцидозом, в момент обострения бронхолегочного процесса, поступивших в отделение медицинской генетики РДКБ.
Добавление к системным антибиотикам раствора тобрамицина для ингаляций позволило добиться увеличения клинической и бактериологической эффективности терапии бронхолегочного процесса у 23 пациентов.
" id="sender_art_description" name = "SENDER_ART_DESCRIPTION" />
Добавление к системным антибиотикам раствора тобрамицина для ингаляций позволило добиться увеличения клинической и бактериологической эффективности терапии бронхолегочного процесса у 23 пациентов.
Адрес электронной почты получателя:
Разделите несколько адресов электронной почты запятой
Сообщение(не обязательно)
Не более 1500 символов
Анти спам:
Для предотвращения спама, пожалуйста, введите в поле слово, которое видите ниже.
Обновить код
* адреса предоставленные Вами будут использоваться только для отправки электронной почты.
