Вспомогательные репродуктивные технологии и их влияние на молочную железу
- Аннотация
- Статья
- Ссылки
- English



В настоящее время в России лечение бесплодия методами вспомогательных репродуктивных технологий (ВРТ) активно поддерживается на государственном уровне. Одним из основных является экстракорпоральное оплодотворение (ЭКО) с применением протоколов индукции суперовуляции. Однако, несмотря на признание высокой эффективности ВРТ, вопрос безопасности такого способа лечения бесплодия в отношении молочной железы остается спорным.
Возрастание заболеваемости раком молочной железы (РМЖ) может быть связано с увеличением частоты развития доброкачественной дисплазии молочной железы (ДДМЖ). Последняя диагностируется у 60–70% женщин с гинекологической патологией. Так, при диффузных формах ДДМЖ (код N60 по Международной классификации болезней (МКБ) 10-го пересмотра) рак молочной железы развивается в три – пять раз чаще, чем в отсутствие указанной патологии, а при узловых формах – в 30–40 раз [1–3]. Бесплодие также признано одним из факторов риска развития рака молочной железы.
Для некоторых пациенток единственным методом лечения трубного бесплодия (код N97.1 по МКБ-10) является выполнение программ ВРТ, а именно ЭКО.
На сегодняшний день информации о влиянии ВРТ на состояние молочной железы крайне мало – три отечественные работы [4–6] и 170 зарубежных [7–12]. Приходится констатировать, что анализ доступной литературы не дает однозначного ответа на вопрос о роли ВРТ в увеличении риска развития патологий молочной железы, в частности РМЖ. В то же время следует отметить, что отбор участников и дизайн исследований были противоречивыми, группы сравнения неравноценными, проводилась оценка только отдаленных результатов, не дифференцировалась патология молочной железы. Поэтому актуальность изучения состояния молочной железы и гормонального фона у пациенток с бесплодием после ЭКО, а также возможностей своевременной терапии и реабилитации больных по-прежнему сохраняется.
Цель исследования – оценить состояние молочной железы и гормонального статуса женщин с трубным бесплодием до и после неудачной попытки ЭКО, а также эффективность препарата Мастодинон® при лечении ДДМЖ и подготовке к индукции овуляции.
Материал и методы
С 2010 по 2016 г. в отделении репродуктивных технологий Томского областного перинатального центра обследовано 1500 пациенток с бесплодием.
Структура женского бесплодия оценивалась с помощью стандартизированного протокола обследования бесплодной пары, разработанного группой экспертов Всемирной организации здравоохранения [13].
Структура патологий молочной железы до и после проведения ВРТ ЭКО анализировалась исходя из эхоскопических характеристик молочных желез и гормонального статуса больных.
Для верификации диагноза ДДМЖ использовали BI-RADS (Breast Imaging – Reporting and Data System – Система описания и обработки данных лучевых исследований молочной железы) и клинико-рентгенологическую классификацию Н.И. Рожковой (1993) [14].
Критериями включения в исследование стали:
- возраст от 24 до 35 лет;
- наличие только одного фактора бесплодия – патологии маточных труб;
- отсутствие нарушений менструального цикла и гинекологической патологии;
- отсутствие эндокринной и соматической патологии;
- отсутствие узловых форм ДДМЖ;
- применение единого протокола стимуляции овуляции – рекомбинантными гонадотропинами без предварительной десенситизации гипофиза;
- неудачная попытка индукции суперовуляции по программе ЭКО.
Было отобрано 140 пациенток с трубным бесплодием, дисгормональной дисплазией молочной железы или без таковой и неудачной попыткой индукции суперовуляции по программе ВРТ ЭКО. Участницы исследования случайным образом были рандомизированы на две группы. Основную группу составили 108 женщин с диффузной ДДМЖ второй категории по BI-RADS, контрольную группу – 32 пациентки без патологии молочной железы.
Молочные железы обследовали в первую фазу менструального цикла (на пятый – десятый день) перед применением протокола стимуляции суперовуляции и через три месяца после неудачной попытки ЭКО. Для этого проводили ультразвуковое исследование (УЗИ) линейным датчиком 14 МГц с применением цветового и энергетического допплеровского картирования (аппарат SONIX, США).
Результаты, полученные при использовании методов лучевой диагностики, обрабатывались автоматически с помощью разработанного нами диагностического алгоритма (патент РФ № 2452389 от 10.06.2012 «Способ дифференциальной диагностики форм фиброзно-кистозной болезни у женщин с сохраненной репродуктивной функцией»).
Уровень фолликулостимулирующего гормона (ФСГ), лютеинизирующего гормона (ЛГ), пролактина, эстрадиола, общего тестостерона, дегидроэпиандростерон-сульфата (ДГЭА-С), 17-оксипрогестерона, секс-стероид-связывающего глобулина (СССГ), тиреотропного гормона (ТТГ), свободного трийодтиронина (св. Т3), свободного тироксина (св. Т4), адренокортикотропного гормона (АКТГ), кортизола и антител к тиреопероксидазе (AT-ТПО) в сыворотке крови определяли в раннюю фолликулярную фазу менструального цикла. Для этого применяли иммуноферментный анализ с использованием стандартных наборов компании Hoffman La Rosh (Франция).
Значения прогестерона в сыворотке крови оценивали во вторую фазу менструального цикла (на 20– 22-й день).
Статистическую обработку данных проводили с помощью стандартного пакета программ Statistica Windows (2000, версия 6.0) фирмы Statsoft Inc. и пакета программ Microsoft Excel (2006) корпорации Microsoft [15].
В рамках исследования также оценивалась эффективность растительного препарата Мастодинон® (компания «Бионорика CE», Германия) при ДДМЖ.
Основным компонентом препарата Мастодинон® является экстракт плодов прутняка обыкновенного BN0 1095 (лат. Vítex agnus-castus). Плоды прутняка обыкновенного широко применяются при расстройстве менструального цикла, аменорее, недостаточности лютеиновой фазы, предменструальном синдроме (ПМС).
Помимо прутняка обыкновенного в состав препарата входят активные компоненты стеблелиста василистниковидного, фиалки альпийской, грудошника горького, ириса разноцветного и тигровой лилии.
Для лечения фиброзно-кистозной болезни препарат Мастодинон® используется с 1975 г. Основной механизм его действия заключается в стимулировании дофаминовых D2-рецепторов передней доли гипофиза. Вследствие этого снижается секреция пролактина, что приводит к регрессу патологических процессов в молочной железе при мастопатии и ПМС.
В клинических исследованиях продемонстрирован также антиоксидантный эффект препарата [6], а в условиях in vitro – способность его основного компонента взаимодействовать с опиоидными рецепторами [16–20].
Наши многолетние исследования показали наличие у препарата дополнительных положительных свойств, а именно: восстановление функционального состояния вегетативной нервной системы, устранение надпочечниковой дисфункции за счет нормализации уровней АКТГ и кортизола, регуляция метаболизма эстрогенов за счет повышения продукции 2-гидроксиэстрона и улучшения соотношения «2-ОНЕ1/16-альфаОНЕ1», повышение синтеза интерлейкина 10, снижение продукции фактора некроза опухоли альфа.
Указанные эффекты препарата Мастодинон® обусловливают его назначение для защиты молочной железы от нежелательных эффектов комбинированных пероральных контрацептивов и менопаузальной гормональной терапии [21].
В эту часть исследования были включены 150 пациенток репродуктивного возраста (от 24 до 35 лет) с ДДМЖ и трубным бесплодием. 90 участниц были распределены на три равноценные группы: с железистой, кистозной, фиброзной формами ДДМЖ. Они принимали Мастодинон® по 30 капель два раза в день (в соответствии с инструкцией) в течение 12 недель. Далее следовал период наблюдения – до 24 недель (шесть месяцев). Помимо основной группы была сформирована группа сравнения. В нее вошли 30 пациенток с ДДМЖ, не получавших консервативного лечения. Контрольную группу составили 30 женщин без соматических, маммологических и гинекологических патологий. Женщины контрольной и основной групп были сопоставимы по возрасту.
Для пациенток с ДДМЖ дизайн исследования предполагал четыре визита: первый – до начала исследования, второй – в начале лечения, третий – через три месяца от начала лечения, четвертый – через три месяца после неудачной попытки ЭКО. Индукция овуляции проводилась в следующем цикле по окончании трехмесячного курса терапии.
Результаты
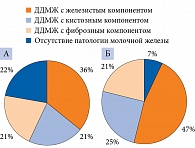
Согласно результатам УЗИ, проведенного до ЭКО, у 32 (22%) пациенток отсутствовала патология молочной железы, у 50 (36%) диагностирована ДДМЖ с преобладанием железистого компонента, у 29 (21%) – ДДМЖ с преобладанием кистозного компонента и у 29 (21%) женщин – ДДМЖ с преобладанием фиброзного компонента (рисунок).
Повторное обследование было проведено только через три месяца, так как учитывался период, необходимый для адаптации после гормональной нагрузки и реакции вегетативной нервной системы на ненаступление беременности. Патология молочной железы отсутствовала только у десяти (7%) больных, ДДМЖ с преобладанием железистого компонента выявлена у 65 (47%), с преобладанием кистозного компонента – у 35 (25%) и преобладанием фиброзного компонента – у 30 (21%) пациенток (см. рисунок).
Необходимо отметить, что правильная интерпретация эхоскопических данных, а также определение формы ДДМЖ по-прежнему остаются актуальной проблемой для специалистов ультразвуковой диагностики. Показатели обследования в виде абсолютных значений признаков вводились в разработанный нами диагностический алгоритм с последующим пересчетом диагностических коэффициентов. Их математическая обработка показала, что основными объективными критериями для установления формы ДДМЖ по классификации Н.И. Рожковой является толщина премаммарной и ретромаммарной клетчатки, а также фиброгландулярного слоя [22].
Исходно у больных ДДМЖ с преобладанием железистого компонента толщина фиброгландулярного слоя была повышена (18,53 ± 0,53 мм), а толщина премаммарной и ретромаммарной клетчатки снижена – 3,87 ± 0,56 и 2,37 ± 0,53 мм соответственно. Эти показатели статистически значимо (р < 0,05) отличались от аналогичных показателей у пациенток контрольной группы. При ДДМЖ с преобладанием кистозного компонента кисты в обеих молочных железах обнаружены у 70% пациенток, в одной – у 30%, их средний диаметр составил 5 [4–7] мм. Кроме того, у этих больных была снижена толщина ретромаммарного слоя – 4,30 ± 0,42 мм (по сравнению с участницами без патологии молочной железы, р < 0,05). У пациенток с ДДМЖ с преобладанием фиброзного компонента отмечались резкое повышение эхогенности железистой ткани, перидуктальный фиброз и фиброзирование связок Купера. Однако статистически значимых различий в отношении толщины премаммарной и ретромаммарной клетчатки, а также фиброгландулярного слоя между этими больными и пациентками контрольной группы не получено (р > 0,05).
Согласно результатам УЗИ, через три месяца после неудачной попытки ЭКО у пациенток без патологии молочной железы статистически значимо (р < 0,05) повысилась толщина фиброгландулярного слоя (16,62 ± 0,12 мм). Аналогичная тенденция наблюдалась у женщин с ДДМЖ с преобладанием железистого компонента. Увеличение толщины фиброгландулярного слоя оказалось статистически значимым относительно исходных значений (р < 0,05) – 23,24 ± 0,44 мм. При ДДМЖ с преобладанием кистозного компонента статистически значимых изменений относительно исходных показателей не выявлено, однако средний диаметр кист увеличился до 8 [6–9] мм. В 80% случаев кисты были обнаружены в обеих молочных железах. В случае ДДМЖ с преобладанием фиброзного компонента толщина премаммарной и ретромаммарной клетчатки, а также фиброгландулярного слоя достоверно не изменилась (р > 0,05) (табл. 1).
Таким образом, после неудачной попытки ЭКО возросло число пациенток с патологией молочной железы. Перераспределение произошло за счет увеличения количества женщин с ДДМЖ с преобладанием железистого и кистозного компонентов. Полученные данные свидетельствуют, что ВРТ ЭКО оказывает влияние на состояние молочной железы.
Изменения в тканях молочных желез при ДДМЖ напрямую зависят от гормональных изменений в организме, поэтому одновременно исследовали гормональный статус участниц.
Исходно в основной группе зафиксировано повышение уровней ФСГ, ТТГ, эстрадиола и пролактина. Различия между основной и контрольной группами по данным показателям оказались статистически значимыми (р < 0,05). Через три месяца после неудачной попытки ЭКО в обеих группах уровни данных гормонов статистически значимо (р < 0,05) увеличились (табл. 2). В то же время в отношении уровней ЛГ, общего тестостерона, ДГЭА-С, 17-оксипрогестерона, СССГ, св. Т3, св. Т4, АКТГ, кортизола, прогестерона и AT-ТПО статистически значимых различий между группами и исходными значениями не зафиксировано (р > 0,05).
Выявление и лечение ДДМЖ согласно приказам Минздрава России № 572н от 01.11.2012 и № 915 от 15.11.2012 входит в обязанности акушера-гинеколога. Разработанный нами способ дифференциальной диагностики форм фиброзно-кистозной болезни у женщин с сохраненной репродуктивной функцией позволяет не только диагностировать форму ДДМЖ в любом возрасте, но и оценить эффективность проводимых лечебных мероприятий.
Для оценки эффективности растительного препарата Мастодинон® при ДДМЖ также была использована разработанная нами математическая модель.
Сумма всех диагностических коэффициентов составила -3,005674202, что меньше порогового значения -1,264262505. Анализ полученных результатов показал, что ошибка риска составляет 0,3–0,7 при 95%-ном доверительном интервале. Следовательно, состояние молочных желез у пациенток с ДДМЖ после применения препарата Мастодинон® было таким же, как у здоровых женщин (контрольная группа) (табл. 3).
Обсуждение результатов
Принципиальным отличием нашего исследования стали его дизайн и критерии формирования групп. Пациентки имели только один фактор бесплодия – трубный, хороший овариальный резерв и не имели эндокринной и соматической патологий. Состояние молочных желез оценивалось до и после неудачной попытки ЭКО с использованием единого протокола стимуляции суперовуляции.
Через три месяца после неудачной попытки ЭКО количество пациенток с патологией молочной железы увеличилось.
Анализ структуры ДДМЖ у этой категории пациенток показал, что увеличение заболеваемости произошло за счет ДДМЖ с преобладанием железистого и кистозного компонентов.
Полученные данные подтверждают предположение о том, что гормональные препараты, применяемые при стимуляции суперовуляции в протоколах ЭКО, оказывают негативное влияние на состояние молочной железы. В частности, они повышают риск развития не только диффузной доброкачественной дисплазии, но и потенциально РМЖ.
При оценке особенностей гормонального статуса перед и после цикла стимуляции у всех пациенток с трубным бесплодием выявлены однонаправленные изменения уровней гормонов, патогенетически связанных с формированием доброкачественной патологии молочной железы и применяемым препаратом рекомбинантного ФСГ. Это также подтверждает, что стимуляция суперовуляции в цикле ЭКО, оказывая влияние на репродуктивную систему, значимо повышает уровни ФСГ, ТТГ, эстрадиола и особенно пролактина. Эта тенденция сохраняется в течение трех месяцев после неудачной попытки ЭКО. Полученные результаты позволяют сделать вывод о возникновении гормонального дисбаланса, что и приводит к изменениям в тканях молочной железы и развитию доброкачественной дисплазии. Известно, что пролактин в отличие от других гипофизарных гормонов обладает большим количеством биологических эффектов. Повышение его уровня в крови ассоциируется с риском развития РМЖ [23].
В то же время увеличение в структуре патологий молочной железы после ВРТ доли ДДМЖ с преобладанием железистого компонента свидетельствует о хорошем прогнозе при проведении терапии.
Препарат Мастодинон® продемонстрировал высокую эффективность при диффузной доброкачественной дисгормональной дисплазии молочной железы. Значимыми объективными критериями оценки эффективности стали клинические симптомы и эхографические показатели (толщина премаммарной и ретромаммарной клетчатки, а также фиброгландулярного слоя).
Разработанная нами математическая модель позволила не только максимально объективно провести диагностику ДДМЖ, но и оценить эффективность проводимой терапии. Полагаем, что использование данной модели поможет существенно ускорить и облегчить работу специалистов практического здравоохранения.
Результаты исследования также продемонстрировали, что отсутствие терапии перед циклами суперовуляции в рамках программы ЭКО у пациенток с ДДМЖ и трубным бесплодием приводит к прогрессированию эхографических характеристик заболевания.
Заключение
При подготовке пациенток к программе ЭКО, а также после неудачной попытки его проведения требуется не только обследование молочных желез, но и лечение выявленной доброкачественной патологии. Для терапии ДДМЖ, а также для защиты молочных желез перед циклом индукции овуляции можно использовать препарат Мастодинон®.
L.S. Sotnikova, Ye.V. Golubyatnikova, Ye.V. Udut
Siberian State Medical University
Ye.D. Goldberg Research Institute of Pharmacology and Regenerative Medicine
Contact person: Larisa Stepanovna Sotnikova, sotnikova-larisa@mail.ru
The results of randomized study involving 140 patients with tubal infertility in combination with benign breast disease or without this pathology are presented. All of these patients had unsuccessful attempt of induction of superovulation within the in vitro fertilization programme. It was found that the number of patients with breast pathology after this procedure increases, as well as significantly increases the level of prolactin, follicle stimulating hormone, thyroid stimulating hormone and estradiol. In addition, the protective effect of Mastodynon® was shown.
