Жесткость артерий – фактор риска сердечно-сосудистых заболеваний: возможности медикаментозной коррекции
- Аннотация
- Статья
- Ссылки
![Рис. 1. Изменение кривизны пульсовой волны в результате старения [18]](/upload/resize_cache/iblock/296/195_350_1/sapunova1.jpg)


В современной медицине важны недорогие, общедоступные, легко воспроизводимые и неинвазивные методики. К настоящему моменту состояние сосудистой стенки неинвазивно возможно оценить с помощью магнитно-резонансной, компьютерной томографии и ультразвуковых методов. Именно ультразвуковые методики являются общедоступными, безопасными и недорогими. Один из таких методов оценки растяжимости и жесткости артериальной стенки – это измерение скорости распространения пульсовой волны (СПВ). Данный метод прост в исполнении, неинвазивный, точный и воспроизводимый. Некоторые модификации определения СПВ рекомендуются к использованию в амбулаторной практике как скрининговый метод обследования населения.
Отмечено, что скорость пульсовой волны, как величина динамическая, при воздействии на нее неблагоприятных факторов изменяется в сторону увеличения. В Рекомендациях Российского медицинского общества по артериальной гипертонии и Всероссийского научного общества кардиологов отмечено следующее: «Существует высокая степень корреляции между вероятностью развития сердечно-сосудистых осложнений и жесткостью крупных (эластических) артерий, оцениваемой по величине скорости распространения пульсовой волны на участке между сонной и бедренной артериями. Наибольшая вероятность осложнений наблюдается при повышении скорости пульсовой волны более 12 м/с» [1]. Наличие повышенной СПВ (> 12 м/с) приводится как критерий поражения органа-мишени (сосудистой стенки), на основании чего больного артериальной гипертензией (АГ) следует относить к группе высокого сердечно-сосудистого риска. Исследование артериальной ригидности приведено в этих рекомендациях в перечне инструментальных методов, рекомендуемых дополнительно.
Стенка артерий обладает мощными адаптационными механизмами и имеет разные упруго-эластические характеристики на различных участках сосудистого русла [2]. Аорта является сосудом эластического типа, основной компонент ее стенки – эластические волокна. По мере продвижения к периферии в артериальной стенке увеличивается пропорция мышечного слоя, что делает периферические артерии более жесткими.
Артериальная система обладает двумя взаимосвязанными функциями – проводящей и демпфирующей [3]. Выполнение первой функции определяется в основном шириной просвета артерий и сопротивлением потоку крови. Стойкое нарушение проводящей функции артерий возникает в основном при их окклюзии [4] или сужении [5]. Наиболее типичным окклюзирующим сосудистым заболеванием является атеросклероз.
Второй важнейшей функцией артерий является демпфирование осцилляций давления, обусловленных циклическим выбросом крови из левого желудочка сердца (эффект Виндкессела) и превращение пульсирующего артериального потока в стабильный, необходимый периферическим тканям и органам [6]. Способность артерий мгновенно поглощать ударный объем зависит от эластических свойств артериальной стенки, которые могут быть описаны такими терминами, как жесткость, растяжимость, податливость [7]. При нарушениях этих свойств кровь из левого желудочка выбрасывается в «жесткую» артериальную систему. При этом происходит генерирование повышенного систолического АД и уменьшение диастолической отдачи, что приводит к снижению диастолического АД. Также ускоренное отражение пульсовой волны способствует повышению пикового и конечного систолического давления в восходящей аорте, что сопровождается увеличением постнагрузки на левый желудочек и усилением потребления кислорода миокардом [8]. Смещение «возвращения» отраженной волны из диастолы в позднюю систолу способствует дальнейшему снижению диастолического АД, которое определяет распределение кровотока и коронарную перфузию.
Экспериментальные исследования показали, что ригидность аорты непосредственно уменьшает субэндокардиальный кровоток, кардиальную трансмуральную перфузию и усиливает субэндокардиальную ишемию. Повышение систолического АД вызывает гипертрофию миокарда, ухудшает диастолическую функцию левого желудочка и снижает выброс из него. Также повышенное систолическое и пульсовое давление ускоряют повреждение артерий, в результате формируется «порочный круг» [9].
Нарушение демпфирующей функции является результатом развития артериосклероза. Этот процесс иногда рассматривается как физиологический феномен старения, который приводит к диффузному фиброэластическому утолщению интимы, повышению содержания коллагена в медии, фрагментации эластической мембраны с вторичным фиброзом и кальцификацией средней оболочки артерий (рис. 1).
В настоящее время существуют методики как прямого измерения жесткости сосудистой стенки (определение диаметра и давления на данном участке с использованием ультразвука и катетеризации, метод магнитного резонанса, использование ангиографии), так и методы непрямого измерения жесткости (измерение скорости пульсовой волны, сфигмография) [10, 11].
Одним из неинвазивных сфигмографических методов оценки сосудистой ригидности является контурный анализ пульсовой волны (рис. 2). Регистрация цифровой пульсовой волны (DVP) основана на прохождении инфракрасного излучения через палец. Количество света прямо пропорционально объему крови, пульсирующей в пальце. Для минимизации получения плохого сигнала специально была разработана тепловая пластина в случае плохой перфузии или вазоконстрикции у пациента.
При формировании цифровой пульсовой волны отмечается два компонента. Первая часть волны (систолический компонент) формируется в результате распространения пульсового давления от дуги аорты к пальцу руки. Вторая часть (диастолический компонент) формируется в результате распространения пульсового давления от желудочка к аорте и далее к нижней части тела, с последующим его отражением через аорту к пальцу. Кривая цифровой пульсовой волны отражает прохождение как прямой пульсовой волны, так и ее отраженной части, таким образом мало изменяя форму DVP.
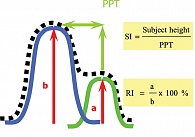
Высота диастолического компонента DVP зависит от значения пульсового давления отражения, характеризующего состояние сосудистого тонуса мелких артерий. Отношение времени диастолического компонента к времени систолического компонента зависит от скорости пульсовой волны в аорте и крупных артериях. Этот показатель отражает ригидность крупных артерий. Контурный анализ пульсовой волны позволяет определить два индекса – отражения и ригидности.
Индекс отражения RI – это процентное отношение высоты диастолического компонента DVP к высоте систолического компонента. Индекс отражает состояние тонуса мелких артерий и значение пульсовой волны отражения.
Индекс ригидности SI (stiffness index) оценивает скорость пульсовой волны крупных артерий и рассчитывается как отношение роста пациента к времени между систолическим и диастолическими компонентами волны DVP. Индекс SI является показателем ригидности крупных артерий [12, 13].
Аортальная СПВ, определяемая при каротидно-феморальном расположении датчиков, т.е. СПВкф (PWVcf, Pulse Wave Velocity carotid-femoral) в настоящее время является «золотым стандартом» измерения артериальной жесткости (ригидности). Измерения артериальной жесткости нужно рассматривать как рекомендованные тесты для оценки сердечно-сосудистого риска, в первую очередь для пациентов, у которых повреждение органов-мишеней не выявлено при обычных условиях [12].
Отмечается высокая корреляция между показателем SI и показателем СПВкф – «золотым стандартом» измерения артериальной ригидности, заболеваниями коронарных артерий (14) и толщиной комплекса интима-медиа.
Большое число исследований, посвященных проблеме артериальной ригидности, послужило основанием для публикации в 2006 году основополагающего документа под названием «Консенсус экспертов по артериальной ригидности: методологические подходы и практическое применение» [15]. В документе приведены клинические состояния, ассоциированные с повышенными артериальной ригидностью и/или отраженной пульсовой волной. Из физиологических состояний указывается старение, низкий вес при рождении, менопауза и гиподинамия. Из генетических причин приводится отягощенная наследственность по артериальной гипертензии, сахарному диабету и инфаркту миокарда. Помимо как таковых сердечно-сосудистых заболеваний (ишемической болезни сердца, хронической сердечной недостаточности, мозгового инсульта), выделяется группа факторов сердечно-сосудистого риска: ожирение, курение, повышение артериального давления, гиперхолестеринемия, нарушение толерантности к глюкозе, сахарный диабет типа 1 и 2, гипергомоцистеинемия, повышение уровня С-реактивного белка. Также указывается группа первично не сердечно-сосудистых заболеваний: хронические заболевания почек, ревматоидный артрит, системный васкулит, системная красная волчанка.
В последнее время многие исследования в медицинской практике проходят с учетом половых различий как в оценке течения заболеваний, так и их лечения. Framingham Heart Study было первым, в котором представлены существенные различия между мужчинами и женщинами. Течение инфаркта миокарда у женщин чаще сопровождалось фатальными осложнениями. Для них показательна большая распространенность инфаркта миокарда без развития патологического зубца Q на ЭКГ, существенно преобладали отрицательные результаты при проведении коронарографии (35% против 16% у мужчин). Внутрисосудистое ультразвуковое исследование и магнитно-резонансная томография выявляют атероматоз коронарных артерий там, где был получен отрицательный результат при коронарографии, при этом смертность в течение 6 месяцев после перенесенного инфаркта миокарда у мужчин составляет 7,9%, а у женщин – 22,8%.
Американские ученые установили, что желудочковая тахикардия/фибрилляция достоверно чаще наблюдается у мужчин: 52% против 34% у женщин. Исследователи пришли к выводу, что несмотря на сходную частоту проаритмогенных электрофизиологических субстратов у женщин может быть ниже чувствительность к аритмогенным триггерам (16). После аортокоронарного шунтирования риск смерти среди женщин остается крайне высоким по сравнению с мужской популяцией. Предполагается, что это связано с несколько иным течением атеросклеротического процесса в коронарных сосудах женщин. Поражение коронарной системы мужчин носит очаговый, локальных характер, что создает предпосылки для успешного проведения операций реваскуляризации; поражение коронарной системы женщин носит диффузный характер без выраженного стеноза, что менее благоприятно с точки зрения оперативного лечения.
На кафедре госпитальной терапии №1 МГМСУ было проведено исследование, в рамках которого изучались особенности ригидности сосудов у женщин с изолированной артериальной гипертензией, либо при ее сочетании с ишемической болезнью сердца и сахарным диабетом типа 2 по сравнению с мужчинами, страдающими аналогичными заболеваниями сердечно-сосудистой системы. Сравнение сопоставимых по возрасту пациентов проводилось по антропометрическим данным, ЧСС, САД, ДАД, показателем объемного дигитального пульса (SI – stiffness index, индекс ригидности) с помощью прибора Pulse Trace PWV (Micro Medical, United Kingdom), а также данным биохимического исследования крови, включающим в себя уровни глюкозы и такие показатели липидограммы, как общий холестерин (ОХС), триглицериды (ТГ), липопротеиды высокой (Хс-ЛПВП) и низкой (Хс-ЛПНП) плотности.
Группа женщин с АГ в целом характеризовало наличие ожирения (ИМТ = 29,12 ± 6,01 кг/м²), изменение показателей липидного обмена, повышенная сосудистая ригидность. Показатели липидного и углеводного обменов, а также ИМТ между группами достоверно не отличались, равно как и показатели АД, вместе с тем, у женщин выявлены достоверно менее высокие значения индекса ригидности. Таким образом, у мужчин наблюдались более выраженные нарушения жесткости сосудов, чем у женщин аналогичного возраста, страдающих АГ сопоставимой степени тяжести.
Аналогично пациенткам, страдающим только АГ, в группе сочетанной патологиеи выявлены ожирение (ИМТ = 29,54 ± 7,14 кг/м²), гиперлипидемия за счет атерогенной фракции и повышенный индекс ригидности. Однако по сравнению с мужчинами у женщин с аналогичным сочетанием заболеваний, отмечаются достоверно менее высокие значения индекса ригидности, а также показатели САД и ДАД. Следовательно, у женщин наблюдаются менее выраженные нарушения жесткости сосудов, а также показателей артериального давления, чем у мужчин сопоставимого возраста, страдающих аналогичным сочетанием заболеваний сердечно-сосудистой системы.
При гендерном сравнении пациентов, у которых помимо артериальной гипертензии и ишемической болезни сердца был диагностирован сахарный диабет типа 2, получены данные, приведенные в таблице 3.
Проводя сопоставление групп женщин и мужчин, у которых наряду с наличием АГ и ИБС имел место сахарный диабет типа 2, отмечено отсутствие каких-либо достоверных различий по всем представленным параметрам. Присоединение сахарного диабета типа 2 полностью нивелирует гендерные различия, более того, у женщин отмечено более высокое среднее значение индекса ригидности SI по сравнению с мужчинами, тогда как в предыдущих группах сравнения показатели сосудистой жесткости у женщин были достоверно ниже.
Таким образом, попытка гендерного сопоставления основных антропометрических параметров, показателей углеводного и липидного обмена, значения АД и сосудистой жесткости выявила как наличие сходства течения сравниваемых заболеваний (по наличию и выраженности ожирения и липидных нарушений, значениям АД), так и достоверных различий, проявляющихся менее выраженной сосудистой ригидностью у женщин с АГ и сочетанием АГ и ИБС. Присоединение к артериальной гипертензии и ишемической болезни сердца сахарного диабета типа 2 полностью нивелирует различия между группами мужчин и женщин по показателю сосудистой жесткости.
Так как повышенная артериальная ригидность отмечается при достаточно большом количестве заболеваний, то не менее актуально изучение воздействий, которые способны снижать артериальную жесткость. Уменьшение артериальной ригидности может быть достигнуто в целом антигипертензивными препаратами в результате снижения давления растяжения. Однако это лишь один из механизмов повышения податливости артерий. Проводившиеся сравнительные исследования выявили существенные различия во влиянии лекарственных средств на артериальную жесткость при сопоставимом снижении уровня АД. Это позволяет предполагать, что некоторые лекарственные препараты обладают непосредственным воздействием на эластические свойства сосудистой стенки, не связанной с их гипотензивным эффектом.
Особого упоминания заслуживает наиболее часто цитируемое исследование COMPLIOR, в котором у пациентов с АГ (около 1700 больных) скорость пульсовой волны измерялась до и после 6-месячного лечения ингибитором АПФ периндоприлом. Было выявлено достоверное снижение ригидности артерий (СПВ уменьшалась на 1,1 м/с), при этом не было обнаружено достоверной корреляции между снижением АД и увеличением податливости артерий [17].
В исследовании X-CELLENT оценивалась эффективность фиксированных доз диуретика индапамида ретард 1,5 мг, блокатора рецепторов ангиотензина II кандесартена и антагониста кальция амлодипина у больных АГ без поражения органов-мишеней (всего более 2400 пациентов). Сравнение гипотензивной активности в общей группе показало практически одинаковую способность трех препаратов снижать систолическое АД, однако индапамид ретард достоверно лучше влиял на эластичность крупных сосудов по сравнению с амлодипином и кандесартаном.
В литературе имеются сведения об исследованиях, где отражено влияние различных антигипертензивных препаратов на сосудистую стенку (18). Так, в одном из них показано преимущество использования комбинации трандолаприла и верапамила по сравнению с монотерапией этими препаратами. Их эффект оценивался по влиянию на среднее АД, пульсовое давление, толщину, диаметр, жесткость сонных артерий, аорты и плечевой артерии, гипертрофию левого желудочка.
В сравнительном исследовании терапии лизиноприлом и метопрололом было обнаружено их сходное влияние на жесткость артерий. Но этот эффект сохранялся в течение 4 недель после отмены препарата в группе лечения лизиноприлом в отличие от метопролола, что объясняется структурными влияниями ингибиторов АПФ на свойства артериальной стенки.
Имеются также данные о преимуществе комбинации малых доз индапамида (0,625 мг) и периндоприла (2 мг) перед монотерапией атенололом. Отмечалось более значительное снижение САД, пульсового давления и СПВ на сонных артериях в группе комбинированного лечения периндоприлом/индапамидом по сравнению с атенололом, что демонстрирует положительное влияние препаратов на жесткость артерий.
При сравнении терапии АГ вальсартаном 160 мг и каптоприлом 100 мг выявлено, что оба препарата оказывали сходное благоприятное влияние на жесткость артерий. Однако комбинированное лечение этими препаратами повышало периферическое сопротивление артерий в значительно большей степени. При этом также не было обнаружено корреляции данного эффекта со снижением уровня АД.
β-Адреноблокаторы оказывают неодинаковое влияние на жесткость артерий. Положительный эффект отмечен у бисопролола 10 мг. Метопролол 50–200 мг уступал лизиноприлу 5–20 мг. Атенолол 100 мг в отличие от нитрендипина 20 мг в течение 8 месяцев лечения не влиял на СПВ при достаточном снижении АД.
При сравнении пропранолола с феноламином, нитропруссидом натрия, каптоприлом и нифедипином в дозах, адекватно контролирующих АД, обнаружено неблагоприятное влияние пропранолола на жесткость артерий, оцениваемую инвазивно.
Исследования показали, что все дигидропиридины снижают СПВ.
У лиц с АГ с повышением жесткости аорты увеличивается уровень альдостерона в плазме крови. Предполагалось, что антагонисты альдостерона будут эффективны в отношении снижения жесткости аорты, но при лечении спиронолактоном в течение 2 недель этого не было обнаружено. При этом предварительное исследование селективного антагониста альдостерона эплеренона показало значительное снижение СПВ.
Таким образом, благоприятное воздействие на артериальную стенку оказывают диуретики (индапамид), β-блокаторы (бисопролол), ингибиторы АПФ (эналаприл, спираприл, периндоприл), блокаторы рецепторов к ангиотензину II (вальсартан), антагонисты кальция (амлодипин), статины (аторвастатин). Из нефармакологических способов отмечается использование α-линоленовой кислоты, рыбьего жира, заместительной гормональной терапии [19].
