количество статей
7261
Загрузка...
Пожалуйста, авторизуйтесь:
Исследования
Возможности вакцинации при рецидивирующей инфекции мочевых путей
"ЭФФЕКТИВНАЯ ФАРМАКОТЕРАПИЯ. Урология и Нефрология" №4
- Аннотация
- Статья
- Ссылки
Вследствие невысокой эффективности антибактериального лечения в статье обосновывается возможность проведения иммунопрофилактики рецидивирующих инфекций мочевых путей (ИМП) на примере препарата Уро-Ваксом.
Уро-Ваксом – единственный препарат, не относящийся к антибиотикам, который рекомендован Европейской урологической ассоциацией для иммунопрофилактики рецидивов ИМП. Полученные в клинических исследованиях данные свидетельствуют, что Уро-Ваксом стимулирует как врожденный, так и приобретенный иммунный ответ.
Клиническая эффективность (в том числе для профилактики рецидивов) и безопасность препарата были подтверждены в исследовании, проведенном на базе ФГБУ «НИИ урологии» Минздравсоцразвития России, с участием 90 женщин с рецидивирующим бактериальным циститом.
Вследствие невысокой эффективности антибактериального лечения в статье обосновывается возможность проведения иммунопрофилактики рецидивирующих инфекций мочевых путей (ИМП) на примере препарата Уро-Ваксом.
Уро-Ваксом – единственный препарат, не относящийся к антибиотикам, который рекомендован Европейской урологической ассоциацией для иммунопрофилактики рецидивов ИМП. Полученные в клинических исследованиях данные свидетельствуют, что Уро-Ваксом стимулирует как врожденный, так и приобретенный иммунный ответ.
Клиническая эффективность (в том числе для профилактики рецидивов) и безопасность препарата были подтверждены в исследовании, проведенном на базе ФГБУ «НИИ урологии» Минздравсоцразвития России, с участием 90 женщин с рецидивирующим бактериальным циститом.
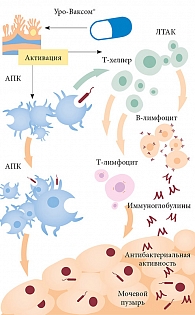
Рис. 1. Механизм действия препарата Уро-Ваксом: стимуляция иммунного ответа против бактериальной инвазии при рецидивирующей ИМП
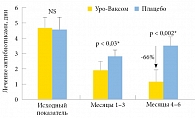
Рис. 2. Длительность применения антибиотиков у взрослых пациентов с рецидивирующими ИМП на фоне терапии препаратом Уро-Ваксом или плацебо

Рис. 3. Средняя частота обострений инфекции мочевыводящих путей у взрослых пациентов с рецидивирующими ИМП на фоне терапии препаратом Уро-Ваксом или плацебо
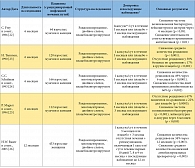
Таблица. Основные клинические исследования, проводимые с использованием препарата Уро-Ваксом
Введение
Инфекции мочевых путей (ИМП) представляют серьезную проблему для здоровья миллионов людей: ежегодно в Западной Европе наблюдают свыше 10 млн случаев заболевания [1]. Неосложненный острый цистит характеризуется микробным поражением слизистой оболочки мочевого пузыря и хорошо поддается терапии антимикробными препаратами. Однако, несмотря на эффективность терапии острого цистита даже при анатомически не изменных мочевых путях, заболевание часто рецидивирует. О хроническом цистите говорят в случае развития не менее двух обострений за 6 месяцев или трех за 12 месяцев. Основным возбудителем неосложненной ИМП (НИМП) является уропатогенная E. coli (от 75 до 90% случаев); в 5–20% случаев этиологически значимыми возбудителями являются Klebsiella pneumoniaе , Staphylococcus saprophyticus, Proteus spp. [2, 3]. На сегодняшний день стандартизированного подхода к лечению рецидивирующей ИМП не выработано. Для профилактики рецидивирующей НИМП рекомендуется длительный прием антибактериальных лекарственных средств в низких (субингибирующих) дозах [4]:
- фуразидина калиевая соль в сочетании с магнием карбоната основным (Фурамаг) по 50 мг на ночь от 1 до 3 месяцев;
- норфлоксацин внутрь 200 мг 1 р/сут, длительно;
- триметоприм внутрь 100 мг 1 р/сут, длительно;
- цефиксим внутрь 200 мг 1 р/сут, длительно;
- ципрофлоксацин внутрь 125 мг 1 р/сут, длительно;
- ко-тримоксазол внутрь 40/200 мг 1 р/сут, длительно.
В настоящее время доказана эффективность длительных курсов антибактериальной профилактики, которая для ко-тримоксазола составляет 2–5 лет, для других лекарственных средств – до 6–12 месяцев [5]. Однако длительный прием противомикробных препаратов приводит к селекции резистентных штаммов микроорганизмов, развитию аллергических реакций, и, более того, после прекращения такого поддерживающего лечения примерно у 60% женщин в течение 3–4 месяцев отмечается рецидив ИМП. Альтернативным методом лечения служит посткоитальная антимикробная профилактика при наличии четкой взаимосвязи между обострением ИМП и половым актом или лечение обострений ИМП полными курсовыми дозами антимикробных лекарственных средств [4, 6]:
- фосфомицина трометамол 3 г - одна доза каждые 10 дней в течение 3 месяцев;
- фуразидина калиевая соль в сочетании с магнием карбоната основным (Фурамаг) по 100 мг 3 р/сут – 7–10 дней;
- норфлоксацин по 400 мг 2 р/сут – 5 дней;
- левофлоксацин по 500 мг 1 р/сут – 5 дней;
- ципрофлоксацин по 250 мг 2 р/сут – 5 дней;
- цефиксим по 400 мг 1 р/сут – 7 дней.
При повторном появлении симптомов заболевания через 2 недели после окончания приема антибиотиков/уросептиков необходимо проведение бактериологического исследования мочи с определением чувствительности к препаратам выявленного возбудителя и повторный курс лечения другим лекарственным средством. Учитывая невысокую эффективность антибактериального лечения рецидивирующей ИМП, большое значение приобретают альтернативные методики, в частности иммунопрофилактика рецидивов заболевания.
Иммунопрофилактика рецидивирующей ИМП
Тяжесть течения ИМП зависит от вирулентности возбудителя и врожденноантибактериальной защиты хозяина. В норме стерильность мочевых путей поддерживается работой иммунной системы. У «иммунологически устойчивых» хозяев бактериурия является преходящей. Полное очищение от инфекции достигается посредством самого акта мочеиспускания, воздействия микробиоцидных молекул слизистой оболочки, таких как дефензины, и миграции в очаг поражения клеток воспаления. При персистирующей инфекции активизируется комплексная защита хозяина с постепенным переходом от врожденного к специфическому иммунитету.Для распознавания антигенных структур, присутствующих на поверхности бактерий, и для инициации соответствующей иммунной реакции важны оба вида иммунного ответа – врожденный и приобретенный. Иммунная активация контролируется разными рецепторами и сигнальными путями [7].
Первой линией защиты от патогенных микроорганизмов, для которых слизистые оболочки являются входными воротами инфекции, служат врожденные факторы местного иммунитета. Их важнейшими компонентами являются Т-гамма-бета- и В1-лимфоциты, заселяющие эпителий слизистых, которые характеризуются способностью усвоения патоген-ассоциированных молекулярных структур (pathogen-associated molecular patterns – PAMPs) без ко-стимулирующих сигналов и предварительного процессинга другими факторами иммунитета. Наряду с ними важную роль в поддержании местного иммунитета играют и другие иммунокомпетентные клетки, включая эпителиальные клетки, несущие на своей мембране толл-подобные рецепторы (toll-like-receptors, TLR), натуральные киллеры (NK) с цитолитической активностью, T-альфа-бета-, Th1-, B2-лимфоциты и др., взаимодействие которых с Т-гамма-бета- и В1-лимфоцитами обеспечивает активацию местного и системного иммунитета к антигенам/патогенам. Доказано, что интенсивный обмен лимфоцитами происходит не только между лимфоидными образованиями, ассоциированными со слизистыми оболочками различных органов, но и с селезенкой (системный иммунитет) [7]. Во многих исследованиях in vitro и in vivo и некоторых клинических испытаниях с участием человека были изучены иммунологические свойства препарата Уро-Ваксом. Полученные данные указывают на то, что данное лекарственное средство стимулирует как врожденный, так и приобретенный иммунный ответ. Примерная схема действия препарата Уро-Ваксом представлена на рисунке 1 [8].
Активизация врожденного иммунитета
Врожденный иммунитет отвечает за защиту против острой бактериальной инфекции. Чувствительность пациента к ИМП управляется генетическими механизмами, которые контролируют врожденный иммунный ответ. Воспалительная реакция запускается уропатогенной E. coli через факторы вирулентности, включая фимбрии Р и 1-го типа, которые служат посредниками адгезии к уротелию. Хемокиновые рецепторы вовлекаются для распознавания бактериальных факторов вирулентности, а TLR-рецепторы – для сигнализирования. Активация TLR-рецепторов слизистой оболочки мочевого пузыря стимулирует внутриклеточные сигнальные пути. Нейтрофилы, борющиеся с инфекцией E. coli, привлекаются и активизируются хемокинами и их рецепторами. Дисфункция этих рецепторов оказывает большое влияние на индивидуальную чувствительность к ИМП. В ответ на сигналы TLR активизируется провоспалительный ответ,контролирующий местную активацию клеток в месте инфицирования. Клетки воспаления привлекаются к инфицированным тканям также посредством секреции цитокинов, интерферонов и хемокинов. Таким образом, TLR-рецепторы контролируют выраженность и активность воспалительной реакции. Дисфункция TLR4 может иметь защитное действие вследствие подавления воспаления и симптомов заболевания [9].
Макрофаги, дендритные и эпителиальные клетки имеют разные образраспознающие рецепторы (ОРР), например, такие как TLR-рецепторы, которые играют ключевую роль в активизации врожденного иммунитета. Эти рецепторы распознают вирулентные компоненты патогенных микроорганизмов, включая компоненты, содержащиеся в препарате Уро-Ваксом, и инициируют иммунный ответ, направленный на их разрушение [10, 11, 12]. В экспериментальных условиях [9] TLR были основными рецепторами для инициации врожденного иммунного ответа против вирулентных штаммов E. coli. Исследования in vitro показали, что Уро-Ваксом стимулирует активность макрофагов и нейтрофилов [13], активизирует созревание дендритных клеток [14] и увеличивает экспрессию адгезивных молекул нейтрофилами [15]. Кроме того, исследования на мышах показали, что Уро-Ваксом повышает активность лейкоцитов в крови и секрецию фактора некроза опухоли альфа (ФНО-альфа) перитонеальными клетками [16], а также иммуноглобулина G (IgG) в культуре клеток селезенки [17]. Молекулярный механизм, посредством которого Уро-Ваксом стимулирует клетки врожденного иммунитета, вероятно, связан с его способностью активировать ОРР-рецепторы, такие как TLR2 и TRL4 [16].
Активизация приобретенного иммунитета
На поверхности эпителия кишечника бактерии или бактериальные компоненты (такие как в составе препарата Уро-Ваксом) распознаются дендритными клетками и инициируют различные реакции специфического иммунного ответа. Благодаря одной из таких реакций активированные дендритные клетки взаимодействуют с «нативными» Т-лимфоцитами, которые дифференцируются и представляют бактериальные антигены В-лимфоцитам в Пейеровых бляшках, что, в свою очередь, приводит к секреции иммуноглобулинов [18]. В результате в эпителии мочевыводящих путей накапливается большое количество секреторного IgА, что является важным фактором профилактики ИМП и их рецидивов.
Экспериментальные исследования Уро-Ваксома
В клинических испытаниях мыши получали многократные дозы препарата Уро-Ваксом перорально или внутрибрюшинно [19]. При обоих способах применения уровни сывороточных IgA и IgG ко всем 18 антигенам E. coli значительно повышались по сравнению с контрольной группой. Это указывает на соответствующий защитный эффект, развивающийся при применении препарата Уро-Ваксом, – стимуляция выработки IgA, который выступает в роли антиген-специфического барьера для патогенных микроорганизмов в эпителии мочевыводящих путей. Секретируемые IgA и IgG также проявляли перекрестную активность в отношении других штаммов и видов бактерий, выделенных при ИМП. Это вселяет надежду, что препарат Уро-Ваксом сможет обеспечить защиту от более широкого спектра микроорганизмов – возбудителей ИМП, а не только от используемых в его составе штаммов кишечной палочки.
Клинические данные по применению препарата Уро-Ваксом при лечении рецидивирующих инфекций нижних мочевыводящих путей
В настоящее время Уро-Ваксом является единственным препаратом, не относящимся к антибиотикам, который рекомендован для иммунопрофилактики согласно руководству Европейской урологической ассоциации (уровень рекомендаций В). Он производится путем лизиса 18 патогенных штаммов E. coli и имеет лекарственную форму в виде капсул 6 мг для перорального применения [20]. В ходе клинической разработки препарата Уро-Ваксом были проведены исследования, включающие более 2000 пациентов, страдающих рецидивирующими ИМП. За пять лет препарат получили более миллиона пациентов [21]. Все основные рандомизированные плацебоконтролируемые клинические исследования, проводимые с участием пациентов с рецидивирующей ИМП, продемонстрировали статистически значимую эффективность применения препарата Уро-Ваксом (табл.) и достоверное снижение частоты рецидивов в течение 6 месяцев или одного года по сравнению с плацебо (р от < 0,003 до < 0,0001) [22–26]. В одном из исследований с участием 160 взрослых пациентов с рецидивирующей ИМП, проведенном в Бельгии (84% женщин с > 3 рецидивами в год), пациенты были рандомизированы на группы лечения Уро-Ваксомом (1 капсула в сутки) (n = 82) или плацебо (n = 78) в течение трех месяцев с последующим 3-месячным периодом наблюдения [24]. По сравнению с плацебо Уро-Ваксом вызывал снижение числа рецидивов на 48% и 51% во время лечения и последующего наблюдения соответственно. При этом Уро-Ваксом также значительно уменьшал количество дней, в течение которых пациенты принимали антибиотики (на 35% в период лечения и 66% в период наблюдения) (рис. 2).
Кроме того, Уро-Ваксом способствовал существенному снижению бактериурии, лейкоцитурии, эритроцитурии, нитритурии, альбуминурии и количества мочевых цилиндров и в целом хорошо переносился. Частота возникновения нежелательных явлений в группе плацебо была выше, чем в группе лечения (6% и 2% соответственно). В аналогичном рандомизированном многоцентровом исследовании, проведенном в Венгрии, было проведено лечение 112 пациентов (85% женщин) с рецидивирующими инфекциями нижних мочевых путей (≥ 105 бактерий/мл в средней порции мочи), которое включало либо одну капсулу препарата Уро-Ваксом в сутки в течение трех месяцев, либо плацебо с последующим 3-месячным периодом наблюдения [22]. Рецидивов ИМП не наблюдалось у 67,2% пациентов при использовании препарата Уро-Ваксом по сравнению с 22,2% в группе плацебо (р < 0,0005). Частота бактериурии, дизурии и лейкоцитурии также значительно уменьшилась (от р < 0,001 до р < 0,005 через 6 месяцев). Кроме того, у пациентов, получавших Уро-Ваксом, не было зарегистрировано развития побочных реакций.
В более крупном многоцентровом исследовании, проведенном в 11 странах Европы, изучались преимущества проведения реиммунизации препаратом Уро-Ваксом после проведения первичного лечения [26]. Из 453 пациенток, страдающих рецидивирующей ИМП (не менее 3 рецидивов за последний год и ≥ 103 бактерий/мл мочи), 231 пациентка получала Уро-Ваксом,а 222 – плацебо. Длительность лечения составила 3 месяца. После трехмесячного перерыва первая группа получала одну капсулу Уро-Ваксома в сутки в течениепервых 10 дней 7, 8 и 9-го месяца, после чего следовал период наблюдения длительностью три месяца. По сравнению с плацебо, в течение первых 6 месяцев прием Уро-Ваксома вызывал снижение частоты возникновения ИМП на 20%, а в течение последующих 6 месяцев этот показатель составил 43%, что говорит о повышении эффективности лечения при повторной иммунизации. Назначение антибиотиков значительно сократилось при применении препарата Уро-Ваксом (2,44 по сравнению с 2,79 на 1 пациента; р < 0,005), также наблюдалось снижение частоты дизурии, поллакиурии и болевого синдрома по сравнению с плацебо. Общее снижение частоты рецидивов ИМП составило 34% (рис. 3), а общая длительность рецидивов была на 49% короче при применении Уро-Ваксома по сравнению с плацебо. Побочные реакции, в основном головная боль и желудочно-кишечные расстройства, возникали с одинаковой частотой в обеих группах. Серьезных осложнений отмечено не было.
Во всех клинических исследованиях было продемонстрировано, что Уро-Ваксом при лечении ИМП является высокоэффективным препаратом и достоверно уменьшает выраженность и длительность симптомов ИМП по сравнению с плацебо. Во всех исследованиях частота рецидивов при использовании Уро-Ваксома была статистически значимо ниже, причем показатели достоверно снижались в случае проведения реиммунизации. Общая длительность рецидивов ИМП и необходимость проведения терапии антибиотиками также были значительно снижены. Эффективность и безопасность препарата Уро-Ваксом позволяют рекомендовать его применение при лечении рецидивирующих ИМП.
Собственный опыт применения препарата Уро-Ваксом
В ФГБУ «НИИ урологии» Минздравсоцразвития России в 2010–2012 гг. проведено открытое постмаркетинговое клиническое исследование (IV фаза) по применению препарата Уро-Ваксом у пациенток с хроническим рецидивирующим бактериальным циститом.В ходе испытания были изучены эффективность, безопасность и переносимость Уро-Ваксома, оценено его влияние на выраженность бактериурии, число рецидивов цистита в год, а также на выраженность клинических симптомов заболевания до и после лечения. В качестве контрольных параметров использовали данные, полученные в течение года наблюдения за пациентками до начала применения Уро-Ваксома. Результаты исследования были сведены в электронную базу и обрабатывались с помощью пакета статистических программ «Статистика». Различия по количественным показателям оценивали с помощью непараметрического критерия Уилкоксона. В качестве критерия статистической значимости различий принималась вероятность ошибки p < 0,05. Отбор пациенток производился в поликлиническом отделении ФГБУ «НИИ урологии» Минздравсоцразвития России.В исследование было включено 90 пациенток с хроническим рецидивирующим бактериальным циститом (> 4 обострений в год) в возрасте от 18 до 67 лет (в среднем 42,59 года).
Длительность исследования составила 33 месяца: период наблюдения за больными в течение 12 месяцев до курса лечения препаратом УроВаксом; 9 месяцев – период лечения – и 12 месяцев после его окончания. Все пациентки, включенные в исследование, получали препарат Уро-Ваксом в дозе 6 мг (1 капсула) 1 р/сут утром на протяжении трех месяцев. Далее следовал трехмесячный перерыв в приеме препарата, после чего курс лечения возобновлялся, и пациентки получали Уро-Ваксом еще в течение трех месяцев, по 10 дней в месяц. Полный курс лечения составил 9 месяцев. Клинические, клинико-лабораторные, биохимические исследования включали: врачебный осмотр урологом с обязательным влагалищным исследованием, клинические анализы крови и мочи, микроскопические исследования мазков из уретры, влагалища и шейки матки (для исключения вагинитов и вагинозов), бактериологическое исследование мочи. Заболевания, передаваемые половым путем (микоплазмы, вирус простого герпеса, хламидии), исключали с помощью ПЦР-диагностики. Все исследования проводились на этапе включения пациенток в группу наблюдения, а также через 3, 6 и 9 месяцев лечения Уро-Ваксомом. Через 1 год после завершения лечения препаратом Уро-Ваксом проводился телефонный опрос участниц испытания. Лечение Уро-Ваксомом в качестве монотерапии получили 49 пациенток. 41 женщине проводилась комбинированная терапия Уро-Ваксомом и антибиотиками, которые назначались короткими курсами при обострениях цистита. Препаратами выбора являлись: фосфомицина трометамол 3 г однократно, норфлоксацин по 400 мг 2 раза в день в течение 3–7 дней, фуразидина калиевая соль по 50–100 мг 3 р/сут в течение 7 дней и цефиксим по 400 мг 1 р/сут в течение 7 дней. Ни одна из пациенток из исследования исключена не была.
Результаты и обсуждение
При изучении анамнеза было установлено, что средняя длительность заболевания до включения пациенток в группу наблюдения составила 5,3 ± 2,4 года, средний возраст начала заболевания – 37,1 ± 18,2 года. До включения в исследование все пациентки страдали от рецидивов цистита с разной периодичностью, при этом среднее количество рецидивов в течение года составило 10,96 ± 7,3. За 9 месяцев лечения препаратом Уро-Ваксом у пациенток было зарегистрировано в среднем по 3,26 ± 2,1 эпизода обострения цистита. Однако в течение 12 месяцев наблюдения после отмены препарата, с подведением окончательных итогов и учетом данных телефонного интервью, на каждую больную в среднем пришлось по 3,97 ± 3,2 обострений за год. При анализе результатов применения Уро-Ваксома было отмечено, что через 3, 6 и 9 месяцев лечения лейкоцитурия статистически значимо снижалась (с 46,7% до лечения до 26,7%; 16,7% и 1,1% соответственно).
У 39 пациенток (43,3%) до лечения была выявлена бактериурия. Основным возбудителем рецидивирующей ИМП была E. coli (77%), далее следовали Enterococcus faecalis (7,9%), Klebsiella pneumoniaе (6,2%), Proteus mirabilis (3%) и др.Через 3 месяца лечения частота выявления бактериурии снизилась до 35,6%, через 6 месяцев – до 30,0% и через 9 месяцев – до 15,6%.Побочных реакций на фоне применения препарата Уро-Ваксом отмечено не было. Таким образом, наш опыт применения Уро-Ваксома у женщин с рецидивирующим бактериальным циститом доказал его клиническую эффективность (в том числе для профилактики рецидивов) и безопасность.
Заключение
Эффективность применения препарата Уро-Ваксом для снижения частоты рецидивов ИМП доказана в клинических исследованиях и на практике. Снижение частоты и длительности применения антибиотиков и благоприятный профиль безопасности препарата делают его использование для профилактики и лечения рецидивирующих ИМП весьма перспективным. Особый интерес представляет также изучение целесообразности применения Уро-Ваксома в сочетании с антибиотиками при остром бактериальном цистите для предотвращения хронизации процесса и персистенции возбудителей.
1. Roos V., Ulett G.C., Schembri M.A., Klemm P. The asymptomatic bacteriuria Escherichia coli strain 83972 outcompetes uropathogenic E. coli strains in human urine // Infect. Immun. 2006. Vol. 74. № 1. P. 615–624.
2. Hedlund M., Duan R.D., Nilsson A. et al. Fimbriae, transmembrane signaling, and cell activation // J. Infect. Dis. 2001. Vol. 183. Suppl. 1. P. S47–S50.
3. Перепанова Т.С., Козлов Р.С., Дехнич А.В. и др. Выбор антимикробных препаратов при инфекции мочевых путей // Урология. 2012. № 2. С. 4–8.
4. Российские национальные рекомендации «Антимикробная терапия и профилактика инфекций почек, мочевыводящих путей и мужских половых органов» / под ред. Н.А. Лопаткина, О.И. Аполихина, Д.Ю. Пушкаря, А.А. Камалова, Т.С. Перепановой. М., 2012. С. 35–36.
5. Gupta K., Hooton T.M., Naber K.G. et al. International clinical practice guidelines for the treatment of acute uncomplicated cystitis and pyelonephritis in women: a 2010 update by the Infectious Diseases Society of America and the European Society for Microbiology and Infectious Diseases // Clin. Infect. Dis. 2011. Vol. 52. № 5. P. e103–е120.
6. Grabe M., Bishop M.C., Bjerklund-Johansen T.E. et al. Guidelines on on the management of urinary and male genital tract infections / European Association of Urology. 2008. 116 p.
7. Маркушин С.Г., Переверзев А.Д., Ахматова Н.К. Изучение иммунного ответа мышей, иммунизированных интраназально живой гриппозной холодоадаптированной вакциной в комбинации с производными хитозана в качестве адъювантов // Российский иммунологический журнал. 2011. Т. 5. № 3–4. С. 233– 243.
8. Gilbart J. Recurrent uncomplicated urinary tract infections: the place of immuno-prophylaxis // Eur. Urol. Rev. 2011. Vol. 6. Is. 2. P. 114–119.
9. Grabe M., Bjerklund-Johansen T.E., Botto H. Guidelines on Urogenital infections // European Association of Urology. 2010. 993 p.
10. Cerutti A., Chen K., Chorny A. Immunoglobulin responses at the mucosal interface // Ann. Rev. Immunol. 2011. Vol. 29. P. 273–293.
11. Nielubowicz G.R., Mobley H.L. Host-pathogen interactions in urinary tract infection // Nat. Rev. Urol. 2010. Vol. 7. № 8. P. 430–441.
12. Song J., Abraham S.N. TLR-mediated immune responses in the urinary tract // Curr. Opin. Microbiol. 2008. Vol. 11. № 1. P. 66–73.
13. Bessler W.G., vor dem Esche U., Zgaga-Griesz A., Ataullakhanov R. et al. Immunostimulatory properties of the bacterial extract OM-89 in vitro and in vivo // Arzneimittelforschung. 2010. Vol. 60. № 6. P. 324–329.
14. Schmidhammer S., Ramoner R., Holtl L. et al. An Escherichia coli-based oral vaccine against urinary tract infections potently activates human dendritic cells // Urology. 2002. Vol. 60. № 3. P. 521–526.
15. Marchant A., Duchow J., Goldman M. Adhesion molecules in antibacterial defenses: effects of bacterial extracts // Respiration. 1992. Vol. 59. Suppl. 3. P. 24–27.
16. Bessler W.G., Puce K., vor dem Esche U. et al. Immunomodulating effects of OM-89, a bacterial extract from Escherichia coli, in murine and human leukocytes // Arzneimittelforschung. 2009. Vol. 59. № 11. P. 571–577.
17. Huber M., Krauter K., Winkelmann G. et al. Immunostimulation by bacterial components: II. Efficacy studies and metaanalysis of the bacterial extract OM-89 // Int. J. Immunopharmacol. 2000. Vol. 22. № 12. P. 1103–1111.
18. Sunden F., Hakansson L., Ljunggren E., Wullt B. Escherichia coli 83972 bacteriuria protects against recurrent lower urinary tract infections in patients with incomplete bladder emptying // J. Urol. 2010. Vol. 184. № 1. P. 179–185.
19. Huber M., Baier W., Serr A., Bessler W.G. Immunogenicity of an E. coli extract after oral or intraperitoneal administration: induction of antibodies against pathogenic bacterial strains // Int. J. Immunopharmacol. 2000. Vol. 22. № 1. P. 57–68.
20. Bessler W.G., vor dem Esche U., Zgaga-Griesz A., Ataullakhanov R. Immunostimulatory properties of the bacterial extract OM-89 in vitro and in vivo // Arzneimittelforschung. 2010. Vol. 60. № 6. P. 324–329.
21. Naber K.G., Cho Y.H., Matsumoto T., Schaeffer A.J. Immunoactive prophylaxis of recurrent urinary tract infections: a metaanalysis // Int. J. Antimicrob. Agents. 2009. Vol. 33. № 2. P. 111–119.
22. Frey C., Obolensky W., Wyss H. Treatment of recurrent urinary tract infections: efficacy of an orally administered biological response modifier // Urol. Int. 1986. Vol. 41. № 6. P. 444–446.
23. Tammen H. Immunobiotherapy with Uro-Vaxom in recurrent urinary tract infection. The German Urinary Tract Infection Study Group // Br. J. Urol. 1990. Vol. 65. № 1. P. 6–9.
24. Schulman C.C., Corbusier A., Michiels H., Taenzer H.J. Oral immunotherapy of recurrent urinary tract infections: a double-blind placebocontrolled multicenter study // J. Urol. 1993. Vol. 150. № 3. P. 917–921.
25. Magasi P., Panovics J., Illes A., Nagy M. Uro-Vaxom and the management of recurrent urinary tract infection in adults: a randomized multicenter double-blind trial // Eur. Urol. 1994. Vol. 26. № 2. P. 137–140.
26. Bauer H.W., Alloussi S., Egger G. et al. A long-term, multicenter, double- blind study of an Escherichia coli extract (OM-89) in female patients with recurrent urinary tract infections // Eur. Urol. 2005. Vol. 47. № 4. P. 542–548.
Новости на тему
28.12.2023
Отправить статью по электронной почте
Ваш адрес электронной почты:
Вследствие невысокой эффективности антибактериального лечения в статье обосновывается возможность проведения иммунопрофилактики рецидивирующих инфекций мочевых путей (ИМП) на примере препарата Уро-Ваксом.
Уро-Ваксом – единственный препарат, не относящийся к антибиотикам, который рекомендован Европейской урологической ассоциацией для иммунопрофилактики рецидивов ИМП. Полученные в клинических исследованиях данные свидетельствуют, что Уро-Ваксом стимулирует как врожденный, так и приобретенный иммунный ответ.
Клиническая эффективность (в том числе для профилактики рецидивов) и безопасность препарата были подтверждены в исследовании, проведенном на базе ФГБУ «НИИ урологии» Минздравсоцразвития России, с участием 90 женщин с рецидивирующим бактериальным циститом.
" id="sender_art_description" name = "SENDER_ART_DESCRIPTION" />
Адрес электронной почты получателя:
Разделите несколько адресов электронной почты запятой
Сообщение(не обязательно)
Не более 1500 символов
Анти спам:
Для предотвращения спама, пожалуйста, введите в поле слово, которое видите ниже.
Обновить код
* адреса предоставленные Вами будут использоваться только для отправки электронной почты.
