Оценка эффективности введения ботулинического токсина типа А детям с нейрогенным мочевым пузырем на фоне миелодисплазии
- Аннотация
- Статья
- Ссылки
- English
На фоне лечения была получена положительная динамика в виде улучшения уродинамических показателей, увеличения «сухих» промежутков или отсутствия эпизодов недержания мочи, снижения объема упускаемой мочи, восстановления эффективного объема мочевого пузыря, улучшения показателя гиперактивности детрузора, уменьшения количества эпизодов инфекции мочевыводящих путей. Результаты проведенного исследования показали высокую эффективность внутридетрузорного введения БТА: у 63,6% пациентов с НМП достигнут положительный результат лечения.
На фоне лечения была получена положительная динамика в виде улучшения уродинамических показателей, увеличения «сухих» промежутков или отсутствия эпизодов недержания мочи, снижения объема упускаемой мочи, восстановления эффективного объема мочевого пузыря, улучшения показателя гиперактивности детрузора, уменьшения количества эпизодов инфекции мочевыводящих путей. Результаты проведенного исследования показали высокую эффективность внутридетрузорного введения БТА: у 63,6% пациентов с НМП достигнут положительный результат лечения.
Введение
Необходимость нормализации уродинамики у детей с нейрогенным мочевым пузырем (НМП) на фоне миелодисплазии обусловлена риском развития вторичных изменений верхних мочевыводящих путей и формирования хронической болезни почек [1, 2]. Нарушения мочеиспускания вследствие нейрогенной дисфункции мочевого пузыря на фоне миелодисплазии практически всегда сопровождаются проблемами с эвакуацией мочи. У детей с данной патологией часто отмечаются хроническая задержка мочи и инфекции мочевыводящих путей. Также в связи с резким повышением внутрипузырного давления и тонуса детрузора высока вероятность развития таких осложнений, как пузырно-мочеточниковый рефлюкс (ПМР) или мегауретер [1, 3].
Несмотря на то что комбинация интермиттирующей катетеризации и приема М-холиноблокаторов является золотым стандартом ведения таких детей, она не всегда обеспечивает нормализацию уродинамических показателей [4, 5]. Внутридетрузорное введение препаратов ботулинического токсина типа А (БТА) является альтернативой лекарственной терапии, особенно у пациентов с побочными эффектами или невосприимчивых к традиционной медикаментозной терапии. БТА вызывает продолжительную, но обратимую химическую денервацию детрузора, блокируя высвобождение нейромедиатора ацетилхолина в нервно-мышечных соединениях, обусловливая улучшение уродинамических параметров вследствие повышения растяжимости, цистометрической емкости мочевого пузыря, снижения внутрипузырного давления и гиперактивности детрузора [6].
Основной целью исследования является оценка эффективности внутридетрузорного введения БТА детям с НМП на фоне миелодисплазии, резистентных к традиционной медикаментозной терапии и находящихся на режиме интермиттирующих катетеризаций.
Материал и методы
На базе урологического отделения Национального медицинского исследовательского центра здоровья детей в группах репродуктологии и трансплантации проведено одноцентровое экспериментальное неконтролируемое исследование за 2022 и 2023 гг. Показанием для оперативного лечения у всех пациентов явилась неэффективность медикаментозной терапии. От всех родителей/законных представителей пациентов получено информированное согласие на включение каждого ребенка в программу обследования, обработку результатов лечения и публикацию материалов.
Критерии включения:
- пациенты в возрасте от двух до 18 лет;
- подтвержденный диагноз миелодисплазии;
- низкая комплаентность мочевого пузыря к медикаментозной терапии;
- повышенное внутрипузырное давление и тонус детрузора по данным уродинамического исследования.
Инструментальное обследование состояло из микционной цистоуретерографии, ультразвукового исследования почек и мочевого пузыря, допплерографии почек, цистометрии. Лабораторный контроль включал в себя клинический и биохимический анализ крови с определением скорости клубочковой фильтрации, клинический анализ мочи, микробиологический посев мочи с определением чувствительности микрофлоры к антибактериальным препаратам.
Критерии исключения:
- активное течение инфекции мочевыводящих путей;
- тяжелые, угрожающие жизни и терминальные состояния пациента;
- отказ пациента и/или его родителей.
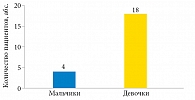
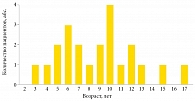
Представлены результаты лечения 22 детей (медиана возраста – 8 лет 11 месяцев) с диагнозом «нейрогенный неадаптированный арефлекторный, гипертоничный мочевой пузырь», которым было выполнено внутридетрузорное введение БТА: 4 (18,1%) мальчиков и 18 (81,8%) девочек (рис. 1). В возрасте от двух до восьми лет было 10 детей, от 9 до 13 лет – 10 детей, от 14 до 17 лет – двое детей (рис. 2).
У всех обследованных детей с НМП диагностирована миелодисплазия как первопричина заболевания [7]. Причинами дисфункции мочевого пузыря являлись спинномозговая грыжа, также были отмечены: сакральная дисплазия у 2 (9%) детей, синдром каудальной регрессии у 5 (22,7%) детей, фиксация спинного мозга интраканальными образованиями у 2 (9%) детей, другие пороки развития центральной нервной системы у 14 (63,7%) детей. Также у всех детей отмечалось отставание в моторном развитии и различные нейроортопедические проблемы.
У 9 (40,9%) больных по результатам рентгенурологического обследования диагностирован ПМР: у шести – односторонний, у трех – двусторонний. В четырех случаях отмечен ПМР I–II степени, в пяти случаях – III–IV степени.
Все пациенты ранее получали медикаментозную терапию в объеме М-холиноблокаторов с целью нормализации давления и восстановления объема мочевого пузыря. У 7 (31,8%) пациентов отмечались побочные эффекты (тахикардия, возбуждение, головная боль, расстройства сна, усиление запоров, когнитивные расстройства, повышение температуры тела). У остальных 15 (68,2%) пациентов терапия не имела положительного эффекта. Все обследуемые дети находились на режиме интермиттирующих катетеризаций. У 7 (31,8%) больных отмечалось подтекание мочи между катетеризациями. Наряду с расстройством акта мочеиспускания у всех детей были отмечены хронический толстокишечный стаз, энкопрез.
Результаты лечения оценивали через шесть месяцев, всем детям проводили инструментальный и лабораторный контроль. Критериями положительного результата являлись улучшение уродинамических показателей, увеличение «сухих» промежутков или отсутствие эпизодов недержания мочи, снижение объема упускаемой мочи, восстановление эффективного объема мочевого пузыря, уменьшение количества эпизодов инфекции мочевыводящих путей. Неудовлетворительным результатом считалось отсутствие улучшений в уродинамическом статусе ребенка после введения БТА.
Процедуру проводили в условиях общей анестезии с интраоперационной антибиотикопрофилактикой. В нашей практике мы использовали операционный цистоскоп с рабочим каналом и цистоскопической иглой 0,6 мм. Существует несколько схем внутридетрузорного введения БТА: деление инъекции на ряды (по всему мочевому пузырю, но преимущественно в заднюю стенку), другим способом является разделение мочевого пузыря на квадранты. В нашем центре используется введение БТА по границе треугольника Льето, далее веерно по задней стенке мочевого пузыря. Мы рекомендуем устанавливать катетер Фолея всем пациентам на сутки после операции для контроля диуреза и возможных осложнений [1, 8].
Рекомендуется разводить ботулинический токсин с изотоническим раствором в дозировке 200–300 единиц, то есть 10 единиц на 1 мл, а затем вводить небольшими порциями непосредственно в мышцу стенки мочевого пузыря до 20–30 участков по 1 мл на участок [9–15]. Y.H. Jiang и соавт. отметили, что эффективным может являться поднятие подслизистого слоя мочевого пузыря или ограничение инъекции мышцей детрузора [12 , 16].
Эффект от введения препарата БТА обычно длится шесть – девять месяцев, и в настоящее время имеются доказательства сохранения его эффективности при повторных инъекциях. J.L. Chen сообщили о 20 пациентах, которым сделали как минимум четыре инъекции, и предоставили клинические и уродинамические доказательства сохранения эффективности в течение более трех лет [17].
Результаты
В исследовании приняли участие 22 ребенка от двух до 17 лет (M = 8 лет 11 месяцев): 4 (18,1%) мальчика и 18 (81,8%) девочек с последующим наблюдением через шесть месяцев. Включены 10 детей в возрасте от 2 до 8 лет, 10 детей от 9 до 13 лет и 2 детей от 14 до 17 лет.
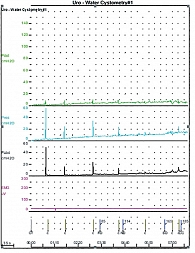
Внутридетрузорное введение БТА позволило достичь положительного результата у 64% пациентов. У 9 (40,9%) детей получена положительная динамика в виде увеличения «сухих» промежутков, снижения объема упускаемой мочи. У 13 (59%) детей отмечено улучшение уродинамических параметров при проведении контрольной цистометрии (рис. 3) [18, 19]. Улучшение показателя гиперактивности детрузора было отмечено как у клинически ответивших, так и у не ответивших на терапию пациентов.
Внутридетрузорное введение БТА способствовало нормализации объема мочевого пузыря у 14 из 22 детей (63,6%) и улучшению адаптации мочевого пузыря в шести случаях. Положительный результат с полным контролем над удержанием мочи после введения БТА получен у одного мальчика и двух девочек (13,5%).
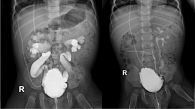
По результатам микционной цистоуретрографии через шесть месяцев после выполнения эндоскопической коррекции рефлюкса объемообразующим имплантом совместно с введением БТА отмечено улучшение у 4 из 9 детей (44,4%), отсутствие динамики – у 1 (11,1%) ребенка (рис. 4). Также необходимо отметить, что положительная динамика в виде уменьшения количества эпизодов инфекций мочевыводящих путей выявлена у 11 (50%) детей.
После оперативного вмешательства могут наблюдаться осложнения [8, 9, 16, 20]. К ним относятся возникновение инфекций мочевыводящих путей, гематома в месте инъекции, кровотечение. В нашем исследовании было отмечено три осложнения класса II по классификации Clavien – Dindo: один случай обострения хронического пиелонефрита, вследствие чего была назначена антибактериальная терапия, и два случая гематурии, которые были купированы применением гемостатического лекарственного препарата. На фоне лечения у детей получена положительная динамика.
Обсуждение
В лечении нейрогенной дисфункции мочевого пузыря помимо комбинации интермиттирующей катетеризации и приема М-холиноблокаторов используют эпидуральные, пресакральные блокады и физиотерапию [21]. Внутридетрузорное введение БТА выступает в качестве альтернативного лечения при недостаточной эффективности и невозможности восстановления объема мочевого пузыря.
Ботулинотерапия является малоинвазивным и безопасным методом лечения тяжелых форм недержания мочи у резистентных к традиционной медикаментозной терапии детей. Ботулинический токсин типа А активно применяется в детской хирургической практике при выраженном недержании мочи, снижении комплаентности мочевого пузыря, повышенном внутрипузырном давлении и тонусе детрузора, поллакиурии. По данным литературы, эффективность введения БТА у детей с нейрогенной дисфункцией составляет 55–81%, что совпадает с результатами, полученными в нашем центре [9, 22–27].
Наш опыт свидетельствует, что для эффективного лечения тяжелых форм нейрогенных нарушений функции мочевого пузыря у детей необходимо проводить полное обследование, включающее комплексное урологическое исследование, а также консультацию специалистов: невролога, гастроэнтеролога, физиотерапевта, нефролога и др. Подход к пациентам должен быть персонализирован с учетом сопутствующих патологий, а тактика ведения обсуждена между лечащими врачами разных нозологий.
Заключение
Результаты представленного исследования продемонстрировали высокую эффективность внутридетрузорного введения БТА, в том числе у детей с ПМР. Данная методика может быть рекомендована к применению у детей с НМП с резистентностью к традиционной медикаментозной терапии, а также рассматриваться как альтернатива аугментационной цистопластике, сфинктеропластике и везикостомии.
S.N. Zorkin, PhD, Prof., E.V. Sibirskaya, PhD, Prof., A.A. Romashova, S.A. Borisova, PhD, A.T. Galuzinskaia, PhD, T.S. Panasenko
National Medical Research Center for Children's Health, Moscow
Pirogov Russian National Research Medical University, Moscow
Russian Children's Clinical Hospital branch of Pirogov Russian National Research Medical University, Moscow
Russian University of Medicine, Moscow
Contact person: Anastasia A. Romashova, anastasi_romashova@mail.ru
The need to normalize urodynamics in children with neurogenic bladder (NBP) on the background of myelodysplasia is due to the risk of developing secondary changes in the upper urinary tract and the formation of chronic kidney disease. The combination of intermittent catheterization and administration of M-choline blockers is the "gold standard" of management of such children, but does not always provide normalization of urodynamic parameters. In pediatric urologic practice botulinum toxin type A (BTA) is actively used in patients resistant to conventional drug therapy. The aim of the study is to evaluate the efficacy of intradetrusor administration of BTA in children with neurogenic spinal bladder, resistant to conventional drug therapy and undergoing intermittent catheterization. This study presents the outcomes of 22 children for 2022 and 2023 diagnosed with NSB on a background of myelodysplasia who underwent intradetrusor injection of BTA with follow-up after 6 months. Successful outcome was considered to be an increase in bladder volume, decrease in intravesical pressure and increase in "dry" intervals between catheterizations. Lack of improvement according to urodynamic examination after BTA administration was considered an unsatisfactory result.
Against the background of treatment, positive dynamics was obtained in the form of improvement of urodynamic parameters, increase in "dry" intervals or absence of episodes of urinary incontinence, decrease in the volume of urine missed, restoration of effective bladder volume, improvement of detrusor hyperactivity index, decrease in the number of episodes of urinary tract infection. The study showed high efficacy of intradetrusor injection of BTA: 63.6% of patients with UIU achieved a positive result of treatment.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.