количество статей
7261
Загрузка...
Пожалуйста, авторизуйтесь:
Медицинский форум
Актуальные вопросы детской гастроэнтерологии
"ЭФФЕКТИВНАЯ ФАРМАКОТЕРАПИЯ. Педиатрия" № 3 (21)
- Аннотация
- Статья
- Ссылки
Функциональные гастроинтестинальные нарушения занимают одно из ведущих мест в структуре заболеваний органов пищеварения в детском возрасте. Наиболее часто они встречаются в первый год жизни ребенка. Характерной особенностью гастроэнтерологической патологии в детском возрасте является ее психосоматическая обусловленность. Проблемы диагностики, профилактики и терапии функциональных нарушений желудочно-кишечного тракта обсуждали ведущие педиатры страны в ходе симпозиума «Актуальные вопросы детской гастроэнтерологии», организованного при поддержке ОАО «ПРОГРЕСС» (Москва, 14 февраля 2014 г.).

Профессор П.В. Шумилов
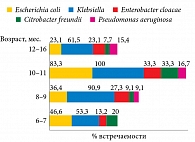
Рис. 1. Возрастная динамика условно патогенной микрофлоры при естественном вскармливании
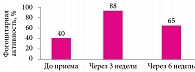
Рис. 2. Влияние пробиотиков на иммунитет

Профессор М.И. Дубровская

Профессор Ю.Г. Мухина
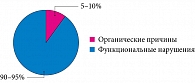
Рис. 3. Структура хронической абдоминальной боли у детей
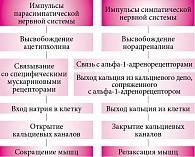
Рис. 4. Сбалансированное действие симпатической и парасимпатической нервной системы
Особенности микробиома при функциональных нарушениях желудочно-кишечного тракта у детей
В начале своего выступления д.м.н., профессор, заведующий кафедрой госпитальной педиатрии № 1 педиатрического факультета Российского национального исследовательского медицинского университета им. Н.И. Пирогова (РНИМУ им. Н.И. Пирогова) Петр Валентинович ШУМИЛОВ отметил, что в последние годы в научных исследованиях все чаще поднимается вопрос о том, насколько важен состав кишечной микробиоты для нормального функционирования организма. Сегодня уже не подвергается сомнению тот факт, что состояние микробиоты во многом определяет здоровье человека.
Кишечная микробиота начинает заселять кишечник ребенка сразу после рождения. Колонизация желудочно-кишечного тракта (ЖКТ) новорожденного микрофлорой происходит в несколько этапов. На первом этапе (1-е сутки жизни) в течение нескольких часов кишечник ребенка заселяется смешанной микрофлорой (аэробы, преимущественно кокки, энтеробактерии, дрожжи и др.), в состав которой входят как полезные, так и условно патогенные микроорганизмы. В ЖКТ новорожденного развивается транзиторный дисбактериоз. На втором этапе (к 3–4-м суткам жизни) при условии полноценного грудного вскармливания формируется нормальная кишечная микрофлора: лактобактерии (108 КОЕ/г), стафилококки и стрептококки (107 КОЕ/г), кишечные палочки (107 КОЕ/г). Из-за дефицита местного иммунитета на этом этапе могут развиваться любые слабовирулентные микроорганизмы. На третьем этапе (6-е сутки) происходит трансформация кишечного биоценоза ребенка. Определяется значимый титр бифидо- и лактобактерий (108–109 КОЕ/г и 109 КОЕ/г соответственно), что характеризует нормальное становление функции кишечника и иммунологической резистентности. Однако в этот период начинают выявляться в больших количествах клостридии, бактероиды, анаэробные кокки, составляющие до 80% всей нормальной микрофлоры организма взрослого человека.
Микрофлора кишечника младенца формируется под воздействием различных факторов. Это способ родоразрешения (естественные роды или при помощи кесарева сечения), гестационный возраст, вид вскармливания (грудное, смешанное, искусственное), вес ребенка, характер питания матери, окружающая среда. Дети, которые получают только грудное молоко и в кишечнике которых преобладают бифидобактерии, полезные для пищеварения, быстрее адаптируются к условиям внешней среды. В кишечнике детей, находящихся на искусственном вскармливании, присутствуют как бифидобактерии, так и условно патогенная микрофлора. У недоношенных детей нарушается нормальное становление биоценоза в раннем периоде, преобладают стафилококки и Clostridium difficile, особенно в случае применения антибиотиков. Антибиотикотерапия индуцирует быстрые изменения в кишечной микрофлоре, снижение бактериального разнообразия и увеличение количества спорообразующих клостридий в микробиоте кишечника.
Кроме того, нарушение санитарно-гигиенических условий при уходе за ребенком способствует ранней колонизации представителями семейства Enterobacteriaceae. Ранняя госпитализация является неблагоприятным фактором для формирования микробиома кишечника ребенка, поскольку в этом случае снижается содержание грамотрицательных анаэробов Bacteroides, Prevotella и бифидобактерий.
Соотношение между полезной и условно патогенной микрофлорой меняется и может вызвать нарушения в организме новорожденного.
Особенности микробиоты детей раннего возраста напрямую зависят от состояния микробиоты матери. Основным источником бактерий для новорожденного является вагинальная, кишечная и кожная микрофлора матери, которая попадает в организм ребенка при прохождении родовых путей и первых контактах.
Следует отметить, что условно патогенная микрофлора кишечника присутствует в норме у всех нормально развивающихся детей. В отсутствие клинической симптоматики наличие патогенных бактерий не считается патологическим состоянием. Так, присутствие Staphylococcus aureus в кишечнике является нормой для здоровых детей первого года жизни (30–60%), бактерии рода Klebsiella определяются у 100%. Грибы рода Candida (до 104–106 КОЕ/г) выделяются у 40% здоровых детей, после первого года уровень штамма постепенно снижается. До трех лет основная микрофлора кишечника у детей представлена бифидобактериями (40–60%). После введения прикорма происходит активный рост анаэробной микрофлоры, в частности бактероидов, лецитиназопозитивных клостридий (Clostridium perfringens) у 30–40% детей первого года и лецитиназонегативных клостридий у 45% детей в возрасте одного месяца. Кишечная микробиота динамически изменяется у детей раннего возраста, а к пяти годам стабилизируется и соответствует микробиоте взрослых (рис. 1).
Состав микробиоты кишечника напрямую связан с характером питания. Вероятно, эволюция микробиоты происходила в соответствии с пищевыми потребностями и особенностями диеты человека. Так, у людей, проживающих в разных регионах, состав микрофлоры различен. Например, у европейских детей доминируют фирмикуты, а состав микробиоты не такой разнообразный, как у африканцев, у которых преобладают бактероиды. Бактероиды способны ферментировать растительные полисахариды с образованием летучих жирных кислот, которые легко усваиваются организмом человека и необходимы тем, кто питается в основном растительной пищей1.
У взрослых выделяют три энтеротипа кишечного микробиома: Bacterjides, Prevotella и Ruminococcus. Однако количество этих типов уточняется2. «Значение нормальной микрофлоры для организма человека чрезвычайно велико, – отметил профессор П.В. Шумилов. – Так, в ЖКТ она способствует развитию кишечного эпителия, формированию крипт, интестинальному ангиогенезу. Нормальный микробиом кишечника влияет на пролиферацию и дифференциацию эпителия, созревание нервной системы кишечника».
Микробиота выполняет три функции – метаболическую, защитную и иммунную. Метаболическая заключается в синтезе эссенциальных нутриентов – витаминов группы В (тиамина, рибофлавина, пиридоксина, цианкобаламина, фолиевой, пантотеновой и никотиновой кислот), биотина, витамина K и в метаболизации гормонов и канцерогенных веществ. Естественная аутофлора кишечника тормозит процессы декарбоксилирования пищевого гистидина, уменьшает синтез гистамина и снижает риск пищевой аллергии у детей.
Защитная функция кишечной микробиоты проявляется прежде всего в формировании колонизационной резистентности по отношению к потенциально болезнетворным микроорганизмам за счет образования бактериостатических низкомолекулярных метаболитов (например, короткоцепочечных жирных кислот (КЦЖК), оксида азота, глутамата, гистамина), деградации бактериальных токсинов, деконъюгации желчных кислот, продукции широкого спектра антимикробных веществ семейства бактерицинов.
Иммуномодулирующая функция осуществляется по отношению к неспецифическим факторам защиты и собственно адаптивному иммунному ответу. За счет микробиоты происходит запуск и последующая активация синтеза неспецифических факторов защиты, как гуморальных (лизоцим, пропердин, комплемент), так и клеточных (фагоцитоз). Воздействие на иммунитет подразумевает стимуляцию созревания лимфоидного аппарата кишечника, активацию синтеза секреторного иммуноглобулина класса A и стимуляцию продукции цитокинов колоноцитами.
Формирование адаптивного иммунитета у ребенка начинается в период ранней микробной колонизации кишечника. Особая роль в этом процессе принадлежит именно нормальной микрофлоре.
Роль микробиоты в формировании функциональных нарушений ЖКТ, в том числе синдрома раздраженного кишечника, хорошо изучена. Под действием изменения состава микробиоты развивается локальное субклиническое воспаление, приводящее к активации неспецифического звена иммунной системы. Как следствие – повышение кишечной проницаемости, активация ноцицептивных сенсорных путей и дисрегуляция нервной системы кишечника. Говоря о функциональных нарушениях ЖКТ, подразумевают нарушение моторики кишечника, висцеральную гиперчувствительность, минимальное кишечное воспаление, дисфункцию в системе «центральная нервная система – кишечник».
Согласно последним данным риск возникновения функциональных нарушений со стороны ЖКТ повышается после перенесенной бактериальной кишечной инфекции, особенно после использования антибактериальной терапии3.
Профессор П.В. Шумилов отметил, что состояние микробиоты тесно связано с видом функциональных нарушений ЖКТ. Так, при функциональной диарее преобладают стрептококки и Escherichia coli, но наблюдается низкий уровень бифидо- и лактобактерий. Функциональные запоры характеризуются повышением уровня клостридий и бифидобактерий, снижением уровня лактобактерий. Риск развития запоров при искусственном вскармливании в 4,5 раза выше, чем при грудном4.
В решении задач, связанных с уровнем кишечной пробиоты в ЖКТ, трудно переоценить роль биологически активных субстанций – про- и пребиотиков. Пробиотики – это живые микроорганизмы, примененные в адекватных количествах и оказывающие оздоровительный эффект на организм человека. Они модулируют иммунный ответ, апоптоз и пролиферацию иммунных клеток через Толл-подобные рецепторы (Toll-like receptor, TLR), подавляя продукцию провоспалительных цитокинов и активность ядерного фактора каппа B (nuclear factor kappa B, NF-kB). Пробиотики восстанавливают барьерную функцию кишечника (рис. 2).
Пребиотики – неперевариваемые ингредиенты пищи, стимулирующие рост и метаболическую активность одной или нескольких групп нормальной микрофлоры толстого кишечника. К пребиотикам относятся инулин, галактоолигосахариды и лактулоза.
Таким образом, пробиотики и пребиотики препятствуют развитию воспалительного ответа в кишечнике.
Наиболее изученный природный пребиотик – инулин. Это природный полисахарид – полимер фруктозы, который способен в объеме 86% от введенной дозы достигать толстой кишки. Инулин активно проявляет пребиотические свойства, стимулирует иммунный ответ и повышает устойчивость организма к кишечным инфекциям.
В настоящее время при производстве пробиотических продуктов для детей используют два вида бактерий – Bifidobacterium и Lactobacillis spp., отличающихся безопасностью и эффективностью. Питание детей, основанное на пробиотиках, признано мягким способом коррекции нарушений микробиоты кишечника. В частности, биотворог «ФрутоНяня» (ОАО «ПРОГРЕСС») рекомендован детям раннего возраста. Закваска этого молочного продукта содержит пробиотические культуры (Bifidobacterium bifidum). Сухие каши «ФрутоНяня», обогащенные инулином, рекомендованы для детей старше пяти месяцев, жидкие молочные каши «ФрутоНяня» с инулином – для детей старше шести месяцев.
По словам профессора П.В. Шумилова, применение пробиотиков и пребиотиков в составе функционального питания – один из возможных способов профилактики функциональных нарушений ЖКТ.
Соматоформные расстройства желудочно-кишечного тракта у детей
Соматоформные расстройства (СФР) – повторяющееся возникновение физических симптомов, заставляющих предположить соматическое заболевание, которое не подтверждается данными медицинского обследования.
Мария Игоревна ДУБРОВСКАЯ, д.м.н., профессор кафедры госпитальной педиатрии № 1 педиатрического факультета РНИМУ им. Н.И. Пирогова, отметила, что частота СФР в России у взрослых составляет 40–68%, у детей – 25–40%5. Неврозы диагностируются у 1/4 больных соматическими заболеваниями, 1/3 больных, получающих медицинскую помощь, страдают первично от эмоциональных расстройств.
Выделяют несколько вариантов развития психосоматических заболеваний:
- ситуационный (первично-психогенный этиологический фактор);
- личностный (измененный вид психологического реагирования со становлением хронизированного эмоционального напряжения);
- психопатологический (при генотипических особенностях центрального аппарата эмоций);
- церебральный (при органическом, резидуально-органическом заболевании мозга);
- соматический (при дефектности регуляторных и исполнительных механизмов висцеральных систем различного происхождения).
Профессор М.И. Дубровская подчеркнула важность факторов риска возникновения СФР у детей. Особую роль играют психосоциальные факторы риска: неполная семья (16,6%), психоэмоциональные нагрузки (21%), посещение детских учреждений (25%), наличие сестер и братьев (37,5%). Велико значение и таких факторов риска, как патология воспитания (59,7%), нарушение системы «мать – дитя» (60%)6.
Разные стили воспитания (традиционный, детоцентрический, демократический) сказываются на психосоматическом здоровье ребенка.
Эмоциональное напряжение, постоянная неудовлетворенность, противоречивые чувства к близким вызывают у ребенка желание хотя бы на время подавить отрицательные эмоции, испытать чувство удовольствия. Это легко достигается патологическими привычными действиями, и, как следствие, формируются вредные привычки: сосание пальца, кусание ногтей (онихофагия), онанизм (мастурбация), болезненное стремление выдергивать или выщипывать волосы (трихотилломания), ритмическое раскачивание головой и туловищем (яктация)6. Они обеспечивают успокоение, засыпание, стимуляцию и стабилизацию базального эмоционального фона, психофизического тонуса. По наличию вышеописанных симптомов можно судить о невротизации ребенка.
По мнению докладчика, одно из наиболее частых проявлений психосоматической патологии – СФР ЖКТ. Соматоформные расстройства пищеварительной системы проявляются в виде нарушений аппетита (снижение или повышение), аэрофагии (икота, не связанная с приемом пищи), тошноты, рвоты, болей в животе, синдрома раздраженного кишечника, психогенной гиперальгезии (разлитой гиперестезии с ятрогенной фиксацией больного) и вегетативной пельвиопатии (жалобы на нестерпимую боль внизу живота с требованием срочной операции)7.
Тошнота – неприятное, болезненное субъективное ощущение, предшествующее рвоте или сопутствующее ей.
При патологии ЖКТ тошнота является следствием повышения интрадуоденального давления и характерна для заболеваний двенадцатиперстной кишки (дуоденит, гастродуоденит, язвенная болезнь). Однако тошнота соматоформного генеза не связана с погрешностями диеты, усиливается при ухудшении физического и психического состояния больных. У детей тошнота, так же как и рвота, может стать следствием крайней степени неприятия и страха. Синдром повторяющихся рвот (эмотивная рвота) встречается у детей 2–5 лет и характеризуется различной частотой (один раз в год или один раз в месяц), не зависит от приема пищи, не поддается диетотерапии. Приступы рвоты мало отражаются на общем самочувствии ребенка, могут сопровождаться повышением температуры тела, артериального давления, тахикардией, появлением болей в животе, головными болями, учащенной дефекацией. В анамнезе у детей с эмотивной рвотой может быть психотравмирующий фактор, непосредственно связанный с пищей.
Профессор М.И. Дубровская коснулась проблемы руминации у детей разных возрастов. Повторяющийся заброс пищи (непереваренной или частично переваренной) в просвет пищевода и ротовую полость без тошноты и позывов к рвоте возникает почти сразу после еды и продолжается в течение 1–2 часов. В раннем детском возрасте это является четким отражением нарушения связи «мать – дитя», у старших детей и подростков может быть проявлением гастроэзофагеального и дуоденогастроального рефлюксов с руминационными волнами8.
Профессор М.И. Дубровская кратко осветила проблему абдоминалгий у детей и подростков как проявления психосоматической патологии. Обычно дебют заболевания приходится на пубертатный период (11–13 лет). Детей с абдоминалгиями отличают высокий уровень личностной тревожности, депрессии. У них низкая самооценка по сравнению со здоровыми детьми. Часто развитие функциональных абдоминалгий тесно связано с тревожностью и депрессией у матери9.
Проблема терапии СФР пищеварительной системы в детском возрасте сложна ввиду разнообразия клинических проявлений, патогенетических механизмов развития болезни, нарушений в психосоциальном статусе. Тем не менее ряд причин, приводящих к возникновению болевых ощущений при функциональных нарушениях ЖКТ у детей, таких как нарушение перистальтики и тонуса гладкой мускулатуры, моторики, избыточное газообразование, можно устранить с помощью специальной диеты и ограничения сахаров, грубых пищевых волокон. Необходимо в пищевой рацион включать высококачественные продукты промышленного производства, способствующие облегчению симптомов нарушений ЖКТ у детей. К таким продуктам относятся продукты торговой марки «ФрутоНяня».
В производстве детского питания «ФрутоНяня» (ОАО «ПРОГРЕСС») не используются загустители, крахмал, мука, лимонный сок, консерванты, красители, генетически модифицированный организм (ГМО). В состав овощных пюре входят только овощи и небольшое количество очищенной воды. Кроме того, новая упаковка содействует развитию сенсорно-моторной сферы ребенка, мелкой моторики и координации.
Абдоминальный синдром
Абдоминальный синдром – один из наиболее частых и важных симптомов клинической гастроэнтерологии. Профессор кафедры госпитальной педиатрии № 1 педиатрического факультета РНИМУ им. Н.И. Пирогова, д.м.н. Юлия Григорьевна МУХИНА заметила, что абдоминальный болевой синдром является ведущим в клинике большинства заболеваний органов пищеварения. Именно поэтому изучение и решение данной проблемы сохраняет актуальность.
Абдоминальная боль – основная диагностическая и терапевтическая проблема гастроэнтерологии. Клинически выделяют два типа боли – острую и хроническую. Такое разделение чрезвычайно важно для понимания феномена боли. Острая и хроническая боль имеют разные физиологический смысл и клинические проявления, в их основе лежат различные патофизиологические механизмы, а для их купирования используются различные фармакологические и нефармакологические методы лечения.
Острая абдоминальная боль развивается быстро или реже постепенно и имеет небольшую продолжительность (минуты, редко несколько часов). Как правило, она связана с острыми процессами, такими как острый аппендицит, холецистит, панкреатит, мезаденит.
Для хронической боли характерно постепенное нарастание. Такая боль сохраняется или рецидивирует на протяжении недель и месяцев. Рецидивирующая абдоминальная боль – одна из наиболее частых проблем, с которыми сталкивается педиатр на амбулаторном приеме. Распространенность такой боли у детей составляет по разным данным около 10%. Причинами возникновения рецидивирующей абдоминальной боли у детей могут быть эндокринные, гематологические, гинекологические, неврологические заболевания, а также болезни сердца, соединительной ткани (рис. 3).
Среди гастроинтестинальных причин боли можно выделить анатомические дефекты (грыжи, удвоения, кисты желчного протока), потерю массы тела, гепатоспленамегалию, запоры, синдром раздраженного кишечника, воспалительные заболевания кишечника, паразитарные инфекции, муковисцидоз с мекониевым илеусом, отравления солями тяжелых металлов.
Профессор Ю.Г. Мухина подробно остановилась на патофизиологических механизмах развития боли и гипералгезии.
Первичная гипералгезия связана с местом повреждения тканей и возникает в ответ на раздражение сенсибилизированных в результате повреждения периферических ноцицепторов. Ноцицепторы становятся чувствительными за счет биологически активных веществ, высвобождаемых или синтезируемых в месте повреждения (серотонина, гистамина, нейроактивных пептидов, кининов). Далее в процесс вовлекаются ноцицепторы, которые в норме неактивны, но активируются вслед за тканевым повреждением. Вследствие такой активации увеличивается афферентная стимуляция нейронов заднего рога спинного мозга, что и становится причиной развития вторичной гипералгезии. Увеличенная афферентная стимуляция, поступающая от сенсибилизированных и активированных ноцицепторов, превышает болевой порог и за счет высвобождения возбуждающих аминокислот (глутаминовой и аспарагиновой) повышает возбудимость чувствительных нейронов заднего рога. В результате увеличения возбудимости чувствительных нейронов задних рогов спинного мозга, связанных с зоной иннервации поврежденного нерва, происходит сенсибилизация близлежащих интактных нейронов с расширением рецептивной зоны. Раздражение неповрежденных сенсорных волокон, которые иннервируют окружающие зону повреждения здоровые ткани, вызывает активацию вторично сенсибилизированных нейронов, что проявляется болью – вторичной гипералгезией.
Иногда боль возникает без раздражения ноцицепторов (центральная боль). Обычно это происходит при повреждении периферических нервов или отделов центральной нервной системы (ЦНС), участвующих в передаче ноцицептивной информации. При повреждении таламуса или на другом уровне спиноталамического тракта может появиться сильная спонтанная боль, хотя точно такое же прерывание ноцицептивного пути может предотвратить или ослабить болевые реакции на периферическое раздражение. Механизмы боли, возникающей после повреждения нервных структур, недостаточно выяснены. Но скорее всего такая боль зависит от изменений активности и реакций нейронов на более высоких уровнях ноцицептивной системы.
Вегетативная нервная система – часть нервной системы, регулирующая деятельность внутренних органов, желез внутренней и внешней секреции, кровеносных и лимфатических сосудов. Характерной особенностью вегетативной иннервации на уровне сегментарно-периферического отдела является наличие двух относительно самостоятельных систем – симпатической и парасимпатической. Именно их согласованная деятельность обеспечивает тонкую регуляцию функций внутренних органов и обмена веществ (рис. 4).
Механизм возникновения боли при функциональных заболеваниях ЖКТ единый. Он связан с нарушением тонуса и перистальтики гладкой мускулатуры и моторики, изменением чувствительности к ноцицептивным воздействиям, избыточным газообразованием. Возникновение боли может быть связано с влиянием эндогенных опиатов, увеличением концентрации серотонина, психоэмоциональным стрессом. На механизм возникновения боли могут влиять медиаторы воспаления (интерлейкин-1), негативно воздействующие на нервные рецепторы.
Из-за особенностей моторики дети раннего возраста склонны к функциональным нарушениям пищеварительного тракта. С этим связано формирование частых абдоминальных болей у большой группы детей. У недоношенных новорожденных слабо выражен моторный комплекс, не координирована моторика желудка и двенадцатиперстной кишки. У таких детей не сформирован механизм регуляции нижнего пищеводного сфинктера. Однако скорость перистальтики существенно не отличается от таковой доношенных новорожденных. Скорость передвижения перистальтической волны у всех доношенных детей в два раза меньше, чем у взрослых. Несмотря на то что особенности первичной и вторичной алгезий у доношенных и недоношенных детей мало изучены, имеются данные о более длительной реакции ЦНС у недоношенных новорожденных на болевые стимулы.
В группу риска по формированию функциональных нарушений ЖКТ на первом году жизни входят недоношенные дети, не получавшие грудного молока в первое кормление и находившиеся на полном парентеральном питании, а также дети с морфофункциональной незрелостью, подвергшиеся стрессам (хроническая внутриутробная и постнатальная гипоксия, асфиксия при родах, инфекции, поражения ЦНС).
Развитие функциональной боли в животе у детей зависит от висцеральной гиперчувствительности и психосоциального компонента. Висцеральная гиперчувствительность формируется под воздействием следующих факторов:
- нарушения гастроинтестинальной реактивности на физиологические стимулы (питание, гормоны, моторика);
- изменения кишечной микробиоты;
- развития патофизиологических реакций в форме воспаления.
Психосоциальный компонент включает в себя прежде всего тесную связь между психологическим состоянием матери и развитием болей в животе у ребенка. Дети с абдоминальной болью в дальнейшем не уверены в своих силах, не способны адекватно реагировать на стрессовые ситуации.
У детей раннего возраста часто наблюдаются колики. У детей с младенческими коликами впоследствии могут сформироваться более серьезные физиологические и психосоматические нарушения.
Значительное влияние на состояние моторики ЖКТ у детей и формирование абдоминальных болей оказывает микрофлора. Деятельность микроорганизмов, населяющих кишечник, приводит к увеличению объема каловых масс, газообразованию, снижению порога чувствительности миоцитов и др. Бактерии вырабатывают огромное количество веществ, воздействующих на моторику, в том числе КЦЖК. КЦЖК – одни из важнейших метаболитов кишечной микрофлоры, оказывающих как местное, так и системное влияние10.
В результате микробного метаболизма в толстой кишке образуются молочная кислота, КЦЖК, углекислый газ, водород, вода. Углекислый газ в большой степени преобразуется в ацетат, водород всасывается и выводится через легкие, а органические кислоты утилизируются макроорганизмом. Синтез КЦЖК является важным фактором колонизационной резистентности, обеспечивающим стабильность состава кишечной микрофлоры.
Большое значение в комплексной терапии функциональных расстройств имеет обеспеченность организма пребиотиками. Достаточное поступление пребиотиков в толстую кишку не только приводит к росту сапрофитной микрофлоры, но и влияет на ее метаболизм, способствуя синтезу КЦЖК.
Одним из важнейших факторов, определяющих жизнедеятельность и уровень здоровья ребенка, является питание. Рациональное питание детей первого года жизни – одно из важнейших условий, обеспечивающих гармоничный рост, оптимальное психомоторное и интеллектуальное развитие, устойчивость к воздействию инфекций и различных неблагоприятных факторов внешней среды.
Учитывая сказанное, для питания детей раннего возраста можно рекомендовать многокомпонентные гипоаллергенные овощные и фруктовые пюре «ФрутоНяня» (ОАО «ПРОГРЕСС»), полностью удовлетворяющие потребности ребенка в энергии и основных компонентах (белках, жирах, углеводах, минералах и микроэлементах, витаминах). Готовые густые каши «ФрутоНяня» с пребиотическим эффектом, содержащие до 40% зернового компонента, также показаны для качественного питания детей. Все продукты «ФрутоНяня» не содержат консервантов и красителей.
Заключение
Тесная взаимосвязь нервной системы, кишечника и микрофлоры определяет комплексный подход к лечению функциональных нарушений ЖКТ, который предполагает создание правильного психоэмоционального и пищевого режима. Благоприятная психологическая обстановка вокруг ребенка должна сочетаться с комплексным подходом к его питанию. Грудное молоко является оптимальным питанием для детей раннего возраста, однако в рацион детей раннего возраста необходимо постепенно вводить прикорм. Именно в этот период целесообразно использовать пробиотики и пребиотики. Употребление пищи с пребиотическими и пробиотическими свойствами способствует укреплению иммунной системы ребенка, формированию нормальной микробиоты, снижает риск заболеваний ЖКТ.
Для прикорма идеально подходят каши «ФрутоНяня», которые обогащены инулином – природным пребиотиком, оказывающим положительный эффект на эвакуаторную систему кишечника. Каши и пюре «ФрутоНяня» изготовлены по специальной технологии, позволяющей сохранить все полезные вещества. Они содержат витамины и микроэлементы – йод, цинк, железо. Продукты для детей торговой марки «ФрутоНяня» демонстрируют хорошую переносимость, улучшают пищеварение, оказывают положительное влияние на функцию кишечника, способствуют полноценному развитию ребенка.
Для прикорма идеально подходят каши «ФрутоНяня», которые обогащены инулином – природным пребиотиком, оказывающим положительный эффект на эвакуаторную систему кишечника. Каши и пюре «ФрутоНяня» изготовлены по специальной технологии, позволяющей сохранить все полезные вещества. Они содержат витамины и микроэлементы – йод, цинк, железо. Продукты для детей торговой марки «ФрутоНяня» демонстрируют хорошую переносимость, улучшают пищеварение, оказывают положительное влияние на функцию кишечника, способствуют полноценному развитию ребенка.
1. De Filippo C., Cavalieri D., Di Paola M. et al. Impact of diet in shaping gut microbiota revealed by a comparative study in children from Europe and rural Africa // Proc. Natl. Acad. Sci U S A. 2010. Vol. 107. № 33. P. 14691–14696.
2. Arumugam M., Raes J., Pelletier E. et al. Enterotypes of the human gut microbiome // Nature. 2011. Vol. 473. № 7346. P. 174–180.
3. Barbara G., Stanghellini V., Berti-Ceroni C. et al. Role of antibiotic therapy on long-term germ excretion in faeces and digestive symptoms after Salmonella infection // Aliment. Pharmacol. Ther. 2000. Vol. 14. № 9. P. 1127–1131.
4. Bouhnik Y., Neut C., Raskine L. et al. Prospective, randomized, parallel-group trial to evaluate the effects of lactulose and polyethylene glycol-4000 on colonic flora in chronic idiopathic constipation // Aliment. Pharmacol. Ther. 2004. Vol. 19. № 8. Р. 889–899.
5. Исаев Д.Н. Психосоматическая медицина детского возраста. СПб.: Специальная литература, 1996.
6. Антропов Ю Ф., Шевченко Ю.С. Психосоматические расстройства и патологические привычные действия у детей и подростков. М.: Институт психотерапии, 2000.
7. Тополянский В.Д., Струковская М.В. Психосоматические расстройства. М.: Медицина, 1986.
8. Chial H.J.1., Camilleri M., Williams D.E. et al. Rumination syndrome in children and adolescents: diagnosis, treatment, and prognosis // Pediatrics. 2003. Vol. 111. № 1. P. 158–162.
9. Campo J.V., Bridge J., Lucas A. et al. Physical and emotional health of mothers of youth with functional abdominal pain // Arch. Pediatr. Adolesc. Med. 2007. Vol. 161. № 2. P. 131–137.
10. Ropert A., Cherbut C., Roze C. et al. Colonic fermentation and proximal gastric tone in humans // Gastroenterology. 1996. Vol. 111. № 2. P. 289–296.
Новости на тему
20.02.2015
21.03.2014
Отправить статью по электронной почте
Ваш адрес электронной почты:
Адрес электронной почты получателя:
Разделите несколько адресов электронной почты запятой
Сообщение(не обязательно)
Не более 1500 символов
Анти спам:
Для предотвращения спама, пожалуйста, введите в поле слово, которое видите ниже.
Обновить код
* адреса предоставленные Вами будут использоваться только для отправки электронной почты.
Уважаемый посетитель uMEDp!
Уведомляем Вас о том, что здесь содержится информация, предназначенная исключительно для специалистов здравоохранения.
Если Вы не являетесь специалистом здравоохранения, администрация не несет ответственности за возможные отрицательные последствия, возникшие в результате самостоятельного использования Вами информации с портала без предварительной консультации с врачом.
Нажимая на кнопку «Войти», Вы подтверждаете, что являетесь врачом или студентом медицинского вуза.